https://www.sciencedirect.com/science/article/pii/S0006295222001095
Jerrold J. Heindel , Sarah Howard , Keren Agay-Shay, Juan P.Arrebola ,Karine Audouze,
Patrick J. Babin, Robert Barouki , Amita Bansal, EtienneBlanc , Matthew C.Cave , Saurabh Chatterjee, Nicolas Chevalier , Mahua Choudhury, David Collier lLisa Connolly mXavier Coumoul fGabriella Garruti nMichael Gilbertson o…Bruce Blumberg u
aAmbiente Saudável e Estratégias de Disrupção Endócrina, Commonweal, Bolinas, CA 92924, EUA
bLaboratório de Pesquisa em Saúde e Meio Ambiente (HER), The Azrieli Faculty of Medicine, Bar Ilan University, Israel
cDepartamento de Medicina Preventiva e Saúde Pública Universidade de Granada, Granada, Espanha
dDepartamento de Biologia de Sistemas e Bioinformática, Universidade de Paris, INSERM, T3S, Paris, França
eDepartamento de Ciências da Vida e da Saúde, Universidade de Bordeaux, INSERM, Pessac, França
fDepartamento de Bioquímica, Universidade de Paris, INSERM, T3S, 75006 Paris, França
gFaculdade de Saúde e Medicina, Universidade Nacional Australiana, Canberra, Austrália
hDivisão de Gastroenterologia, Hepatologia e Nutrição, Universidade de Louisville, Louisville, KY 40402, EUA
iLaboratório de Saúde e Doenças Ambientais, Universidade da Carolina do Sul, Columbia, SC 29208, EUA
jObstetrícia e Ginecologia, Universidade de Cote d’Azur, Cote d’Azur, França
kFaculdade de Farmácia, Texas A&M University, College Station, TX 77843, EUA
lBrody School of Medicine, East Carolina University, Greenville, NC 27834, EUA
mThe Institute for Global Food Security, School of Biological Sciences, Queen’s University, Belfast, Irlanda do Norte, Reino Unido
nDepartamento de Endocrinologia, Universidade de Bari “Aldo Moro”, Bari, Itália
oGrupo de Pesquisa em Saúde Ocupacional e Ambiental, Universidade de Stirling, Stirling, Escócia
pDepartamento de Ciências Ambientais e de Saúde Ocupacional, Escola de Saúde Pública, SUNY Downstate Health Sciences University, Brooklyn, NY 11203, EUA
qUniversidade McMaster, Departamento de Obstetrícia e Ginecologia, Hamilton, Ontário, CA, EUA
rCentro de Ciências da Saúde Ambiental, Mississippi State University, Mississippi State, MS 39762, EUA
sInstituto de Ciências da Saúde Ambiental e Departamento de Farmacologia, Wayne State University, Detroit, MI 48202, EUA
tUniversidade Sorbonne Paris Nord, Bobigny, INSERM U1124 (T3S), Paris, França
uDepartamento de Desenvolvimento e Biologia Celular, Universidade da Califórnia, Irvine, Irvine, CA 92697, EUA
vEpidemiologia Clínica, Departamento de Ciências Médicas, Hospital Universitário de Uppsala, Universidade de Uppsala, Uppsala, Suécia
WMedicina Ocupacional e Ambiental, Departamento de Ciências Médicas, Hospital Universitário de Uppsala, Universidade de Uppsala, Uppsala, Suécia
xDivisão de Endocrinologia, Departamento de Pediatria, University of California San Francisco, CA 94143, EUA
yDepartamento de Fisiologia e Farmacologia, Karolinska Institute, Solna, Suécia
zDepartamento de Ciência Animal, Escola de Ciências Ambientais e Biológicas, Rutgers University, New Brunswick, NJ 08901, EUA
aaDivisão de Endocrinologia, Diabetes e Metabolismo, Universidade de Illinois em Chicago, Chicago, Il 60612, EUA
abDepartamento de Epidemiologia, Universidade da Carolina do Norte em Chapel Hill, Chapel Hill, NC 27599, EUA
acNorris Cotton Cancer Center, Departamento de Biologia Molecular e de Sistemas, Geisel School of Medicine em Dartmouth, Líbano, NH 03756, EUA
adDepartamento de Citocinética, Instituto de Biofísica da Academia Tcheca de Ciências, Brno, República Tcheca
aeDivisão de Ciências Biológicas, The University of Missouri, Columbia, MO 65211, EUA
afUniv Rennes, INSERM EHESP, IRSET UMR_5S 1085, 35000 Rennes, França
Recebido em 20 de dezembro de 2021, revisado em 12 de março de 2022, aceito em 15 de março de 2022, disponível on-line em 5 de abril de 2022, versão do registro em 25 de abril de 2022 .
Destaques
- Há uma pandemia global de obesidade em expansão.
- Produtos químicos ambientais onipresentes chamados obesogênios desempenham um papel vital na pandemia de obesidade.
- A exposição a obesogênicos ocorre ao longo da vida, desde antes da concepção até a morte.
- O desenvolvimento fetal é o momento mais sensível para os obesogênicos impactarem o ganho de peso futuro ao longo da vida e gerações.
- Os obesógenos podem atuar por meio de mecanismos epigenéticos.
- Há uma necessidade de expandir a compreensão do paradigma obesogênico para médicos e consumidores.
Resumo
A obesidade é uma doença multifatorial com componentes genéticos e ambientais. A visão predominante é que a obesidade resulta de um desequilíbrio entre a ingestão e o gasto de energia causado por excessos e exercícios insuficientes. Descrevemos outro elemento ambiental que pode alterar o equilíbrio entre ingestão e gasto energético: os obesogênios (nt.: destaque em negrito feito pela tradução). Os obesógenos são um subconjunto de substâncias químicas ambientais que atuam como disruptores endócrinos afetando os desfechos metabólicos. A hipótese obesogênica postula que a exposição a esses disruptores endócrinos e outros produtos químicos pode alterar o desenvolvimento e a função do tecido adiposo, fígado, pâncreas, trato gastrointestinal e cérebro, alterando assim o ponto de ajuste para o controle do metabolismo. Os obesógenos podem determinar quanto alimento é necessário para manter a homeostase e, assim, aumentar a suscetibilidade à obesidade. O momento mais sensível para a ação obesogênica é no útero (nt.: novamente o destaque para a situação estar sendo gerada desde a fase fetal e com isso se determina que o ser que nasce já vem com essa determinação fisiológica da obesidade) e na primeira infância, em parte por meio de programação epigenética que pode ser transmitida às gerações futuras. Esta revisão explora as evidências que apoiam a hipótese do obesogênio e destaca as lacunas de conhecimento que impediram a aceitação generalizada como contribuinte para a pandemia de obesidade. Criticamente, a hipótese obesogênica muda a narrativa da cura da obesidade para a prevenção da obesidade.
Esta é a segunda de três revisões com foco na obesidade. O primeiro, Obesidade I, desenvolveu uma visão geral da obesidade com foco em causas e mecanismos. Obesidade III concentra-se em ensaios (nt.: já publicado nesse website) definir um produto químico como um obesogênio ou obesogênio potencial. Esta revisão, Obesidade II, concentra-se em evidências que apoiam a hipótese obesogênica, os obesogênios conhecidos e seus mecanismos de ação. Em seguida, discutimos lacunas de conhecimento e discrepâncias experimentais que dificultaram a aceitação da hipótese obesogênica como um contribuinte essencial para a pandemia de obesidade.
Resumo gráfico
Reduzir a exposição a obesogênios é uma estratégia para prevenir a obesidade.

1 . Introdução
1.1 . Obesidade
A obesidade é uma condição crônica e recidivante caracterizada pelo excesso de gordura corporal [1], [2]. A obesidade aumentou em todo o mundo em todos os países estudados nos últimos 50 anos e agora é considerada uma pandemia global [3]. Atualmente, o número de pessoas com sobrepeso e obesas é maior do que aquelas com baixo peso [4]. A obesidade resulta de um desequilíbrio energético a longo prazo caracterizado por uma mudança de peso em relação ao ponto de ajuste de altura para valores mais altos. É comumente definido por um Índice de Massa Corporal (IMC) acima de 30 kg/m2 nos países ocidentais. A visão predominante é que o desequilíbrio energético que caracteriza a obesidade é devido a excessos e exercícios insuficientes. No entanto, a obesidade é uma doença multifatorial com muitas causas subjacentes entrelaçadas, incluindo fatores genéticos e ambientais, componentes do expossoma (nt.: medida cumulativa de influências ambientais e respostas biológicas associadas, ao longo da vida, incluindo exposições do ambiente, dieta, comportamento e processos endógenos), como drogas, produtos químicos ambientais, estresse e microbioma intestinal alterado [2]. Há uma atenção crescente sobre o impacto de substâncias químicas ambientais chamadas obesogênios no desenvolvimento da obesidade.
Esta é a segunda de três revisões com foco na obesidade. O primeiro, Obesidade I, desenvolveu uma visão geral da obesidade com foco em causas e mecanismos. A Obesidade III concentra-se em ensaios para definir um produto químico como um obesogênios efetivo ou potencial. Esta revisão, Obesidade II, concentra-se em evidências que apoiam a hipótese obesogênica, os obesogênios conhecidos e seus mecanismos de ação. Em seguida, discutimos lacunas de conhecimento e discrepâncias experimentais que dificultaram a aceitação da hipótese obesogênica como um contribuinte essencial para a pandemia de obesidade.
1.2 . Substâncias químicas disruptores endócrinos (EDCs/endocrines disruptors chemicals)
Muitos milhares de produtos químicos são usados no comércio hoje, mas a maioria dos perigos para a saúde não foi caracterizada. Os tóxicos químicos têm vários modos de ação. Estes incluem letalidade específica ou não específica, toxicidade de órgãos, genotoxicidade e mutagenicidade através da sequência de DNA e alterações estruturais. Eles também podem interromper os níveis ou a ação dos hormônios, como os EDCs [5]. Estes disruptores endócrinos (EDCs) têm uma série de características-chave, incluindo a capacidade de interagir ou ativar os receptores hormonais, antagonizar os receptores hormonais, alterar a expressão do receptor hormonal, alterar a transdução de sinal em células responsivas a hormônios, induzir modificações epigenéticas em células produtoras de hormônios ou responsivas a hormônios, alteram a síntese hormonal, alteram o transporte hormonal através das membranas celulares, alteram a distribuição hormonal ou os níveis hormonais circulantes [6].
A Endocrine Society delineou a toxicidade dos EDCs, incluindo seus efeitos em uma variedade de doenças, em 2015 [7]. Atualmente, cerca de 1.000 produtos químicos são designados como EDCs [8]. Eles podem imitar as ações dos hormônios endógenos, mas seus efeitos podem não ser tão específicos quanto os hormônios que se ligam a receptores cognatos. O EDC bisfenol A (BPA), por exemplo, liga-se ao estrogênio (ER), androgênio (AR), tireóide (TR) e ao receptor-gama ativado por proliferador de peroxissoma (PPARγ) (nt.: organelas que exercem funções importantes no interior das células, têm enzimas digestivas responsáveis por oxidar substâncias orgânicas).
Os EDCs têm duas outras características que os distinguem da maioria dos outros tóxicos. Como os hormônios endógenos, eles podem agir em concentrações muito baixas, muitas vezes mais baixas do que as exposições ambientais conhecidas (nt.: esse aspecto muda completamente o paradigma de Paracelsus, médico da Idade Média, onde a relação era com a dose, sendo quem tornaria uma molécula veneno. Mas no seu tempo todas as moléculas eram naturais e essa situação de hoje, com o EDCs, se não a totalidade, a maioria das moléculas é artificial, sintética e desconhecida da natureza. E os hormônios agem em doses infinitesimais e com isso a dose fica para efeitos tóxicos, mas nunca hormonais!). Os EDCs, como os hormônios genuínos, podem provocar perfis de resposta à dose não monotônicos, onde os efeitos de doses baixas podem diferir dos efeitos de doses mais altas [9]. Tal dose-resposta não monotônica pode ser explicada pelo impacto dos EDCs em múltiplas vias mediadas por receptores, incluindo efeitos antagônicos em alguns com diferentes perfis de dose-resposta e efeitos no número de receptores e retorno, extinguindo a resposta em altas doses [10], [11].
1.3 . Obesogênicos
– 1.3.1 . Definição
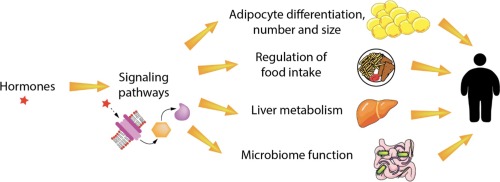
Os obesógenos são substâncias químicas que provocam aumento da massa de tecido adiposo branco (TAB) após exposição in vivo, revisado em [12], [13], [14], [15]. Os obesogênios potenciais são substâncias químicas que podem induzir a diferenciação de adipócitos in vitro, mas ainda não foram demonstrados que aumentem o acúmulo de WAT/white adipose tissue (nt.: armazena os triglicerídeos em uma única e grande gota lipídica que ocupa a porção central da célula, deslocando o citoplasma, núcleo e demais organelas para a periferia) in vivo. Os produtos químicos obesogênicos podem atuar diretamente na fisiologia do tecido adiposo, modulando o comprometimento das células-tronco, sua diferenciação em adipócitos e o tamanho do número e conteúdo de triglicerídeos dos adipócitos.
– 1.3.2 . Novidade
A exposição a produtos químicos obesogênicos é um fator pouco reconhecido e pouco estudado na pandemia de obesidade. De fato, muitos produtos químicos conhecidos por serem obesogênicos em modelos animais também foram associados ao aumento da prevalência de obesidade, BMI/body mass index (nt.: IMC – índice de massa corporal) e peso corporal em humanos [13]. A pesquisa nesta área floresceu, e inúmeras revisões recentes resumiram aspectos da pesquisa sobre obesogênios [por exemplo, [12], [14], [16], [17], [18], [19]]. Uma história do campo obesogênico foi publicada [20]. Os obesogênicos são predominantes em nosso ambiente e foram identificados em poeira, água, contaminação de alimentos, alimentos processados (incluindo aditivos alimentares), embalagens de alimentos, recipientes de alimentos e armazenamento, cosméticos e produtos de higiene pessoal, móveis e eletrônicos, poluição do ar e solventes, desinfetantes, agrotóxicos, protetores solares, plásticos e plastificantes, adoçantes não nutritivos, alguns antidepressivos e antidiabéticos e produtos domésticos comuns [7], [18] (Fig.1). (nt.: destaque em negrito feito pela tradução PARA DAR A DEVIDA ÊNFASE DE ONDE ESTÃO AS SUBSTÂNCIAS QUE SÃO OBESOGÊNICAS EM NOSSO DIA A DIA – ver a figura abaixo com a identificação desses produtos de consumo moderno).

Fig. 1 . Fontes de obesogênios. Esta figura mostra apenas algumas das principais classes de obesogênios, juntamente com algumas fontes de exposição. A exposição aos obesogênicos ocorre em casa e no trabalho; através do ar, água, alimentos e contato com a pele.
– 1.3.3 . Distúrbio metabólico
Os obesógenos podem ter efeitos mais diversos na saúde metabólica (por exemplo, diabetes tipo 2 –T2D, doença hepática gordurosa não alcoólica -DHGNA-, resistência à insulina) do que apenas contribuir diretamente para o aumento da massa gorda. Por exemplo, os obesogênicos podem modificar a taxa metabólica, a composição da microbiota intestinal e o controle hormonal do comportamento alimentar. Alguns obesogênios também afetam a função da tireoide, um mediador chave do metabolismo de carboidratos e lipídios, oxidação de gorduras, ingestão de alimentos e taxa metabólica de repouso. A maioria dos obesogênios é um subconjunto de uma classe maior de substâncias químicas denominadas substâncias químicas que interrompem o metabolismo (MDCs/metabolism disrupting chemicals), nem todas são obesogênicas, revisadas em [13], [20]. Considerando as diversas vias importantes para o desenvolvimento da obesidade, vale ressaltar que alguns produtos químicos classificados como obesogênicos não são EDCs, pois não influenciam a obesidade por meio de um modo de ação endócrino. Abaixo, resumimos o que se sabe sobre os mecanismos subjacentes à ação dos obesogênios, discutimos os obesogênios recém-identificados e produtos químicos potencialmente obesogênicos e propomos áreas essenciais para pesquisas futuras.
– 1.3.4 . Tempo de ação
O paradigma Developmental Origins of Health and Disease/DOHaD (nt.: uma forma nova de de tratar as doenças que se manifestam desde as fases pré-natais) inicialmente focou na nutrição alterada durante a gravidez e seus efeitos sobre doenças, incluindo obesidade mais tarde na vida [21]. Logo ficou claro que existem janelas sensíveis de vulnerabilidade para exposição a EDCs, incluindo obesogênios [22]. Essa sensibilidade aumentada aos obesogênios, durante o desenvolvimento fetal, resulta de múltiplos fatores de interação, incluindo plasticidade de desenvolvimento de tecidos metabólicos e controle central de comportamentos alimentares [23], remodelação epigenética, um sistema imunológico imaturo, falta de reparo de DNA e metabolismo hepático deficiente e parcialmente desenvolvido barreiras sangue-cérebro e sangue-órgãos. Esses fatores permitem que os produtos químicos tenham meias-vidas mais longas e alcancem tecidos normalmente inacessíveis [23]. O desenvolvimento é controlado por hormônios e fatores de crescimento que determinam quais genes são ativados e desativados de forma sincronizada, levando ao desenvolvimento de tecidos normais. Os EDCs, incluindo os obesogênicos, alteram a ação hormonal em momentos críticos, levando a mudanças nos padrões epigenéticos e na expressão gênica, resultando em maior suscetibilidade a doenças metabólicas e obesidade mais tarde na vida.
– 1.3.5 . Características
Várias características importantes da ação obesogênica durante o desenvolvimento incluem:
• Os efeitos podem ser mudanças epigenéticas sutis transmitidas através da linha germinativa para as gerações futuras (herança epigenética transgeracional). Eles podem não ser detectáveis sem abordagens moleculares sensíveis e/ou aparentes sem um desafio ou “segundo golpe” mais tarde na vida.
• Há uma latência entre a exposição e o início da doença, que pode durar de meses a anos ou décadas.
• Uma vez que a suscetibilidade à doença é provavelmente devido a alterações epigenéticas, os efeitos podem não ser reversíveis com as tecnologias atuais.
• Pode ser possível medir mudanças epigenéticas devido a exposições obesogênicas ao nascimento, mas algumas mudanças não se tornarão aparentes até mais tarde na vida.
• Os efeitos do obesogênio geralmente serão específicos do sexo.
• A exposição ao obesogênio pode interagir com genética, nutrição e outros estressores ambientais para alterar a incidência, suscetibilidade ou gravidade da doença.
A pré-concepção, a gravidez e a primeira infância são os momentos mais sensíveis para os obesógenos afetarem o desenvolvimento dos tecidos, levando à obesidade mais tarde na vida. No entanto, a exposição ao obesogênio na idade adulta também pode causar alterações que levam ao aumento da suscetibilidade à obesidade. De fato, as exposições durante a idade adulta também podem interagir com mudanças nutricionais e outros fatores ambientais para exacerbarem a suscetibilidade à obesidade devido a exposições durante o desenvolvimento. Há poucas evidências mostrando que os efeitos da exposição ao obesogênio na idade adulta podem persistir por toda a vida. Em contraste, as exposições no período do desenvolvimento podem provocar mudanças que persistem ao longo da vida e ao longo das gerações.
2 . Mecanismos subjacentes às ações obesogênicas
Estabelecer um nexo de causalidade entre exposição(ões) química(s) e obesidade requer a identificação de seu mecanismo de ação. Numerosos estudos tentaram delinear esses mecanismos e identificaram princípios gerais discutidos abaixo. Eles podem ser agrupados em várias classes representando diferentes estágios nos mecanismos de ação. 1) Mecanismos de longo prazo, incluindo vias epigenéticas responsáveis por efeitos intergeracionais e transgeracionais. 2) Mecanismos proximais que se concentram principalmente em alvos receptores. 3) Eventos intermediários como inflamação, estresse oxidativo ou proteínas intermediárias específicas que ligam a regulação do receptor a efeitos de longo prazo. 4) Mecanismos dependentes de órgãos destacam contribuições específicas de diferentes órgãos e tecidos críticos, como fígado, gordura e sistema nervoso.
2.1 . Mecanismos epigenéticos
A epigenética estuda os mecanismos hereditários e persistentes que controlam as mudanças na expressão gênica sem alterar a sequência do DNA. Cinco tipos principais desses mecanismos são atualmente compreendidos. Um envolve o próprio DNA, por exemplo, metilação do DNA; outro requer interação com as proteínas histonas em torno das quais o DNA é enrolado, por exemplo, metilação de histonas, um terceiro envolve RNAs não codificantes (ncRNAs), um quarto envolve modificação do RNA (por exemplo, metilação de RNA) e um quinto envolve uma ordem superior. estrutura da cromatina [24] , [25] , [26] (Fig.2). A metilação do DNA e as modificações das histonas serão discutidas na seção de mecanismos transgeracionais. Essas mudanças influenciam o epigenoma do corpo, variando entre vários tipos de células e passando por mudanças muito específicas e sincronizadas durante toda a vida [27]. As exposições ambientais no início da vida podem modificar o epigenoma e influenciar a expressão gênica dentro das gerações atuais e futuras.

Fig. 2 . Regulação epigenética da obesidade. As substâncias químicas mostradas são apenas representativas de todas as classes de substâncias químicas que são obesogênicas, e que podem atuar por meio de alterações no controle epigenético da expressão gênica, especialmente quando as exposições ocorrem durante o desenvolvimento fetal quando hormônios e fatores de crescimento estão controlando a diferenciação celular e tecidual. Os sistemas de controle epigenético conhecidos são mostrados: metilação de DNA, modificação de histonas, modelagem de cromatina e uma variedade de RNAs não codificantes.
Os obesógenos que atuam durante o desenvolvimento fetal provavelmente modificarão os mecanismos epigenéticos como parte de seu mecanismo de ação.
[NOTA DO WEBISTE: os próximos parágrafos até 2.2 tratam de aspectos muito específicos que, para os leigos são incompreensíveis. Podem ser desprezados, até 2.2.
Diferentes ftalatos têm sido implicados na adipogênese por meio de alterações nos mecanismos epigenéticos, incluindo efeitos de butil benzil ftalato (BBP) e diisobutil ftalato (DiBP) [28], [29]. Bisfenóis, incluindo bisfenol A, F e S, promoveram a obesidade por meio de mecanismos epigenéticos [30], [31].
Os ncRNAs são transcritos do DNA, mas não traduzidos em proteínas. Os ncRNAs regulam a expressão gênica nos níveis transcricional e pós-transcricional. Eles podem compreender ncRNAs curtos (menos de 30 nucleotídeos (nts)) e os ncRNAs longos (maiores que 200 nts). MicroRNAs (miRNAs), RNAs inibitórios curtos (19-22 nts) e RNAs de interação com piwi (21-31nts) são considerados RNAs não codificantes curtos [26]. Os ncRNAs regulam a expressão gênica no nível traducional, e evidências recentes indicam seu papel na metilação do DNA e nas modificações de histonas. Os ncRNAs têm sido associados a várias doenças, incluindo obesidade [26], [27], [32], [33]. Os ncRNAs longos (lncRNAs) desempenham um papel regulador significativo durante o desenvolvimento [34] e exibem expressão específica do tipo de célula [35], [36].
As entradas para lncRNAs relacionados a doenças no lncRNA e Disease Database (lncRNADisease: https://www.cuilab.cn/lncrnadisease) aumentaram de 63 entradas para mais de 2.900 entradas verificadas experimentalmente nos últimos anos [37]. Vários lncRNAs são expressos diferencialmente no tecido adiposo ou gordura em indivíduos obesos e estão associados à adipogênese [38], [39]. O lncRNA RP11-20G13.3 foi positivamente associado com leptina, proteína C reativa de alta sensibilidade (PCR), colesterol de lipoproteína de baixa densidade (LDL), insulina em jejum, relação cintura-quadril, circunferência da cintura e IMC. Menor IMC, circunferência da cintura, insulina em jejum e triglicerídeos foram associados a níveis mais altos de expressão de lncRNA GYG2P1 [40].
Embora a ligação entre obesidade e ncRNAs seja aceita, há evidências limitadas para a regulação de miRNA/lncRNA da obesidade. O tetrabromobisfenol A (TBBPA) induziu miR-107 e miR-103, reduziu a expressão de Thy1 e promoveu adipogênese [41]. lncRNA, miRNA e RNA nucleolar pequeno foram diferencialmente expressos em adipócitos primários humanos expostos a baixas e altas doses de bisfenóis [30]. Finalmente, a exposição ao BBP foi associada à desregulação metabólica e alterações no lncRNA H19 e seus miRNAs alvo [29]. Mais dados são necessários para fundamentar essas associações, e estudos que investigam o papel do mi/lncRNA na mediação do impacto de diferentes EDCs na obesidade são necessários. ]
2.2 . Herança transgeracional da obesidade
[NOTA DO WEBSITE: texto abaixo muito específico, compreensível para os iniciados. Vale a pena saber-se que há transmissão entre gerações.
A herança transgeracional refere-se à herança de um fenótipo resultante de uma exposição ambiental à qual a geração que expressa o fenótipo não foi exposta [42]. A exposição de fêmeas de mamíferos F0 grávidas durante a gravidez a um estressor químico ou ambiental (por exemplo, fome) afetará diretamente a geração F1, que foi exposta in utero e a geração F2, que foram expostas diretamente como células germinativas em desenvolvimento nos embriões F1. Os efeitos das exposições diretas são denominados multi ou intergeracionais. A geração F3 nunca foi exposta e os efeitos são considerados transgeracionais. A exposição de fêmeas não grávidas ou machos afeta diretamente apenas a geração F1 através das células germinativas; assim, os efeitos vistos em F2 são transgeracionais. Os efeitos em vertebrados não mamíferos, como peixes e invertebrados, seguem esse padrão.
Há evidências experimentais consideráveis que apoiam a herança transgeracional da obesidade. Camundongos F0 prenhes expostos a tributilestanho/TBT (nt.: biocidas contra organismos que aderem aos cascos principalmente em embarcações. Agridem violentamente a vida marinha. Banido, mas seus efeitos ainda permanecem) durante a gravidez [43] ou durante a gravidez e lactação [44] produziram descendentes com tamanho aumentado de WAT (nt.: white adipose tissue) com mais e maiores adipócitos brancos, particularmente em machos, através das gerações F3 e F4, respectivamente. Os efeitos transgeracionais do TBT também foram aparentes como impressões digitais metabolômicas alteradas em homens e mulheres F3 e F4. Embora as fêmeas não tenham se tornado obesas, elas tiveram um metaboloma alterado indicando efeitos transgeracionais [45]. Isso foi acompanhado por regulação positiva de genes associados ao armazenamento e transporte de lipídios, lipogênese e lipólise, bem como fígado gorduroso [43]. Estudos com vários produtos químicos mostraram que o fenótipo obeso pode ser transmitido transgeracionalmente [46], [47], [48], [49]. Roedores expostos à poluição do ar (matéria particulada fina, PM2,5), diclorodifeniltricloroetano (DDT), combustível de aviação (JP-8), BPA, di(2-etilhexil) ftalato (DEHP) e dibutil ftalato (DBP) [31], [46], [47], [48], [50], [51] exibiram uma incidência aumentada de obesidade de início na idade adulta, juntamente com inúmeras outras patologias. Fome ou estresse de F0 C.elegans induziu metabolismo alterado na geração F3 [52], [53]. A exposição multigeracional ao bisfenol S (BPS) em C.elegans promoveu o armazenamento de gordura ao longo de quatro gerações [54]. A exposição prolongada a altas doses de F0 Drosophila melanogaster ao DEHP levou a um aumento do peso corporal da prole [55]. Juntos, esses estudos indicaram que a exposição a obesogênios pode levar à herança transgeracional da obesidade.
Possíveis mecanismos que foram propostos para a herança transgeracional em geral e especificamente para a herança transgeracional da obesidade incluem mutações epigenéticas (epimutações), como a metilação do DNA [42], a herança da metilação de histonas [56], retenção de histonas [57], [ 58], a transmissão de pequenos RNAs não codificantes (ncRNAs) em machos [59] e estrutura de cromatina de ordem superior alterada [44]. Blocos de DNA diferencialmente metilado denotados como iso blocos metilados diferencialmente direcionais (isoDMBs) foram observados em camundongos machos da geração F4 após exposição a F0 TBT. As regiões, onde os isoDMBs foram submetilados em comparação com os controles, foram enriquecidas em genes metabólicos como a leptina e menos acessíveis do que os controles em espermatozóides F3 e espermatozóides F4 dos mesmos animais [60]. Portanto, a exposição ancestral ao TBT foi proposta para resultar em mudanças hereditárias na estrutura da cromatina de ordem superior, levando ao aumento da expressão de genes adipogênicos e metabólicos no WAT em comparação com os controles [44] , [60]. A reconstrução transgeracional da estrutura de cromatina de ordem superior alterada oferece um modelo unificador atraente de como mecanismos díspares, como metilação de DNA, metilação de histonas, retenção de histonas e expressão de ncRNA, podem ser coordenados entre as gerações. No entanto, mais pesquisas são necessárias para delinear os mecanismos pelos quais isso ocorre. ]
2.3 . Mecanismos do receptor
Demonstrou-se que os obesógenos ativam ou antagonizam a ação de receptores hormonais nucleares, que são fatores de transcrição modulados por ligantes que regulam diretamente a expressão de genes envolvidos na diferenciação de adipócitos, peso corporal e metabolismo.
[NOTA DO WEBSITE: todas as explicações abaixo novamente são complexas para os leigos até o 2.4.
2.3.1 . Gama do receptor ativado por proliferador de peroxissoma
O regulador mestre da adipogênese é o receptor γ ativado por proliferador de peroxissoma (PPARγ) [61]. Há fortes evidências de que a ativação desse receptor leva à obesidade, sendo os exemplos mais marcantes as drogas tiazolidinedionas (nt.: também conhecidas como glitazonas, são uma classe de fármacos usados no tratamento de diabetes mellitus tipo 2 e outras enfermidades relacionadas). Várias substâncias ambientais que se ligam a esse receptor apresentam efeitos obesogênicos. Plastificantes ftalatos e BPA e seus análogos, produtos químicos retardadores de chama, substâncias per e poli fluoroalquil (PFAS) e TBT estimulam a adipogênese (nt.: destaque dado pela tradução para novamente frisar onde estes obesogênios aparecem em nossas casas) através da via PPARγ [45], [62], [63], [64], [65] abordados em mais detalhes abaixo. Os efeitos dos obesogênios mediados pelo PPARγ não se limitam ao tecido adiposo. Por exemplo, o TBT demonstrou promover hepatomegalia e níveis de triglicerídeos no fígado (TG) em peixe-zebra [66].
2.3.2 . Receptor Retinóide X
O receptor retinóide X (também conhecido como receptor de ácido retinóico 9-cis , RXR) heterodimeriza com muitos receptores nucleares (NRs), incluindo PPARγ, apoiando um papel chave para RXR na adipogênese [67]. A ativação do RXR pode promover tanto a diferenciação adipogênica quanto a proliferação de pré-adipócitos [68], [69]. O obesogênio TBT é um potente ativador de RXR e um agonista parcial de PPARγ levando a um aumento do número de adipócitos [70], [71]. A diferenciação de adipócitos induzida pela ativação de RXR por TBT ou outros ativadores de RXR (chamados rexinóides) parece criar adipócitos funcionalmente distintos daqueles gerados via PPAR [72], [73], [74] com diminuição da captação de glicose, expressão de adiponectina e vias de escurecimento alteradas. A ativação do heterodímero RXR:PPARγ pelo TBT, que foi proposto para ser mediado principalmente pelo RXR, leva tanto ao acúmulo de lipídios quanto à indução de genes lipogênicos no fígado do peixe-zebra [66].
[NOTA DO WEBSITE: esses dois itens seguintes tratam de aspectos fisiológicos que interessam por serem relacionados à ação de hormônios feminizantes e masculinizantes nos organismos. Relacionados com a presença de EDCs na fase de definição fisiológica dos sexos, na fase embrionária.
2.3.3 . Estrogênios/receptores de estrogênio
Os estrogênios exibem efeitos complexos no metabolismo e na obesidade, dependendo parcialmente do momento da exposição. Os estrogênios atuam via receptores nucleares ERα e ERβ e receptores de membrana [75]. O tecido adiposo humano contém receptores de estrogênio de membrana e nucleares [76]. Eles podem afetar a saúde metabólica inibindo a lipogênese de adipócitos e modulando o gasto de energia e o consumo de alimentos por meio de ações no cérebro [77]. Os estrogênios promovem a proliferação de pré-adipócitos e regulam o número de adipócitos [78], [79], presumivelmente mediados pelo receptor do fator de crescimento de insulina (IGF) 1 (IGF1-R) e PPARγ [78]. Durante o desenvolvimento fetal, a exposição ao dietilestilbestrol (DES), um estrogênio sintético, está associada a um risco aumentado de obesidade [80]. O BPA e seus análogos são obesogênicos que atuam pelo menos parcialmente via receptores de estrogênio nuclear e associados à membrana [81]. De fato, o BPA inibe a liberação de adiponectina de explantes (nt.: fragmentos de tecidos fora dos organismos para pesquisas) de tecido adiposo humano e adipócitos em concentrações nanomolares, sugerindo que atua através do receptor de estrogênio da membrana [76].
2.3.4 . Andrógenos/receptor de andrógenos
Os andrógenos desempenham um papel fundamental na adipogênese. Eles são considerados anti-obesogênicos [82], [83] porque a diminuição da ação androgênica está associada ao aumento da adiposidade. Um antiandrogênico não esteroidal, a flutamida, promoveu o acúmulo de triglicerídeos em pré-adipócitos 3T3-L1 [69].
2.3.5 . Receptor de glicocorticóide
O receptor de glicocorticóide (GR) tem um papel no metabolismo lipídico e na formação de adipócitos [84]. O agonista de GR, dexametasona, promove acúmulo de triglicerídeos e proliferação de pré-adipócitos em modelos mesenquimais e pré-adipócitos [69] , [85] , enquanto os antagonistas de GR inibem a adipogênese [86] . O fungicida tolilfluanida é um obesogênico que funciona via ativação de GR [87] .
2.3.6 . Receptores da tireoide
O receptor da tireoide (TR) é essencial para a manutenção do metabolismo de lipídios e carboidratos, pressão arterial e massa corporal [88], [89], [90]. O TR regula a taxa metabólica basal e a termogênese no tecido adiposo marrom (BAT) [91]. As isoformas do receptor (α, β1, β2) desempenham papéis distintos com o TRα regulando principalmente a termogênese, enquanto o TRβ regula principalmente o metabolismo do colesterol e a lipogênese [89]. O TRβ também governa genes essenciais para a proliferação e diferenciação de pré-adipócitos [89]. Bisfenóis e PFAS são obesogênios que podem atuar via TR em larvas de peixe-zebra [81].
2.3.7 . Receptor constitutivo de androstano e receptor pregnano X
O receptor constitutivo de androstano (CAR) e o receptor X de pregnano (PXR) são receptores enriquecidos no fígado relacionados que regulam o metabolismo xenobiótico, bem como a homeostase da glicose e energia, função imunológica e metabolismo lipídico [92], [93]. O PXR atua regulando a expressão do PPARγ [93], enquanto a ativação do PPARα induz a expressão do CAR [94]. Os bifenilos policlorados (PCBs) atuam indiretamente via CAR/PXR [95], assim como alguns agrotóxicos [96].
2.3.8 . Receptor Farnesóide X
O receptor farnesóide X (FXR, também conhecido como receptor de ácidos biliares) regula a síntese de ácidos biliares e outros receptores associados a ácidos biliares [97], [98], [99]. É expresso em adipócitos maduros e células 3T3-L1 diferenciadas [100]. Os agonistas de FXR aumentam a diferenciação de adipócitos e aumentam a sinalização associada à insulina [100], [101]. Os obesogênios ácido perfluorooctanóico (PFOA) e ácido perfluorooctanosulfônico (PFOS) induzem a expressão de genes normalmente regulados por FXR [102] (nt.: lembrar que esses dois ácidos citados como têm flúor, são ‘forever chemicals’).
2.3.9 . Receptor de hidrocarboneto aril
O receptor de hidrocarboneto aril (AhR) é um membro da superfamília de reguladores transcricionais de hélice básica (bHLH)–PER-ARNT-SIM (PAS) [103]. Convertem sinais em resposta a estímulos ambientais [103].
A sinalização do AhR na desregulação do metabolismo é observada na obesidade induzida por dieta e obesogênio. A inibição do AhR pode prevenir e reverter a obesidade. A ativação de AhR em células-tronco mesenquimais (MSC) por benzo[a]pireno (BaP) inibiu a diferenciação de adipócitos terminais por regulação negativa da sinalização PPARγ e redução da expressão de genes adipogênicos [104]. O antagonismo de AhR pela alfa-naftoflavona anulou a inibição da adipogênese mediada por AhR [104]. Os PCBs podem atuar como agonistas de AhR. Em geral, os efeitos in vitro dos ligantes AhR na adipogênese não parecem ser consistentes e dependem do sistema celular; no entanto, esses ligantes podem induzir citocinas inflamatórias e distúrbios metabólicos [105] in vivo.
2.3.10 . Outras vias de sinalização
Os obesógenos e os EDCs também podem atuar interrompendo os sinais não hormonais, como as vias do receptor quinase a jusante da sinalização do fator de crescimento, sinalização do neurotransmissor, processos de sinalização do desenvolvimento, um conceito conhecido como “toxicidade do sinal” [106] . Esta área é atualmente inexplorada para EDCs, mas pode abranger outras vias possíveis para a ação obesogênica. ]
2.4 . Efeitos específicos de órgãos
2.4.1 . Adipócitos
Todos os obesogênios aumentam direta ou indiretamente o número e/ou tamanho das células adiposas. Conforme descrito acima, existem fortes evidências para conectar cada um dos dez receptores nucleares com alterações nos adipócitos. A literatura atual sobre adipócitos concentra-se no uso de linhagens 3T3-L1 murinas e adipócitos de origem humana ou MSCs para examinar o mecanismo de produção de adipócitos in vitro . A replicação e expansão desses dados e técnicas para obesogênios in vivo forneceriam mais informações sobre como os obesogênios promovem a obesidade no nível dos adipócitos.
2.4.2 . Fígado
O fígado é o principal órgão para o metabolismo e desintoxicação intermediário e xenobiótico. As exposições químicas industriais estão associadas a várias lesões hepáticas. A forma histológica mais comum de patologia hepática é a doença hepática gordurosa (FLD/fatty liver disease) [107], [108], [109]. A DHGNA é a manifestação hepática da obesidade e da síndrome metabólica. A mortalidade por doença cardiovascular (DCV) é a principal causa de morte em pacientes com DHGNA.
A esteato-hepatite associada a toxicidade (TASH) foi cunhada para descrever a FLD/fatty liver disease associada à resistência à insulina em indivíduos não obesos com exposições ocupacionais de cloreto de vinil de alto nível [110] (nt.: lembrar que aqui estão todos os PVCs, do filme plástico de embalar alimentos ao corpo da Barbie, à cortina do banheiro, ao piso vinílico, etc). A TASH foi associada a outras exposições químicas ambientais, incluindo poluentes orgânicos persistentes (POPs), compostos orgânicos voláteis, material particulado, metais, BPA, fungicidas, herbicidas à base de glifosato e dinoseb [13], [109], [111], [112]. Algumas exposições, como 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD ou dioxina) ou altas doses de cloreto de vinil/PVC, são suficientes para causar esteatose hepática. Um biomarcador urinário de exposição ao cloreto de vinil foi associado ao aumento da DHGNA pediátrica e fibrose hepática adulta em residentes que vivem perto de um complexo petroquímico em Taiwan [113], [114]. Outras exposições, como os PCBs orto – substituídos, comprometem o fígado, exacerbando a FLD induzida pela dieta. A esteatose hepática aumenta os níveis de PCB no fígado, possivelmente aumentando sua hepatotoxicidade [115]. Vários medicamentos prescritos também foram implicados no desenvolvimento de FLD [116].
Em estudos epidemiológicos e modelos animais, os PCBs foram associados à FLD [109]. Os PCBs foram implicados na ativação de ligantes de receptores xenobióticos hepáticos e metabolismo intermediário (por exemplo, AhR, CAR ou PXR) e parecem ser antagonistas competitivos do receptor do fator de crescimento epidérmico (EGFR). A inibição da sinalização de fosfoproteínas a jusante do EGFR é responsável pela ativação indireta do CAR associada a esses compostos [95], [117]. A terapia com fator de crescimento epidérmico (EGF) melhorou a inflamação hepática e a fibrose em um modelo de camundongo de esteato-hepatite relacionada ao PCB, mas paradoxalmente piorou a hiperglicemia e a dislipidemia [118]. Para complicar ainda mais, a indução de genes alvo CAR, AhR e PXR hepáticos por PCBs foi recentemente demonstrado ser parcialmente dependente do microbioma intestinal [119]. Os mecanismos cada vez mais complexos pelos quais as exposições a PCBs e TCDD/dioxina reprogramam a expressão gênica que afetam a NAFLD/non-alcoholic fatty liver disease merecem uma investigação mais aprofundada.
Os PFAS foram associados à DHGNA em adultos humanos [120], populações pediátricas [121], [122] e um modelo de camundongo PPARα humanizado. A exposição do desenvolvimento ao TBT foi associada ao aumento da esteatose hepática e tumores em camundongos machos, mas não fêmeas [123]. As exposições in vitro de TBT aumentaram os lipídios hepáticos na linhagem de células hepáticas humanas, HepaRG [124]. Plastificantes BPA, BPS e DEHP têm sido associados com NAFLD em modelos de peixe-zebra [125], [126], [127].
O DM2 é um fator clínico primário da gravidade da doença DHGNA. Os obesógenos que pioram a resistência à insulina podem aumentar a gravidade da DHGNA por meio desse mecanismo. No entanto, o próprio fígado é um órgão endócrino que libera hepatocinas que afetam a fome, o metabolismo sistêmico e as doenças associadas à obesidade. Estudos experimentais recentes demonstraram associações entre exposições a PCB ou triclosan e hepatocinas (por exemplo, Fgf21, Igf1 e betatrofina) em sistemas modelo FLD [128] , [129] . Assim, a NAFLD pode ser tanto um efeito quanto uma causa da disruptura endócrina sistêmica associada a exposições químicas ambientais.
2.4.3 . Músculo esquelético
O músculo esquelético desempenha um papel crítico no desenvolvimento de doenças metabólicas, incluindo a obesidade, uma vez que consome a maior parte da glicose do corpo e é um órgão alvo da insulina. Portanto, quaisquer distúrbios crônicos nas células musculares podem contribuir para a resistência à insulina e subsequente obesidade. Os obesógenos podem afetar a utilização de glicose no músculo esquelético. O BPA altera a homeostase da glicose na transdução do sinal de insulina nas células musculares em camundongos [130], [131], e o TBT reduz a expressão do receptor de insulina e GLUT4 no músculo esquelético em camundongos [132].
2.4.4 . Outros mecanismos
Além de ativar receptores no tecido adiposo, músculo esquelético e fígado, os obesogênios podem interromper a função de outros tecidos e vias que não são diretamente ativados por receptores hormonais específicos, mas podem levar à obesidade.
2.4.5 . Microbioma intestinal
A composição da microbiota intestinal pode ser alvo de obesogênios [133], [134]. Estes incluem metais pesados, nanopartículas e vários obesogênios conhecidos: BPA (e até certo ponto outros bisfenóis), estrogênios naturais, ftalatos, congêneres de PCB individuais e suas misturas, hidrocarbonetos aromáticos policíclicos (PAHs), PFAS, retardadores de chama bromados, agrotóxicos, dibenzo policlorado-p-dioxinas e dibenzofuranos (PCDD/Fs) [133], [134] e poluição do ar. Esses efeitos podem ser exacerbados quando combinados com excesso de nutrientes, como em uma dieta rica em gordura (ocidental). A ação química ambiental na composição da microbiota intestinal e a disbiose resultante podem afetar profundamente o metabolismo do hospedeiro, contribuindo assim para a interrupção metabólica para o aparecimento de múltiplas doenças metabólicas [133], [134], [135]. Recentemente, descobriu-se que a delta-valerobetaína derivada do microbioma é um obesogênio dependente da dieta correlacionado com a massa de IVA em humanos. A delta-valerobetaína inibiu a oxidação de ácidos graxos mitocondriais [136]. Além disso, alterações no microbioma podem alterar a biodisponibilidade dos obesogênios, embora isso exija uma investigação formal.
2.4.6 . Ritmos circadianos
Os poluentes ambientais têm como alvo os reguladores (por exemplo, REV-Erβ ou PPAR) envolvidos no ciclo de retroalimentação transcricional-traducional que forma o mecanismo do relógio circadiano [137], [138], [139]. A exposição a esses xenobióticos pode levar a patologias metabólicas como obesidade ou DHGNA/doença hepática gordurosa não alcoólica. Demonstrou-se que o TCDDioxina interrompe a ritmicidade circadiana através da repressão dependente de AhR dos reguladores do relógio hepático em camundongos, resultando em metabolismo de carboidratos hepático alterado [137], [140]. A exposição à tolilfluanida (TF) em camundongos adultos levou ao aumento da massa gorda e do peso corporal e alteração dos ritmos circadianos [141]. O BPA também pode interromper os ritmos circadianos [142], [143], [144], [145].
Mais pesquisas são necessárias para explorar os EDCs e os distúrbios do relógio circadiano relacionados ao obesogênio e seu papel potencial na obesidade intergeracional. Mais recentemente, a exposição dos pais do peixe medaka Oryzias melastigma ao BaP [146] interrompeu os ritmos circadianos, que foram transferidos através das gerações.
2.4.7 . Inflamação
Numerosos produtos químicos ambientais perturbam a imunidade inata e promovem a inflamação, incluindo PCBs, bisfenóis, ftalatos, retardadores de chama, herbicidas e fungicidas [147], [148], [149]. Seus efeitos na inflamação foram documentados in vitro e in vivo . Suas ações também podem afetar as reações inflamatórias indiretamente por meio de alterações do microbioma intestinal e/ou ruptura da barreira intestinal [147], [150], [151]. Os efeitos de perturbação imunológica dos poluentes podem perturbar o equilíbrio do sistema imunológico inato, o que contribui para a inflamação crônica tanto sistemicamente quanto em órgãos individuais envolvidos no controle do metabolismo energético.
2.4.8 . Estresse mitocondrial/oxidativo
O estresse oxidativo foi proposto para contribuir para a obesidade e distúrbios metabólicos relacionados à obesidade [152]. O WAT/white adipose tissue pode contribuir para estados pró-inflamatórios e estresse oxidativo dependendo de sua localização. O excesso de WAT pode aumentar a concentração de ácidos graxos livres (AGL) no soro, levando à desregulação do metabolismo da glicose e acúmulo de substratos energéticos como glicose e ácidos graxos (AG). O acúmulo de WAT no fígado e nos músculos pode desencadear a oxidação mitocondrial e peroxissomal, aumentando as espécies reativas de oxigênio (ROS/reactive oxygen species) [152]. As mitocôndrias são um local primário de produção de espécies reativas através da cadeia de transporte de elétrons (ETC) devido ao seu papel essencial na via de fosforilação oxidativa da síntese de ATP [153]. A produção fisiológica de ROS mitocondriais (mtROS) é contrabalançada por enzimas antioxidantes, incluindo catalase e glutationa peroxidase [153]. Esse equilíbrio pode ser alterado em situações patológicas ou exposição a tóxicos ambientais, levando ao aumento da produção de mtROS [154], [155]. Hepatócitos humanos HepaRG esteatóticos expostos a uma mistura de BaP/etanol em baixas doses mostram aumento da produção de mtROS e diminuição da atividade do complexo I, II e IV provavelmente via ativação de AhR [156]. Obesogênios como arsênio, atrazina, BPA, BBP, cádmio (Cd), clorpirifós, DEHP, PFOA, PFOS, TCDD e TBT foram relatados para atingir as mitocôndrias resultando em bioenergética mitocondrial alterada, massa e produção excessiva de ROS, causando morte celular e resistência à insulina [155]. Mudanças na epigenética mitocondrial (por exemplo, metilação do mtDNA) podem ser importantes na indução de disfunção mitocondrial e estresse oxidativo relacionado [157].
2.4.9 . Sirtuínas
Sirtuínas (SIRTs) são uma família conservada de proteínas presentes na maioria das espécies que funcionam como sensores de energia e efetores de transcrição controlando a acetilação de histonas [158], [159]. As SIRTs constituem um importante elo biológico entre o estado energético e a regulação epigenética. As SIRTs são expressas em tecidos envolvidos na regulação metabólica, como fígado, músculo esquelético e tecido adiposo. SIRT1 é um regulador fisiológico crítico que medeia o metabolismo, o estresse oxidativo e a apoptose (nt.: auto determinação da morte celular, ‘suicídio’ celular) [160]. SIRT3 funciona nas mitocôndrias para regular o metabolismo energético e a secreção de insulina [161], [162]. SIRT1 e SIRT2 estimulam a lipólise no WAT durante o jejum. SIRT3 estimula a termogênese no tecido adiposo marrom [162]. A atividade hepática de SIRT1 e SIRT3 está diminuída em modelos animais alimentados com uma dieta rica em gordura (HFD) por longos períodos que desenvolvem FLD [158], [163]. O BBP baixou SIRT1 e SIRT3 e induziu hiperacetilação de proteínas na adipogênese celular e em modelos de fígado gorduroso in vitro [164], [165]. Os reguladores da biogênese mitocondrial PGC-1α, NRF-1 e NRF-2 também foram diminuídos em ambos os modelos. Assim, os obesógenos podem aumentar a adipogênese e a desregulação metabólica, alterando reguladores epigenéticos críticos como as SIRTs.
2.5 . Comportamento alimentar e dependência alimentar
Vários estudos demonstraram que as exposições durante o desenvolvimento fetal a obesogênios, particularmente BPA, influenciaram o sistema de recompensa dopaminérgico e a rede de impulsividade do córtex [166]. A exposição ao BPA em crianças foi associada com hiperatividade e transtorno de déficit de atenção e hiperatividade (TDAH) [167], que envolve os mesmos circuitos neurológicos. Ainda assim, este estudo não considerou a compulsão alimentar e/ou dependência alimentar. Um estudo transversal recente de pacientes obesos descobriu que as concentrações séricas de bisfenol A bis(2,3-diidroxipropil) éter (BADGE.2H20) estavam positivamente associadas à incidência de transtorno de compulsão alimentar periódica [168]. Como as regiões cerebrais associadas ao sistema de recompensa dopaminérgico expressam alvos obesogênicos [169], [170], [171], estudos futuros sobre a relação entre exposição ao obesogênio, transtornos de compulsão alimentar e dependência alimentar em modelos animais seriam valiosos.
3 . Evidências que apoiam o conceito obesogênico
Cerca de 50 produtos químicos e classes de produtos químicos são classificados como obesogênicos. Veja revisões recentes [12], [15], [17], [172], incluindo uma revisão sistemática e metanálise [173] e uma avaliação de obesogênios entre os jovens de origem latina ou hispânica nos Estados Unidos e na América Latina [174]. Esta seção descreve os obesogênicos com o suporte mais experimental e evidências robustas de efeitos sobre a obesidade. Os produtos químicos detalhados abaixo têm in vitro, dose-resposta animal e dados mecanísticos, juntamente com dados humanos de apoio. Experimentos em modelos animais podem mostrar causa e efeito, ligando um produto químico ao aumento da adipogênese e da obesidade. A Tabela 1 (nt.: por sua especificidade complexa, foi excluída nessa tradução) integra as evidências para obesogênios. Ao avaliar o peso da evidência de que um produto químico é obesogênico, consideramos os seguintes fatores:
• Estudos positivos receberam mais peso do que estudos negativos.
• Estudos confirmados em repetição receberam mais peso do que estudos únicos.
• Espera-se que nem todos os estudos em animais concordem devido a diferentes tempos e vias de exposição, intervalo de doses testadas, tempo e sensibilidade dos parâmetros avaliados e antecedentes genéticos do modelo. Da mesma forma, não se espera que todos os estudos epidemiológicos concordem devido a diferenças nas exposições, avaliações de exposição, dados demográficos e desfechos avaliados.
• Estudos em modelos animais podem provar causa e efeito.
• A menos que haja dados em contrário, presume-se que os dados de animais extrapolarão para humanos.
• A exposição durante o desenvolvimento fetal a obesogênios provavelmente será mais impactante do que a exposição de adultos (nt.: fator importantíssimo porque estamos inviabilizando uma vida saudável e nornal para um ser que ainda nem nascer).
• Espera-se que os efeitos dos obesogênios sejam sexualmente dimórficos.
• Pode haver respostas de dose não monotônicas (nt.: para entendermos perfeitamente o que essa expressão quer dizer, é que não é a dose o que determina o dano desses disruptores já que atuam em baixas doses e não como na toxicologia clássica que será a dose que informará o nível de dano dos venenos. Aqui é importante termos essa compreensão bem clara para entendermos porque somos, no caso de nosso website, completa e totalmente contrários ao agrotóxicos. No mundo convencional da chamada agricultura química que sustenta o chamado agronegócio, a classificação dos agrotóxicos obedece essa visão superada da toxicologia clássica de causalidade entre dose e efeito tóxico) que devem ser consideradas fisiológica e endocrinológicamente plausíveis.
[NOTA DO WEBSITE: para melhor compreensão da curva não monotônica, anexamos esses quadros abaixo e que estão no link de busca do nosso website].
O quadro mostra os dois tipos de curvas dose-resposta, a curva monotônica e a não monotônica
Aqui está a mostra que é a baixa dose que afeta, como um hormônio natural que se chamará ‘dose fisiológica’, e que além daí será a ‘dose toxicológica’.
• Para obesogênios não persistentes, é difícil avaliar com precisão as exposições reais em estudos de epidemiologia humana, a menos que haja várias medições ao longo do período de avaliação. Medidas únicas podem levar a resultados errôneos. Vários outros fatores de confusão tornam mais complicado avaliar os impactos dos estudos epidemiológicos.
• Estudos longitudinais de coorte de nascimento são mais sensíveis e propensos a encontrar uma associação entre exposição e obesidade do que estudos transversais.
Tabela 1 . Esta tabela resume os principais achados dos estudos in vitro (em células-tronco, adipócitos ou hepatócitos), in vivo (em roedores ou peixe-zebra) e epidemiológicos (incluindo metanálises) discutidos no texto relacionados à adiposidade, lipídios ou fígado gordo. As revisões não são incluídas, a menos que sejam meta-análises, e os resultados de peso ao nascer não são incluídos.
[nota do website: informamos que não transcrevemos os dados da tabela por serem por demais específicos, se houver interesse, acesse o link original]
……………………………………………………………………..
4 . Os obesogênios mais relevantes
Esta seção discute os obesogênios mais relevantes e as evidências que sustentam seu impacto na obesidade. Tais evidências incluem dados que ligam a exposição ao obesogênio à formação de adipócitos in vitro e ganho de peso em estudos com animais e humanos.
4.1 . Produtos farmacêuticos
É bem conhecido que alguns medicamentos têm o efeito colateral de causar ganho de peso. Esses dados fornecem uma forte prova de conceito para a hipótese do obesogênio e estabelecem ligações causais entre a exposição química e o ganho de peso. A maioria dos exemplos de obesidade induzida por drogas deriva da exposição do adulto e não durante o desenvolvimento fetal.
Os antidepressivos são usados no tratamento da depressão moderada a grave. O uso prolongado de antidepressivos foi associado ao aumento da adiposidade abdominal e ganho de peso [175], [176]. Ainda não está claro se esses efeitos são secundários à hipercortisolemia de estresse e depressão. Esses efeitos também parecem ser específicos da droga [177]. Os inibidores seletivos da recaptação da serotonina (ISRSs), sertralina e escitalopram, foram associados ao ganho de peso/aumento da massa corporal, enquanto o uso de fluoxetina foi associado à perda de peso [177]. O antidepressivo tricíclico amitriptilina e o antagonista do receptor de serotonina Trazadona foram associados ao ganho de peso [178]. Os medicamentos antipsicóticos de segunda geração ou “atípicos” frequentemente usados na depressão grave também estão associados ao ganho de peso, levando à síndrome metabólica ou DM2 [179], [180]. Os mecanismos pelos quais os antidepressivos podem alterar o peso não foram totalmente elucidados; no entanto, a exposição a SSRI mostrou causar homeostase lipídica hepática anormal [181] e metabolismo desregulado de glicose e lipídios no tecido adiposo [182].
Alguns medicamentos antidiabéticos, incluindo tiazolidinedionas como rosiglitazona (ROSI), pioglitazona e sulfonilureias, também podem levar ao ganho de peso [183]. O ROSI provavelmente estimula o ganho de peso devido à sua ação como agonista do PPARγ: a ativação da via do PPARγ resulta na diferenciação de precursores em adipócitos [61]. Os betabloqueadores usados para controlar a pressão arterial [184] e os corticosteroides usados para tratar a inflamação também podem causar ganho de peso [185].
O DES é um medicamento estrogênico usado para prevenir abortos espontâneos da década de 1940 até a década de 1970. Em um modelo de camundongo, a exposição perinatal a doses baixas, mas não altas de DES resultou em obesidade na prole específica para mulheres quando adultas. O aumento do ganho de peso e o WAT visceral começaram na puberdade e, na idade adulta, os camundongos pesavam cerca de três vezes o peso dos controles [186]. A exposição pré-natal ao DES em humanos resultou em um leve aumento na obesidade adulta na prole [80].
4.2 . Fumar/nicotina
O uso global de tabaco é a segunda principal causa de doença; mais de 30 doenças e condições são causadas pelo tabagismo, incluindo obesidade em fumantes e expostos à fumaça do tabaco [187]. Os cigarros contêm nicotina, e é esse produto químico que leva à dependência. A nicotina se liga a receptores, incluindo a dopamina, levando à estimulação positiva e ao reforço do tabagismo. Nicotina, Cd/cádmio e BaP/benzo(a)pireno estão entre os produtos químicos da fumaça que têm sido associados à obesidade. Os extensos dados que ligam o tabagismo materno à obesidade na prole fornecem uma forte prova do princípio de que um produto químico ambiental pode ser um obesogênico.
4.2.1 . Estudos de peixe-zebra
A exposição do desenvolvimento ao Cd/cádmio aumenta a deposição lipídica em juvenis de peixe-zebra [188]. Embriões e peixes-zebra adultos expostos ao Cd por quatro semanas apresentaram hiperlipidemia grave e alterações no fígado gorduroso, mostrando que o Cd promove aumento da adiposidade e desenvolvimento de fígado gorduroso [189]. Larvas de peixe-zebra alimentados com HFD/high-fat diet para induzir obesidade, então co-expostos ao BaP/benzo(a)pireno e etanol desenvolveram esteato-hepatite. Portanto, a obesidade induzida por HFD atuou como um primeiro golpe para sensibilizar o sistema, e a exposição ao BaP/etanol forneceu um segundo golpe que promoveu o desenvolvimento de esteato-hepatite e inflamação [190].
4.2.2 . Estudos de roedores
A fumaça do cigarro contém mais de 7.000 produtos químicos, mas a maioria dos estudos em animais se concentrou nos efeitos da exposição à nicotina para entender como a exposição fetal à fumaça do cigarro pode aumentar a adiposidade e o risco de obesidade [191]. Os mecanismos subjacentes ao modo como a exposição precoce à nicotina ou à fumaça do cigarro provoca obesidade em animais são variados e incluem aumento da ingestão de energia, redução do gasto de energia e efeitos no desenvolvimento e função do tecido adiposo. A nicotina aumenta o estresse oxidativo, a apoptose hepatocelular e a lipogênese hepática, exacerbando a esteatose hepática desencadeada pela HFD em ratos [192] . A exposição precoce à fumaça do cigarro resultou em hiperfagia e uma maior referência a uma HFD em ratos [193]. Esses resultados são paralelos aos relatados em humanos após a exposição pré-natal à fumaça do cigarro [194]. Os neuropeptídeos hipotalâmicos alterados pela nicotina são importantes para o controle do apetite em estudos com animais [195], [196], [197] e podem funcionar de forma semelhante em humanos. A exposição precoce à nicotina também afetou o gasto de energia [198], talvez pelo “branqueamento” do BAT que reduziu a atividade do BAT [195], [199], [200]. A exposição pré-natal à nicotina também levou à expressão elevada de marcadores adipogênicos no WAT e aumento do armazenamento de lipídios no WAT e nos tecidos periféricos em ratos [191], [198], [199], [201]. Este efeito é central para o desenvolvimento de obesidade e resistência à insulina [202].
4.2.3 . Estudos humanos
Os dados epidemiológicos apoiam fortemente uma associação causal positiva e provável entre o tabagismo materno e o aumento do risco de obesidade ou sobrepeso na prole. O aumento da gordura corporal e da massa gorda também foi relatado em crianças nascidas de mulheres que fumam [203], [204], [205]. Uma meta-análise baseada em 39 estudos de 236.687 crianças relatou um risco aumentado de obesidade em crianças nascidas de mães que fumaram durante a gravidez (OR 1,55 agrupados) [206]. A análise de mais de 200.000 nascimentos únicos de 28 coortes de nascimentos relatou um risco aumentado de sobrepeso infantil (OR 1,42). Este efeito não foi alterado pela redução do número de cigarros fumados durante a gravidez [207].
Quando 77 diferentes exposições pré-natais, incluindo poluentes do ar interno e externo, ambiente construído, espaços verdes, tabagismo e biomarcadores de poluentes químicos foram examinados no estudo Human Early Life Exposome (HELIX) (N=1.301 pares mãe-filho de 6 coortes de nascimento na Europa), o tabagismo materno foi o único fator associado a um IMC infantil mais elevado [208]. Outro estudo correlacionou dados epidemiológicos com resultados obtidos no modelo de larva de peixe-zebra em que a exposição ao Cd aumentou a adiposidade, demonstrando que o Cd pode atuar como um obesogênico [188]. Esses dados corroboram as observações de que o tabagismo materno durante a gravidez é um fator de risco para obesidade na prole. Um estudo recente quantificou a dose-resposta entre tabagismo e obesidade e encontrou uma relação linear entre tabagismo materno (1-15 cigarros por dia sem aumento adicional após 15 cigarros) e obesidade da prole sem diferenças entre sexos observadas [209].
4.2.4 . Fumo passivo/fumo de segunda não/tabagismo ambiental
Pouco se sabe sobre a associação entre exposição passiva ou de segunda mão à fumaça do tabaco e obesidade. Uma recente meta-análise de onze estudos avaliou potenciais associações entre o fumo passivo (SHS) e o risco de aumento do IMC e da circunferência da cintura [210]. A SHS foi associada a um IMC global mais elevado (0,58 kg/m2). Houve uma associação mais forte entre SH e IMC em adultos (1,31 kg/m2) do que em crianças (0,47 kg/m2) ou adolescentes (0,54 kg/m2). Não foram mostradas associações significativas nos idosos. Algumas evidências ligam o tabagismo paterno ao sobrepeso infantil (OR 1,21) [207], mas essa associação é menos consistente entre os estudos [211]. Uma revisão sistemática revelou que a exposição ao SHS durante a gravidez estava associada a um IMC mais elevado ou excesso de peso em crianças em 4 de 7 estudos [212]. Resultados contrastantes foram observados entre países de alto e baixo RNB (renda nacional bruta per capita), com exposição SHS associada a IMC mais alto em países de RNB alto e IMC mais baixo em países de RNB baixo.
4.2.5 . Integração e resumo de evidências
O tabagismo ativo durante a gravidez fornece evidências robustas para obesogênios e a hipótese do obesogênio. O risco populacional de obesidade atribuível ao tabagismo materno foi estimado em 5,5% nos EUA e até 10% em áreas com taxas de tabagismo mais altas [213]. Portanto, evitar fumar durante a gravidez tem benefícios substanciais na prevenção da obesidade na prole e na redução de outros efeitos nocivos para mães e filhos. A exposição ao SHS durante a gravidez aumenta o risco de sobrepeso na prole, embora o efeito seja menor e menos consistente [214].
4.3 . Bisfenol A e análogos
O BPA é amplamente utilizado em plásticos (nt.: a resina é a policarbonato) e resinas epóxi (nt.: destaque em negrito é da tradução). O BPA livre também é um aditivo (plastificante) em uma ampla variedade de plásticos (por exemplo, cloreto de polivinila/PVC), em outros produtos para uso diário, em muitos materiais de contato com alimentos e como revelador que reveste a superfície de papéis térmicos dos quais é prontamente liberado [215] (nt.: importantíssimo ver onde estão essas moléculas em nosso dia a dia). O BPA está entre os produtos químicos de maior volume de produção detectados em ecossistemas, fluidos humanos e tecidos. O BPA tem recebido crescente atenção do público devido aos seus efeitos nocivos no desenvolvimento fetal, nos órgãos e processos de reprodução, metabolismo, sistemas cardiovascular e imunológico. O BPA foi classificado como uma substância de alta preocupação e seu uso é proibido ou restrito em alguns produtos, mas essas restrições diferem consideravelmente dentro e entre países.
Existem vinte e quatro análogos de BPA, incluindo BPS, bisfenol F (BPF), bisfenol B (BPB), bisfenol E (BPE) e bisfenol AF (BPAF). Alguns deles são usados como substitutos do BPA, mas devido à sua semelhança estrutural e funcional com o BPA, é provável que tenham impactos semelhantes na saúde [216], [217], [218]. As Ingestões Diárias Toleráveis (TDI) para BPA foram elaboradas (por exemplo, a Autoridade Europeia de Segurança Alimentar fixou o TDI de BPA em 4 µg/kg pc/dia). Valores de orientação modificados derivados de dados de biomonitoramento humano estão em desenvolvimento para o BPA em populações gerais e ocupacionais [219], [220], [221].
4.3.1 . Estudos in vitro
BPA, BPS e BPF induzem a diferenciação de adipócitos. Estudos in vitro usando o 3T3-L1 de camundongo, pré-adipócitos mostraram que o tratamento com BPA resultou em efeitos transitórios na metilação do promotor PPARγ e acúmulo de lipídios [222]. O GR também pode participar da resposta do BPA em células 3T3-L1 [87]. Estudos in vitro em células HepG2 hepáticas humanas mostraram que baixas concentrações de BPA promoveram acúmulo de lipídios nas células hepáticas, disfunção mitocondrial, alterações no metabolismo lipídico e inflamação [223]. Ao contrário do BPA, o BPS não induziu anormalidades metabólicas em linhagens celulares de hepatócitos [224]. A capacidade dos bisfenóis de se ligar a muitos NRs pode explicar os efeitos pró-adipogênicos associados ao BPA, BPF, BPS e BPAF na linhagem celular murina 3T3-L1 e pré-adipócitos humanos [225], [226], [227], [228 ].
O BPA também induziu respostas inflamatórias, lipogênese e diminuição da sensibilidade à insulina dos adipócitos [225], [229], indicando que produz um adipócito disfuncional in vitro . A indução de citocinas pró-inflamatórias como TNFα e IL6 em adipócitos e a redução da expressão do hormônio anti-inflamatório adiponectina causaram inflamação em explantes de adipócitos humanos cultivados [76].
4.3.2 . Estudos de peixe-zebra
A exposição crônica ao BPA induziu uma desregulação nos genes relacionados ao metabolismo lipídico, levando à esteatose hepática em juvenis de peixe-zebra. A exposição ao BPA induziu a DHGNA e promoveu a progressão da inflamação hepática, levando a um estágio patológico mais grave da DHGNA [125]. Em peixes adultos, exposições crônicas e agudas ao BPA, assinaturas de expressão gênica alteradas associadas à DHGNA, indicam distúrbios no metabolismo lipídico que podem promover o acúmulo de lipídios no fígado, daí a esteatose [230], [231], [232]. Da mesma forma, a exposição prolongada ao BPS aumentou o acúmulo de gordura no fígado, favorecendo assim o risco de aparecimento de DHGNA e promovendo esteatose simples a esteato-hepatite não alcoólica (NASH) via estresse de retículo endoplasmático[126]. A exposição a doses ambientalmente relevantes de BPS e BPF causou efeitos adversos semelhantes ao BPA em relação à interrupção do metabolismo [216], incluindo a interrupção do metabolismo dos triglicerídeos [233].
Dois BPAs halogenados, TBBPA e tetraclorobisfenol A (TCBPA), comumente usados como retardadores de chama, provocaram acúmulo de lipídios em larvas de peixe-zebra e ganho de peso tardio em peixes-zebra juvenis pela ativação de PPARγ [234]. A exposição a níveis ambientalmente relevantes de BPA ou TBBA em peixe-zebra levou à hiperfagia e obesidade em peixes adultos. Além disso, eles ativaram o receptor canabinóide CB1, que poderia ser parte do mecanismo que leva à obesidade [235]. Por último, a exposição ao BPA, BPF ou BPS em peixe-zebra confirmou as alterações de estrogênio, andrógeno e interrupção do hormônio da tireóide observadas in vitro [81], [236].
4.3.3 . Estudos de roedores
O BPA ingerido passa do intestino através dos vasos mesentéricos diretamente para o fígado, onde ocorre uma extensa conjugação de primeira passagem de fase II, resultando em conjugados hidrofílicos de BPA (principalmente BPA-glicuronídeo e BPA-sulfato) que são seletivamente excretados na urina. A exposição fetal e pós-natal ao BPA interrompeu permanentemente os sistemas metabólicos que regulam o peso corporal. Após o período fetal-neonatal de organogênese, o BPA mostrou perturbar os sistemas homeostáticos necessários para manter o peso corporal normal, incluindo consequências a longo prazo para camundongos fêmeas grávidas expostos ao BPA [237].
Uma revisão sistemática e metanálises realizadas em 61 estudos de roedores (ratos e camundongos) relataram os efeitos obesogênicos do BPA na gordura ou peso corporal, triglicerídeos e ácidos graxos livres [238]. Globalmente, uma associação positiva foi encontrada entre as exposições precoces de BPA e peso WAT, triglicerídeos ou FFA, e uma associação negativa com o peso corporal. Essas associações dependeram da cepa do animal, sexo, frequência, via, dose e janela de exposição. A exposição fetal a doses baixas (nt.: esse aspecto é importantíssimo porque altera totalmente o princípio da toxicologia clássica que relaciona dose e efeito. Aqui a dose é baixa e os efeitos são dramáticos), mas não altas de BPA causou aumento do peso corporal, ingestão de alimentos, número de adipócitos e regulação alterada da leptina, adiponectina, glicose e insulina [239]. A exposição do desenvolvimento de camundongos CD-1 a uma dose baixa (25μg/kg/dia) de BPA aumentou o peso corporal da prole masculina e feminina. A adição de BPA durante o período peripuberal aumentou a exposição pré-natal em mulheres [240]. A exposição pré-natal a uma dose baixa de BPA aumentou o peso corporal adulto associado a um aumento de 3 vezes no WAT parametrial e hipertrofia de adipócitos em ratas fêmeas Sprague-Dawley. Elas também exibiram aumento da expressão de genes lipogênicos: PPARγ, C/EBPα, lipoproteína lipase (LPL), proteína de ligação ao elemento regulador de esterol (SREBP-1C), ácido graxo de sintase (FAS) e estearoil-CoA dessaturase 1 (SCD-1 ) [241], [242].
A exposição ao BPA durante o desenvolvimento provocou ganho de peso a partir do aumento da ingestão de alimentos em modelos animais específicos, reduzindo o número de neurônios de saciedade e aumentando o número de neurônios de apetite no cérebro [243]. A exposição ao BPA durante o desenvolvimento através da dieta materna também pode influenciar o neurocircuito hipotalâmico da melanocortina que controla o comportamento alimentar em camundongos CD-1 [244]. Camundongos expostos ao BPA foram mais insensíveis aos efeitos da leptina na expressão da pró-opiomelanocortina (POMC) do que os controles. Eles exibiram uma redução na inervação POMC do núcleo paraventricular (PVN), resgatado pela administração de leptina pós-natal em mulheres. Machos e fêmeas expostos ao BPA foram resistentes aos efeitos da injeção de leptina no peso corporal [244]. A exposição pré-natal de ratos ao BPA prejudicou a tolerância à glicose, aumentou a ingestão de alimentos, aumentou o peso corporal e levou a alterações nos sinais hipotalâmicos que controlam a ingestão de alimentos [245].
A inflamação induzida pelo BPA pode ser uma parte essencial do mecanismo subjacente da ação do BPA. A exposição ao BPA em camundongos C57BL/6J adolescentes resultou na liberação de citocinas pró-inflamatórias, inflamação crônica de baixo grau e aumento do peso corporal e da gordura [147], [246]. A prole F1 e F2 de camundongos fêmeas expostas ao BPA desde a pré-concepção até o desmame aumentou a inflamação pancreática, o peso corporal e a gordura corporal na idade adulta [31].
O BPS potencializa a obesidade induzida por alto teor de gordura em camundongos [247] e o BPF pode estar associado a uma diminuição do peso corporal em ratos, revisado em [236]. Os efeitos obesogênicos dos análogos do BPA em animais precisam de mais investigação porque esses dados são escassos em comparação com o BPA.
4.3.4 . Estudos humanos
Uma meta-análise [248] identificou 15 estudos transversais de BPA, 12 encontraram uma associação significativa entre os níveis de BPA e obesidade em adultos. Um estudo prospectivo, realizado apenas em mulheres, mostrou que níveis elevados de BPA estavam associados a um aumento no ganho de peso futuro [249]. Um segundo estudo prospectivo detectou associações entre BPA elevado e futura obesidade abdominal em ambos os sexos [250].
A exposição pré-natal ao BPA foi associada ao aumento da adiposidade central em meninas entre 2 e 6 anos de idade em um grande estudo de coorte de nascimento [251] e aumento da gordura corporal aos 7 anos de idade em meninas [252], mas não em meninos. Outros não encontraram associações entre a exposição pré-natal a amostras de urina spot de BPA no primeiro e terceiro trimestre e aumento do IMC em crianças de 7 anos em uma coorte de nascimento [253]. A concentração de BPA, medida com uma única amostra de urina no primeiro trimestre em um estudo de coorte de nascimento, não estava relacionada à adiposidade na prole, mas níveis mais altos de BPA medidos aos quatro anos foram associados à adiposidade infantil naquela época [254]. Dois estudos de coorte de nascimento menores usando uma amostra de urina spot para BPA não mostraram associação com adiposidade[255], [256]. A evidência epidemiológica de um efeito obesogênico do BPA em estudos de coorte de nascimento e obesidade infantil é inconsistente, pois outro estudo encontrou IMC reduzido [257].
Vários fatores podem explicar esses dados divergentes de estudos epidemiológicos sobre exposições ao BPA. A maioria avaliou a exposição ao BPA na urina ou no soro usando uma única medida de BPA que não pode refletir as exposições múltiplas e os níveis flutuantes de BPA resultantes de sua meia-vida curta em humanos (~6 h) [258]. O IMC ou o peso corporal são medidas imprecisas da obesidade, principalmente em crianças. Estudos longitudinais prospectivos usando múltiplas avaliações do nível de BPA e avaliações de exposição aprimoradas são necessários para avaliar melhor a exposição a produtos químicos de vida curta e melhorar a coerência entre dados humanos e experimentais [259] .
4.3.5 . Integração e resumo de evidências
O BPA estimulou a diferenciação de adipócitos in vitro e aumentou a ingestão de alimentos, peso corporal e tecido adiposo in vivo em vários estudos com roedores . O BPA também interrompeu a função imunológica dos roedores, o microbioma do trato gastrointestinal, o fígado, a função das células β pancreáticas e a regulação hipotalâmica da ingestão de alimentos ( Fig.3). Alguns estudos de coorte de nascimento também indicaram que o BPA atua como um obesogênico. No entanto, as evidências são inconsistentes. Os estudos do BPA forneceram vários conceitos e ferramentas importantes para o campo dos obesógenos: impacto nos tecidos metabólicos, regulação do apetite e saciedade no sistema nervoso central (SNC), respostas a doses baixas e não monotônicas, impacto na interação epigenética com dietas, a multiplicidade de receptores-alvo e mecanismos e potencial relevância de estudos computacionais. A integração geral dos dados do BPA indica que é um obesogênico, e seu uso e regulamentação devem considerar esses achados.

Fig. 3 . BPA regulação da obesidade BPA é um obesogênico. As ações do BPA são as mais detalhadas e abrangentes de todos os obesogênios e esta figura indica os múltiplos locais e mecanismos pelos quais ele demonstrou atuar para estimular o ganho de peso em experimentos in vitro e em modelos animais.
4.4 . Ftalatos
Os ftalatos (diésteres de ácido ftálico) são uma classe de produtos químicos de alto volume de produção que consistem em anéis de benzeno de 1,2-diéster onde as cadeias de alquila diferem umas das outras. Cerca de 25 ésteres de ftalato estão atualmente em uso [260], e alguns metabólitos também são ativos. Os ftalatos de alto peso molecular (cadeia longa) incluem DEHP, ftalato de diisononil (DiNP), ftalato de diisodecil (DiDP), ftalatos de dipropilheptil (DPHP) e di-n-octilftalato (DOP). Os ftalatos de cadeia longa são usados como plastificantes em bens de consumo de plástico, produtos domésticos à base de PVC (nt.: observa-se que novamente o PVC aparece, em todos os seus usos domésticos conhecidos, com outro plastificante como já tinha sido com o BPA. Isso significa que o PVC tem contaminações múltiplas até por ser um clorado e por isso ter, provavelmente, contaminações não intencionais com as dioxinas, moléculas artificiais mais mortíferas que se conhece. Nunca esquecer a Guerra do Vietnã e a tragédia de Seveso no norte da Itália), materiais de embalagem e dispositivos médicos. Plastificantes de ftalato são usados para aumentar a durabilidade, flexibilidade, longevidade e transparência do plástico. Os ftalatos não estão ligados à matriz plástica de fundo e podem migrar facilmente para o meio ambiente. Os ftalatos de cadeia curta são usados como aditivos em produtos de higiene pessoal e na produção de vernizes e revestimentos. Os ftalatos comuns de baixo peso molecular (cadeia curta) incluem dimetil ftalato (DMP), dietil ftalato (DEP), DBP e DiBP.
As exposições humanas ocorrem diretamente (oral e tropical) ou indiretamente (ambiental) via ar, alimentos e água, ar, poeira, produtos plásticos, cosméticos e produtos de consumo via inalação, ingestão ou contato dérmico. Os ftalatos também são encontrados em plásticos usados em unidades de cuidados intensivos neonatais [261] (nt.: trágica realidade dos utensílios serem, na sua maioria, feitos de PVC!!). Os ftalatos são metabolizados e excretados pela urina, suor e fezes. Alguns metabólitos de ftalatos são mais ativos que os componentes originais. Estudos epidemiológicos relataram a detecção de metabólitos de ftalatos em fluidos corporais [262].
4.4.1 . Estudos in vitro
BBP e DiBP são ativadores potentes da diferenciação de adipócitos na linhagem de células pré-adipócitos 3T3-L1, mas apenas BBP ativou PPARγ e induziu adipogênese em MSCs/mesenchymal stem cells [28], [164], [263]). O DEHP não induziu adipogênese em células 3T3-L1 em alguns estudos [264], [265] ou no modelo de cultura de células humanas, SGBS/Síndrome de Simpson-Golabi-Behmel [266], mas induziu adipogênese na linha celular C3H10T1/2 do tipo MSC [267]. A exposição ao DEHP em células 3T3-L1 demonstrou aumentar a proliferação de adipócitos, diminuir o conteúdo lipídico, aumentar a captação de glicose basal e estimulada por insulina enquanto regula negativamente a expressão de PPARγ, com aumento da via de sinalização PI3K [268]. Esses dados indicam que a exposição ao DEHP leva a um adipócito disfuncional com lipídios reduzidos, tamanho reduzido de gotículas lipídicas, diminuição da adiponectina e resistência à insulina, talvez pela ativação de vias diferentes da via PPARγ mais comum [268]. Tal como as ações do TBT, a exposição ao DEHP nas MSCs da medula óssea aumentou a adipogénese à custa da osteoblastogénese [269]. Um metabólito de DEHP humano, mono etilhexil ftalato (MEHP), ativou PPARγ e estimulou adipogênese em pré-adipócitos 3T3-L1 [270], [271], [272], [273]. O MEHP também induziu alterações transcriptômicas e metabólicas precoces em adipócitos humanos diferenciados in vitro, resultando em diferenciação de adipócitos e gliceroneogênese [274]. Assim, as diferenças na adipogênese relatada pelo DEHP podem resultar da capacidade insuficiente de metabolização em algumas linhagens celulares.
A exposição ao BBP pode levar à desregulação metabólica, alterando os reguladores epigenéticos, como lncRNA H19 e seu alvo, miRNA-103/107. BBP induziu adipogênese em células C3H10T1/2 através de uma via epigenética [29]. O BBP também atua através do PPARγ para aumentar a acetilação da histona 3 lisina 9 enquanto diminui a dimetilação da histona 3 lisina 9 e inclina o equilíbrio epigenômico em direção à adipogênese [28].
4.4.2 . Estudos de peixe-zebra
A exposição a baixas doses de DEHP modulou a expressão de genes hepáticos relacionados ao metabolismo de ácidos graxos induzindo NAFLD em peixe-zebra [127]. A exposição a longo prazo ao DEHP interrompeu o microbioma gastrointestinal e a expressão de genes relacionados ao metabolismo lipídico, aumentando o armazenamento de gordura em peixes-zebra adultos [275], [276]. A exposição do desenvolvimento ao MEHP interrompeu a organogênese pancreática no peixe-zebra que pode levar à disfunção metabólica [277]. O DEHP também demonstrou induzir a progressão patológica da esteatose hepática após co-exposição com etanol em larvas de peixe-zebra induzidas a serem esteatóticas por HFD [278]. In vitro e in vivo estudos concordam que a exposição ao DEHP pode promover o acúmulo de lipídios nos hepatócitos, interromper o estresse oxidativo que leva à redox e induzir a lipogênese de novo por meio da ativação de SREBP1c [279], [280], [281]. Bis(2-etilhexil)-2,3,4,5-tetrabromoftalato (TBPH) e seu metabólito, mono-(2-etilhexil)-tetrabromoftalato (TBMEHP) foram mostrados para alterar o metabolismo lipídico dos estágios larvais iniciais do peixe-zebra através da demetilação de DNA promotor de PPARγ [282].
4.4.3 . Modelos de roedores
Uma revisão sistemática examinou 31 estudos com roedores que analisaram os efeitos do DEHP na obesidade [283]. Os resultados do estudo diferiram, mas a exposição do desenvolvimento de roedores ao DEHP foi significativamente associada ao aumento do peso da gordura. A exposição ao DEHP por oito semanas em camundongos C3H/N causou aumento na ingestão de alimentos, peso corporal e WAT visceral em ambos os sexos [284]. Resultados semelhantes foram relatados em outro estudo C3H/N após cinco semanas de exposição ao DEHP. O aumento da expressão do neuropeptídeo Y (NPY) e do peptídeo relacionado à Agouti (AgRP) e diminuição do POMC, genes críticos envolvidos na regulação da ingestão de alimentos e do peso corporal, foi proposto para explicar o aumento da ingestão de alimentos [285]. O tratamento de 1296S, camundongos resistentes à obesidade com DEHP por dez semanas induziu ganho de peso e WAT em fêmeas, juntamente com um aumento da expressão de ERα no tecido adiposo [268].
A exposição ao DEHP durante o desenvolvimento e lactação em camundongos também aumentou o peso em ambos os sexos no desmame que continuou até o dia pós-natal (PND) 84 [284]. Experimentos usando a cepa C57BL/6J mostraram ganho de peso apenas em machos [286]. As mães de ratos Long-Evans foram expostas durante a gravidez e lactação a uma mistura de ftalatos (200 ou 1000 μg/kg/dia) que imitava os perfis de ftalatos urinários de mulheres grávidas em Champaign-Urbana, Illinois (35% DEP, 21% DEHP, 15 % DBP, 15% DiNP, 8% DiBP e 5% BBP), juntamente com controle ou HFD [287]. A HFD aumentou o peso corporal e o tamanho dos adipócitos e a expressão gênica em fêmeas aos 90 dias de idade. Nos machos, HFD ou 200 µg/kg/dia da mistura de ftalato, mas não ambos, aumentou o peso corporal sem efeito sobre o tamanho dos adipócitos. A exposição ao BBP aumentou significativamente o peso corporal de camundongos C57BL6 adultos alimentados com HFD por 16 semanas devido ao aumento do fígado e do tecido adiposo em ambos os sexos [263]. A exposição de adultos a DBP por 13 semanas resultou em aumento do ganho de peso corporal e colesterol sérico em ratos [288].
4.4.4 . Estudos humanos
Os ftalatos têm meias-vidas curtas (~12-18 h) e não se acumulam no tecido adiposo. Uma revisão sistemática e meta-análise examinou 18 estudos que ligam a exposição aos ftalatos à obesidade [248]. Quinze estudos transversais com dez estudos em populações adultas mostraram uma relação geral entre ftalatos e diferentes medidas de obesidade. Um estudo prospectivo em mulheres adultas associou níveis elevados de ftalatos com ganho de peso nos próximos dez anos [249].
Vários estudos prospectivos de coorte de nascimento mostraram uma associação de metabólitos de ftalatos maternos com ganho de peso. As exposições in utero ao monoetil ftalato (MEP), BBP e a soma de metabólitos monoéster DEHP foram associadas ao aumento do IMC, circunferência da cintura e percentual de gordura corporal em crianças de 5 e 12 anos [289]. Numa análise conjunta de três coortes de nascimentos, as concentrações urinárias pré-natais do metabolito DEHP mono-3-carboxipropilftalato (MCPP) foram associadas a um aumento de peso em crianças de 4-7 anos [290]. Em um estudo de coorte de nascimento, a exposição ao DEHP inferida a partir de medições de metabólitos na primeira urina do bebê foi positivamente associada ao aumento de peso aos três meses [291]. A exposição pré-natal a uma mistura de cinco metabólitos de ftalatos de alto peso molecular, medida duas vezes durante a gravidez, foi associada a menor ganho de peso inicial na infância e menor IMC aos 4-7 anos de idade em meninos, mas com maior ganho de peso infantil e IMC infantil em meninas [292]. Um metabolito de DEP, medido uma vez durante a gravidez, foi associado ao IMC da descendência aos cinco anos de idade no estudo de coorte mãe-filho EDEN [293]. A exposição ao DEHP, DiBP, DEP e ao di-n-butil ftalato (DNBP) medida em um estudo transversal em adolescentes foi associada à obesidade abdominal e à circunferência da cintura [294].
No geral, os dados que associam a exposição in utero ao ftalato com ganho de peso na prole eram inconsistentes. Vários estudos não relataram associações significativas ou associações inversas. Os níveis de ácido ftalato materno no primeiro trimestre, mas não as concentrações de DEHP ou DOP, aumentaram a adiposidade infantil em dez anos [295]. Nos EUA, os níveis de ftalatos não DEHP no útero foram associados a um IMC mais baixo, menor circunferência da cintura e menor massa gorda em meninos de 5 a 7 anos de idade [296]. Não houve associação em meninas ou com níveis de metabólitos de DEHP. As exposições pré-natais aos ftalatos, medidas uma vez durante o terceiro trimestre em uma coorte de nascimentos em Nova York, não foram associadas ao aumento da gordura corporal em crianças de 4 a 9 anos de idade [297]. A exposição pré-natal a 11 metabolitos de ftalatos, medidos duas vezes durante a gravidez, mostrou que as concentrações urinárias de monocarboxi-isonil ftalato de MEP estavam consistentemente associadas a um aumento do z-score do IMC e da adiposidade infantil aos 5 anos de idade [298]. O mono(2-etil-5-carboxipentil) ftalato (MECPP) foi inversamente relacionado com o risco de obesidade infantil [253]. Em um estudo de coorte de nascimentos que utilizou medidas repetidas de ftalatos durante a gestação, infância e infância, os resultados não mostraram associação entre a soma dos metabólitos de DEHP e a adiposidade infantil aos oito anos ou nenhuma associação entre as concentrações urinárias de metabólitos MEP aos 5 e 8 anos de idade com adiposidade aos 8 anos [299].
4.4.5 . Integração e resumo de evidências
Os estudos in vitro de peixe zebra e roedores apresentam evidências convincentes de que os ftalatos de cadeia longa DEHP e DBP são obesogênicos. No entanto, muitos dos ftalatos aos quais os humanos estão expostos não foram adequadamente estudados, especialmente os ftalatos de baixo peso molecular encontrados em produtos de higiene pessoal e novos ftalatos como o éster diisononílico do ácido 1,2-ciclohexano dicarboxílico (DINCH). Os níveis de exposição são geralmente inferidos pela medição de metabólitos de ftalatos urinários. Medições únicas não podem avaliar com precisão a exposição contínua ou de longo prazo devido a uma meia-vida curta do ftalato. Muitos estudos epidemiológicos sofrem de uma avaliação de exposição inadequada, falta de avaliação dos ftalatos atuais e falta de desfechos sensíveis fora do peso corporal e IMC. Estudos transversais de ftalatos são de valor limitado.
4.5 . Poluição do ar
A poluição do ar ambiente é um fator de risco de saúde ambiental global significativo que contribui substancialmente para a carga mundial de doenças [300], [301]. Os níveis de poluição do ar ambiente aumentaram significativamente nas últimas três décadas [302]. PM2.5 refere-se ao material particulado atmosférico (PM) com um diâmetro inferior a 2,5 µm. Embora as concentrações médias anuais de PM2,5 e de ozônio continuem a diminuir em países de alta renda, a maioria da população mundial vive em áreas onde as diretrizes de qualidade do ar são rotineiramente excedidas [300].
4.5.1 . Estudos de roedores
Vários mecanismos têm sido propostos para contribuir para os efeitos obesogênicos e diabetogênicos dos poluentes atmosféricos. Os estudos se concentraram no impacto do ozônio, óxidos de nitrogênio, carbono negro e efeitos pró-inflamatórios do PM, bem como os efeitos metabólicos de gases e outros constituintes importantes do PM, como PAHs ou metais transitórios [303]. Os efeitos do PM e seus constituintes podem estar ligados à disfunção endotelial e resistência à insulina [304], estresse oxidativo, inflamação, aumento dos níveis de leptina e interferência no sistema endócrino [304], [305], [306], [307], [308], [309], [310], [311]. A exposição crônica de camundongos ao PAH, BaP causou obesidade [312], [313], [314]. A exposição à exaustão do diesel, que contém grandes quantidades de PAHs, também pode causar disfunção mitocondrial e acúmulo de lipídios nas células hepáticas, in vitro e in vivo [315]. A exposição precoce ao PM leva à subsequente resistência à insulina, adiposidade e inflamação em camundongos [316]. A exposição pré-natal de ratos ao PM2,5 predispôs a progênie a múltiplos defeitos metabólicos de longo prazo, embora isso possa não levar à obesidade em adultos [317]. A exposição a PM2.5 induziu intolerância à glicose, resistência à insulina ou distúrbios do metabolismo lipídico em camundongos [318]. A glicose hepática e o metabolismo lipídico foram alterados em camundongos expostos a PM2,5 [319]. As alterações nos perfis lipídicos celulares foram associadas a efeitos metabólicos adversos observados após a exposição ao PM [320]. PM no ar ambiente promoveu o crescimento do tecido adiposo em animais experimentais [321]. PM pode interagir com outros fatores obesogênicos para induzir inflamação, estresse oxidativo ou DM2 em animais experimentais [322], [323], [324]. A PM tem maior impacto em animais com predisposição genética para DM2 [325].
Os efeitos pró-inflamatórios da PM [326] podem ser a principal causa de seu impacto na obesidade e no desenvolvimento de DM2. A exposição ao PM provocou inflamação pulmonar e sistêmica, contribuindo para a síndrome metabólica e doença cardiopulmonar [327]. A exposição ao ar poluído aumentou o estresse oxidativo sistêmico e a inflamação em vários tecidos [328]. Pode exagerar a inflamação no tecido adiposo e promover a resistência à insulina em modelos de camundongos [304], [306], [329]. A indução de inflamação é um efeito comum de vários tipos de PM, independentemente de sua origem [308]. A inflamação sistêmica e o estresse oxidativo podem desencadear alterações observadas em vários órgãos, incluindo vasculatura, fígado, músculos esqueléticos e tecidos adiposos brancos e marrons [330], [331].
O microbioma intestinal representa outro alvo potencial de poluentes do ar. Ambos PM e PAHs alteram a composição microbiana intestinal para favorecer táxons bacterianos ligados à obesidade e diabetes em animais experimentais. No entanto, apenas alguns estudos foram realizados em humanos [303], [332].
Numerosos componentes de PM, em particular PAHs, são ligantes de AhR [333] e podem interromper o(s) papel(es) fisiológico(s) de AhR na regulação da integridade da barreira epitelial [334]. Além dos mecanismos acima, a poluição do ar também afeta a atividade física, afeta a inflamação hipotalâmica, o eixo hipotálamo-hipófise-adrenal ou atua por meio de mecanismos epigenéticos em modelos animais [335], [336], [337].
4.5.2 . Estudos humanos
A poluição do ar ambiente contribuiu para o aumento da obesidade e da adiposidade abdominal das crianças [338]. A poluição do ar no trânsito está positivamente associada ao crescimento do IMC em crianças [339], [340], [341]. Há evidências limitadas de que a exposição pré-natal ao PM pode levar a efeitos obesogênicos em lactentes [342]; no entanto, a exposição precoce à poluição do ar pode aumentar o risco de sobrepeso e obesidade mais tarde na vida [343], [344], [345]. A exposição à poluição do ar afetou os níveis lipídicos em adultos jovens, particularmente aqueles com obesidade [346] e metabolismo alterado dos ácidos graxos [347]. A avaliação sistemática de várias coortes de nascimentos distintas indicou que a poluição do ar contribuiu para a obesidade infantil [208], e um achado semelhante foi relatado em outro estudo de grande escala [348]. Uma recente meta-análise e revisão sistemática da literatura avaliou se a exposição à poluição atmosférica estava associada à obesidade infantil [349]. Eles relataram que a absorção de PM2,5, PM10, PM2,5 e NO 2 aumentaram significativamente o risco de obesidade em crianças (OR 1,06, 1,07, 1,23 e 1,10, respectivamente). Em contraste, outros estudos sugeriram que a associação da poluição relacionada ao trânsito, incluindo a exposição pré-natal, com o excesso de peso infantil é fraca ou inexistente [350], [351], [352].
Outros estudos apontaram para o papel potencial da poluição do ar ambiente ou poluição do ar relacionada ao tráfego em populações adultas específicas. Foi proposto que os adultos mais velhos seriam mais sensíveis aos efeitos obesogênicos e adipogênicos do PM [353], [354], [355]. Sexo, idade ou suscetibilidade genética a um IMC mais alto podem sensibilizar os indivíduos durante a exposição prolongada a poluentes do ar ambiente, aumentando o risco de obesidade. Em indivíduos expostos a níveis aumentados de PM, foi observado um risco maior de síndrome metabólica, circunferência da cintura, hipertrigliceridemia e hiperglicemia [356]. São necessários estudos longitudinais mais extensos, com análises mais refinadas da composição da poluição do ar, para investigar mais ligações entre poluição do ar e sobrepeso/obesidade [357].
4.5.3 . Integração e resumo de evidências
Estudos mecanísticos e epidemiológicos associaram a exposição crônica à poluição do ar ambiente com aumento da obesidade (particularmente durante a infância por exposição in utero) e um risco elevado de DM2. Evidências sugerem fortemente que a poluição do ar é um obesogênico que pode contribuir para esses efeitos. As ligações funcionais entre poluição do ar e doenças metabólicas, potencialmente contribuindo para a obesidade e consequências graves na vida adulta (incluindo o aumento do risco de DM2), certamente merecem mais atenção. Isso pode ser particularmente relevante para populações vulneráveis, como aquelas com disfunções metabólicas pré-existentes [358].
4.6 . Tributilestanho
O TBT é um obesogênio bem caracterizado [revisado em [18]]. O TBT e outros organoestânicos são amplamente utilizados na indústria e em menor escala na agricultura. Os seres humanos são expostos ao TBT através da dieta, uma vez que o TBT continua a contaminar os frutos do mar devido ao seu uso contínuo, embora em declínio, em aplicações de transporte marítimo [359]. O TBT também é usado como fungicida em fábricas de papel e sistemas industriais de água [revisado em [360]]. O organoestanho relacionado, trifenil estanho (TPhT), é usado como fungicida em batatas, beterrabas, feijão e nozes (entre outros) e como acaricida em certas culturas alimentares, incluindo frutas de caroço e nozes, apresentando oportunidades adicionais para exposição humana [361]. Talvez mais notavelmente, o TBT está presente como um contaminante de dibutilestanho (DBT) usado em até 3% p/p em plásticos de PVC (nt.: novamente o PVC, o que torna essa resina uma das mais perigosas e letais em nosso ambiente doméstico. Na nossa opinião crime corporativo e prevaricação dos órgãos públicos reguladores!). A poeira doméstica contém organoestânicos, e é provável que sejam riscos dérmicos e de inalação para humanos [362], [363].
4.6.1 . Dibutilestanho
DBT é encontrado em plásticos de PVC e lixivia na água potável de tubos de PVC (nt.: TUBOS PLÁSTICOS DE PVC NA ÁGUA ‘POTÁVEL’!!). É também o principal produto de decomposição do TBT. Em camundongos, a exposição ao DBT durante o desenvolvimento resultou em aumento do tecido adiposo e resistência à insulina [364]. Também estimulou a adipogênese em células 3T3-L1 e MSCs humanas e de camundongo por meio de uma via dependente de PPARγ [364], [365].
4.6.2 . Estudos in vitro
O TBT é um ativador de alta afinidade dos receptores nucleares PPARγ e seu parceiro heterodimérico, RXR, em níveis nanomolares in vitro [70], [71]. A análise cristalográfica de raios-X mostrou que o TBT se liga ao RXR como um aduto covalente à cisteína 432 da hélice 11 na proteína RXRα [366]. O TBT também pode se ligar ao PXR e pode modular a afinidade do heterodímero RXR-PXR para coativadores transcricionais [367]. TBT induziu a diferenciação de pré-adipócitos 3T3-L1 de camundongo em adipócitos brancos maduros [70], [71], [368] e essa diferenciação foi bloqueada pelo co-tratamento com um antagonista de PPARγ [369]. As MSCs humanas e de camundongo também foram induzidas a se diferenciar em adipócitos brancos por meio de uma via dependente de PPARγ após exposição a níveis nanomolares (nM) de TBT [369], [370], assim como a linha de células semelhantes a MSC de camundongo C3H/10 T1/ 2 [267]. A exposição pré-natal ao TBT mudou o destino de MSCs derivadas de tecido adiposo e de medula óssea preferencialmente em direção à linhagem adiposa e longe da linhagem óssea em camundongos expostos [370] e MSCs de camundongo, in vitro [371] por meio de uma via dependente de RXR. Finalmente, as linhas de células do fígado humano, HepaRG e HepG2, responderam aos níveis nM de TBT aumentando o conteúdo lipídico através da ativação do PPARγ [372].
4.6.3 . Estudos de peixe-zebra
As larvas de peixe-zebra tratadas com concentrações nM de TBT exibiram adiposidade aumentada em exposições crônicas e de curto prazo [373], [374], [375]. O TBT modula a transcrição dos principais fatores reguladores de lipídios e enzimas envolvidas na adipogênese, lipogênese, metabolismo de glicocorticóides e crescimento e desenvolvimento [66], [376]. A exposição ao TBT também aumentou o peso corporal e a ingestão de alimentos em peixes dourados [377] e adiposidade em salmão e medaka [378], [379]. Enquanto o TBT ativa o PPARγ de mamíferos, seu ortólogo de peixe-zebra não respondeu ao TBT, talvez devido a uma remodelação mutacional específica da bolsa de ligação ao ligante [380]. Como o TBT se liga avidamente ao RXR [366], o TBT pode induzir o acúmulo de gordura via homodímeros RXR ou pela ativação do lado RXR do heterodímero RXR-PPARγ. Um estudo de peixe-zebra usando TBT e antagonistas seletivos de vários receptores nucleares sugeriu que o TBT pode promover o armazenamento de triacilglicerol em adipócitos através de vias dependentes de RXR independentemente de PPARs [381].
4.6.4 . Estudos de roedores
O TBT foi o primeiro produto químico designado como obesogênico in vivo [382]. A exposição pré-natal ou perinatal ao TBT em camundongos levou ao aumento da gordura corporal na prole [43], [44], [382] e predisposição das MSCs para produzir adipócitos quando cultivadas ex vivo [370]. TBT induziu obesidade em camundongos de ambos os sexos, independentemente da idade no tratamento [383], [384], [385], [386]. Efeitos semelhantes foram observados em ratos [386]. Como observado anteriormente, a exposição a baixas doses de TBT durante a gravidez ou gravidez e lactação levou à predisposição transgeracional à obesidade na prole masculina até pelo menos a geração F4 [43], [44].
Além de seu efeito direto na adipogênese, o TBT também é tóxico para o fígado e interfere no controle do metabolismo por meio de efeitos no cérebro. Quando ratos adultos foram expostos ao TBT por 54 dias, os machos apresentaram aumento do peso corporal e da massa gorda, enquanto as fêmeas apresentaram aumento da ingestão alimentar. As fêmeas tiveram um aumento no NPY/neuropeptide Y, enquanto os machos apresentaram POMC/pro-opiomelanocortin cerebral, AgRP e expressão de mRNA de transcrição regulada por cocaína e anfetaminas (CART) deprimidos no cérebro, indicando ações específicas no controle do comportamento alimentar [386]. Outro estudo de alimentação de adultos com TBT em camundongos machos não mostrou ganho de peso, mas reduziu a atividade da β-galactosidase relacionada ao NPY e Y1 no circuito hipotalâmico que controla a ingestão de alimentos [387]. Portanto, os efeitos do TBT no controle do comportamento alimentar não são claros.
4.6.5 . Estudos humanos
Existem poucos estudos epidemiológicos de exposições ao TBT e seus efeitos, apesar da força da literatura animal. Um único estudo de coorte longitudinal finlandês revelou uma associação linear entre os níveis placentários de TBT e o ganho de peso infantil, embora o TBT fosse indetectável no sangue [388]. Embora os dados do National Health and Nutrition Examination Survey (NHANES) sejam transversais e, portanto, inadequados para inferir causalidade, uma análise recente dos dados do NHANES identificou uma ligação significativa entre níveis elevados de estanho total urinário e diabetes [389]. Nesta população, a exposição ao estanho era onipresente [390]. No entanto, num pequeno grupo (55 indivíduos) de mulheres dinamarquesas, não foram identificados níveis significativos de TBT num estudo realizado pelo Programa Nacional de Toxicologia (NTP) [391]. Significativamente, foi recentemente demonstrado que os recipientes de plástico para espécimes do tipo universalmente usado em tais estudos eram fortes aglutinantes de TBT e outros organoestanhos, reduzindo acentuadamente a recuperação de organoestanho durante a análise [392]. Portanto, estudos anteriores de níveis de organoestanho em amostras humanas, incluindo o estudo NTP, provavelmente subestimaram substancialmente os níveis de TBT porque usaram de amostras de sangue de recipientes de plástico durante o processamento e a análise.
4.6.6 . Integração e resumo de evidências
Os efeitos obesogênicos da exposição ao TBT são bem comprovados por meio de ensaios in vitro de peixes zebra e roedores. O TBT estimula a diferenciação de pré-adipócitos em adipócitos e altera os centros de alimentação do cérebro e a lipogênese hepática. A falta de dados longitudinais em humanos impede uma avaliação definitiva dos efeitos obesogênicos dos organoestânicos em humanos, mas as evidências de outros estudos são substanciais. Portanto, os efeitos obesogênicos da exposição ao TBT são bem fundamentados na literatura [18].
4.7 . Retardadores de chamas
Retardadores de chama, como éteres difenílicos polibromados (PBDE) e retardadores de chama organofosforados (OPFR) são classes de EDCs. Para atender às regulamentações governamentais de segurança contra incêndio, retardadores de chama foram adicionados aos produtos, assumindo que isso reduziria a combustibilidade. Esses produtos incluem móveis, roupas, brinquedos, eletrônicos, plásticos e outros móveis domésticos e de trabalho. Os retardadores de chama não são quimicamente ligados ao tecido, plástico ou materiais e podem ser voláteis. Eles são encontrados na poeira doméstica, alimentos, água e no ar de escritórios, aviões e outros ambientes de trabalho [393], [394], [395], [396]. Existem 209 PBDEs, e a maioria é persistente, bioacumulativa e neurotóxica. A avaliação da segurança do PBDE levou a uma eliminação progressiva na Europa e nos EUA [397]. Cinco a dez anos após a eliminação progressiva, os PBDEs foram detectados em amostras humanas (placentária e leite materno) em concentrações de 1 a 60 ng/g de lipídios [398], [399] em comparação com os níveis de segurança padrão estabelecidos em 0,1–7 mg /kg/dia. Os BDEs foram substituídos principalmente por OPFRs, que têm meias-vidas mais curtas de horas a dias [400] .
OPFRs são ésteres orgânicos de ácido fosfórico contendo cadeias alquil ou grupos aril. Enquanto o uso de PBDEs está em declínio, o uso de OPFR está aumentando e eles podem apresentar toxicidade semelhante [401]. As cargas do corpo humano de OPFRs e seus metabólitos estão aumentando, com alguns metabólitos encontrados em níveis 15 vezes maiores em 2014–15 do que em 2002–03 [402], [403], [404]. Como existem muitos PBDEs e OPFRs diferentes, a maioria dos ensaios avalia os efeitos de produtos químicos representativos como PBDE-47 ou PBDE-97 ou trifenilfosfato (TPhP). Os metabólitos de OPFR são detectáveis na urina humana, leite materno e amostras de sangue [405]. TPhP, tricresil fosfato (TCP) e tris (1,3-dicloro-2-propil) fosfato (TDCPP) são encontrados no pó doméstico em concentrações médias de ∼1–6 μg/g de pó e são ingeridos acidentalmente por gestantes e seus bebês em desenvolvimento [406] (nt.: todos os halogênios -flúor, bromo e cloro-, conforme o documentário da mídia franco-alemã ARTE, ‘Demain, tous crétins?’- ‘Amanhã, todos retardados?’, demonstram deslocar o outro halogênio, iodo, do hormônio da tiroide materna, tiroxina, imprescindível para o desenvolvimento saudável do SNC/cérebro, já nos primeiros dias do desenvolvimento embrionário. Daí estarem as crianças nascendo com possibilidades de um retardo mental, numa gama variável, face a contaminação materna com produtos com os três primeiros halogênios acima citados).
4.8 . PBDEs
4.8.1 . estudos in vitro
A exposição de adipócitos 3T3-L1 a PBDE-47 e PBDE-99 induziu adipogênese de maneira dose-dependente (2,5-30 µM) [407], [408] e induziu a expressão de PPARγ via desmetilação de sítios CpG no promotor PPARγ [ 408], [409]. Esta indução levou à expressão da subunidade catalítica da leptina e da glicose-6-fosfatase e à ruptura da homeostase da glicose dos adipócitos in vivo [409]. Além disso, o PBDE-47 alterou o metabolismo das purinas e da glutationa nas células 3T3-L1 e elevou a respiração mitocondrial e a glicólise, levando ao estresse oxidativo reativo [410]. O PBDE-47 também ativou a sinalização Akt via sinalização do hormônio tireoidiano nas células β pancreáticas para aumentar a secreção de insulina estimulada pela glicose [411] .
4.8.2 . Estudos de roedores
Muitos estudos com roedores relataram que as exposições perinatais de PBDE alteraram o crescimento da prole adulta, peso corporal, adiposidade e homeostase de glicose e insulina. A exposição ao PBDE-47 a 0,1 e 1,0 mg/kg, o nível de efeito adverso não observado ((NOAEL) é 0,7 mg/kg), desde o pré-acasalamento até o desmame, aumentou o peso corporal na prole masculina. Foi levantada a hipótese de que a exposição ao PBDE-47 induziu um estado semelhante à desnutrição nas mães, levando à suscetibilidade subsequente ao ganho de peso em filhotes machos [412]. A exposição a uma dose baixa de PBDE-47 (0,2 mg/kg/dia) induziu maior crescimento de filhotes e juvenis e peso corporal em ratos potencialmente através do aumento da sinalização de IGF-1 em filhotes machos [413]. Em camundongos, a exposição perinatal à mesma dose de PBDE-47 alterou os genes xenobióticos e metabólicos lipídicos no tecido adiposo gonadal na prole masculina jovem [414]. Em camundongos machos, a exposição ao PBDE-47 exacerbou a resposta à obesidade induzida pela dieta com esteatose hepática e perturbação do microbioma intestinal [415].
As exposições de PBDE em adultos também influenciaram os processos metabólicos em modelos de roedores em doses que estavam dentro da faixa superior de exposição ou excederam as exposições humanas. A exposição de adultos a baixas doses de PBDEs (0,5 ou 10 μg/kg/dia de água potável) exacerbou a resposta à obesidade induzida pela dieta, induzindo hiperglicemia e interrompendo a ação da insulina no músculo esquelético [416]. A exposição de adultos ao PBDE-47 (1 mg/kg, 6 d/semana, 8 semanas) induziu hiperglicemia em ratos machos, que se correlacionou com o aumento da expressão hepática de genes envolvidos na mobilização de glicose em um modelo de obesidade induzida por dieta [417]. A exposição ao PBDE também pode atingir o microbioma intestinal porque a dosagem oral de curto prazo de PBDE-47 ou PBDE-99 alterou metabólitos de aminoácidos de cadeia ramificada e aromáticos e populações de vinte e três táxons bacterianos no intestino [418]. Esses estudos indicam que a exposição crônica, intermitente ou de curto prazo a doses relevantes para exposições humanas pode interromper os processos metabólicos e exacerbar a interrupção metabólica associada à obesidade.
4.8.3 . Estudos humanos
Numerosos estudos examinaram as relações entre cargas corporais de PBDE ou exposições perinatais e resultados metabólicos e estados de doença. Em mulheres do Reino Unido, as cargas corporais de hexabromociclododecano (HBCDD) foram fracamente correlacionadas com pesos corporais mais elevados [419]. Em mulheres de uma população indígena canadense (Cree), foram encontradas correlações positivas entre níveis elevados de glicose em jejum e concentrações plasmáticas de PBDE-47 [420]. Um estudo de mulheres adultas do estudo CHAMACOS, com sede na Califórnia, descobriu que as concentrações séricas de PBDE-153 estavam associadas a um IMC mais baixo nos 1 a 3 anos subsequentes.
A exposição pré-natal ao PBDE foi associada positiva e negativamente ao IMC na infância, dependendo do sexo do sujeito, local do estudo e do PBDE específico estudado. Em um estudo longitudinal de coorte de nascimento de exposição a PBDE em crianças de uma população latino-americana na Califórnia, as concentrações séricas maternas de PBDE foram associadas a IMC mais alto em meninos, mas IMC mais baixo em meninas aos sete anos de idade [421]. Isso é esperado, pois os efeitos das exposições químicas ambientais tendem a ser específicos do sexo. No entanto, em um estudo na China, os níveis de PBDE-153 e PBDE-154 foram associados a IMC e circunferência da cintura mais baixos em crianças aos 8 anos de idade [422]. Da mesma forma, os níveis maternos de PBDE (99, 100, 153, 154, 209) do colostro ingerido até 96 horas após o parto não foram associados ao IMC infantil e risco de obesidade aos 7 anos de idade [253]. No Health Outcomes and Measures of the Environment Cohort, as exposições pré-natais e perinatais ao PBDE-153 (50-200 ng/g de lipídios) foram negativamente correlacionadas com o IMC, circunferência da cintura e percentual de gordura corporal até 8 anos de idade [423]. Esses resultados sugerem evidências limitadas de que as exposições perinatais aos PBDEs podem alterar os processos metabólicos em crianças. Resultados diferentes podem derivar das várias idades das crianças no momento da avaliação do peso ou da adiposidade, bem como diferenças no PBDE específico examinado e faixa de exposição em cada população e outras exposições químicas concomitantes.
4.8.4 . Integração e resumo de evidências
Os modelos in vitro e animais, apoiados por estudos humanos limitados, indicam que os PBDEs testados são obesogênicos. Como os PBDEs agora são proibidos, seus efeitos sobre a obesidade devem diminuir à medida que seus níveis diminuem gradualmente.
4.9 . Retardadores de chama organofosforados (OPFRs)
4.9.1 . Estudos in vitro
TPhP (1–50 μM) induziu a proliferação e diferenciação de adipócitos enquanto aumentava os níveis de transcritos de PPAR e CCAAT/proteína intensificadora (C/EBP) [424]. O OPFR 2-etilhexil difenil fosfato (EHPHHP) alterou a expressão de genes envolvidos no ciclo celular, resposta imune e homeostase de glicose e lipídios. Em um estudo semelhante usando células HepG2 humanas, TPhP, trTCP e TDCPP aumentaram a deposição intracelular de triglicerídeos e colesterol total através da modulação da β-oxidação de ácidos graxos, alterando a sinalização de PPARγ e SREBP2 [425]. O TPhP diminuiu o consumo de oxigênio mitocondrial e o conteúdo de ATP, corroborando os achados nos estudos de exposição em adultos e perinatais [426], [427]. O TPhP também criou adipócitos com propriedades diferentes do ROSI/rosiglitazone (nt.: fármaco da classe dos antidiabéticos), incluindo falha em induzir diferenciação de adipócitos bege, diferenças no proteoma, biogênese mitocondrial reduzida, diferenças no citoesqueleto e outras proteínas envolvidas na homeostase de lipídios e glicose [428].
4.9.2 . Estudos de peixe-zebra e frango
As exposições de adultos e de desenvolvimento aos OPFRs afetam os processos metabólicos em modelos não mamíferos. No peixe-zebra, a exposição ao TPhP em concentrações ambientalmente relevantes induziu muitas alterações metabólicas e transcricionais hepáticas, incluindo o metabolismo da glicose e do lactato e a sinalização do PPAR [429]. Em galinhas em desenvolvimento, o TDCPP induziu a expressão de CYP3A37 e CYP2H1, fígado colestático e fibrose biliar, metabolismo de lipídios e esteróides interrompidos, aumento do ácido biliar circulante, diminuição do colesterol plasmático e expressão alterada de PPARγ [430].
4.9.3 . Estudos de roedores
Os OPFRs representam um risco semelhante, se não maior, de interrupção metabólica do que os PBDEs devido à sua prevalência em produtos manufaturados. A exposição ao OPFR aumentou os níveis de glicose, triglicerídeos e colesterol, juntamente com a expressão hepática de genes envolvidos no metabolismo da glicose [431], aumentou as concentrações séricas de triacilglicerol, LDL e lipoproteína de muito baixa densidade (VLDL) pela inibição das enzimas carboxilesterase (Ces) no fígado [432] e aumento do colesterol sérico total e colesterol de lipoproteína de alta densidade (HDL) em ambos os sexos em camundongos [433]. Em doses que se aproximam das exposições humanas, uma mistura OPFR de TPhP, TDCPP e TCP (1 mg/kg cada) impactou a homeostase energética, a expressão gênica hipotalâmica e hepática e a excitabilidade neuronal hipotalâmica em camundongos adultos. Uma administração oral de 4 semanas da mistura de OPFR aumentou a expressão gênica hipotalâmica e hepática e o ganho de peso corporal, potencialmente via ERα [434]. A exposição aos mesmos OPFRs interrompeu a ingestão de alimentos e líquidos, reduziu a produção de leptina e insulina, aumentou os níveis de glicose em jejum, suprimiu a atividade locomotora e as taxas metabólicas [435], e produziu camundongos machos mais gordos e pesados numa HFD/high-fat diet sem efeito sobre a adiposidade feminina. A exposição de adultos à mesma mistura de OPFR induziu hiperexcitabilidade em neurônios POMC através do aumento de entradas pré-sinápticas excitatórias em camundongos fêmeas, mas não machos. A exposição ao OPFR também aumentou a excitabilidade nos neurônios NPY/AgRP em camundongos fêmeas, em parte pela inibição da corrente M, a corrente de potássio que controla a frequência de disparo. Os neurônios NPY/AgRP em mulheres também foram mais sensíveis ao hormônio da fome grelina após exposição a OPFRs [427]. Coletivamente, esses dados sugerem que as exposições de adultos a OPFRs em roedores em concentrações que excedem as exposições humanas diárias não ocupacionais podem interromper a homeostase energética por meio de circuitos sensíveis a nutrientes e hormônios que controlam a homeostase, especialmente em machos.
Há um crescente corpo de pesquisas sobre os efeitos perinatais da exposição ao OPFR no metabolismo da prole em ratos e camundongos. A exposição perinatal a EHDPHP em camundongos machos aumentou o peso corporal quando os machos foram alimentados com uma dieta com baixo teor de gordura [436]. Em um estudo usando uma mistura comercial de OPFRs e retardadores de chama bromados, Firemaster® 550, a exposição perinatal (1 mg/kg/d) aumentou o peso corporal e diminuiu a depuração de glicose na prole de ratos fêmeas [437]. Por outro lado, a exposição perinatal em ratos Wistar a uma mistura de OPFRs ou uma mistura de novos retardadores de chama bromados (2-etilhexil-2,3,4,5-tetrabromobenzoato (EH-TBB) e TBPH reduziu o peso corporal na prole masculina desde os dias pós-natais 64 a 250 [438]. Na prole feminina, o peso corporal juvenil foi menor nos grupos expostos, com normalização ocorrendo no dia 49 pós-natal.
A exposição perinatal ao TPhP em camundongos CD-1 alimentados com HFD aumentou o peso corporal e a adiposidade, o peso do fígado e a expressão do gene da lipogênese [415], [439], [440]. A exposição materna a uma mistura de TPhP, TDCPP e TCP em camundongos C57Bl/6J não afetou o peso corporal ou a adiposidade em uma baixa ou HFD. No entanto, a mistura OPFR interagiu com a HFD para aumentar a glicemia de jejum nas fêmeas e alterou a resistência à glicose e à insulina na prole masculina [441]. Assim, a exposição materna a alguns OPFRs programa o fígado e o tecido adiposo de forma sexual e animal, alterando sua resposta a uma dieta obesogênica e alterando a homeostase energética do adulto.
4.9.4 . Estudos humanos
Desde a eliminação dos PBDEs, as cargas corporais de OPFRs em humanos aumentaram para níveis mais altos do que os PBDEs [401], [404]. Dados limitados associaram a exposição ao OPFR com desfechos metabólicos. Usando dados e amostras do US NHANES/National Health and Nutrition Examination Survey, metabólitos de OPFR, incluindo tris (2-cloroetil) fosfato (TCEP) e TDCPP, foram associados à síndrome metabólica em homens adultos, e as misturas de OPFR foram associadas à síndrome metabólica, hiperglicemia e obesidade central [442]. Outro estudo usando dados do NHANES encontrou maiores chances de excesso de peso entre crianças com altas concentrações de bis (2-cloroetil) fosfato (BCEP), mas IMC mais baixo associado a concentrações mais altas de dibutil fosfato (DBUP) [443].
Os únicos dois estudos de coorte de nascimento que examinaram os OPFRs pré-natais descobriram que as exposições in utero resultaram em ganho de peso na prole. As concentrações urinárias maternas de bis (1,3-dicloro-2-propil) fosfato (BDCPP) durante a gravidez foram associadas a um maior índice ponderal infantil ao nascimento [444]. Além disso, um estudo piloto (n = 56) encontrou uma associação positiva entre o BDCPP e o aumento do comprimento e do peso infantil apenas no sexo masculino [445].
4.9.5 . Integração e resumo de evidências
Ambos os antigos retardadores de chama (PBDEs) e seus compostos de substituição mais recentes (OPFRs) são obesogênicos, dependendo do modelo animal, dose, janela de exposição, sexo do animal e resultado metabólico examinado. Embora os estudos epidemiológicos sejam limitados, os resultados são consistentes de que todos os OPFRs testados são obesogênicos e ou metabolicamente disruptivos em adultos e descendentes de exposição in utero .
4.10 . Agrotóxicos/DDT
Embora numerosas classes de agrotóxicos tenham sido implicadas como potenciais obesogênicos, incluindo as classes de organoclorados, organofosforados e piretróides, os dados tendem a ser inconsistentes [446], [447]. Os agrotóxicos analisados mais amplamente estudados foram os organoclorados diclorodifenildicloroetileno (DDE), DDT e seus metabólitos, incluindo diclorodifenildicloroetano (DDD) ( p, p’-DDE/ p, p’- DDD e p, p’-DDT), hexaclorobenzeno (HCB) (nt.: no Brasil é conhecido com BHC e pelo codinome de ‘pó de gafanhoto’. Este como o DDT e sua família bem como outros organoclorados foram proibidos no Brasil desde os anos 80) e β-hexaclorociclohexano (βHCH) [13], [447], [448]. O DDT é um agrotóxico obesogênico com mais dados. Embora seu uso tenha sido proibido nos Estados Unidos no início da década de 1970, o DDT ainda é usado na Índia e na África para o controle de vetores da malária [449], [450]. O DDT técnico é uma mistura de agrotóxicos orgânicos persistentes de três isoformas, p, p’ -DDT o, p’- DDT e p, p’- DDD. O DDT é metabolizado em DDE bioacumulativo, que é altamente lipofílico e persistente no ambiente e na cadeia alimentar [451]. Assim, a exposição ao DDT por contato ambiental ou ocupacional e ao DDE pelo consumo de alimentos contaminados continua sendo uma preocupação relevante em todo o mundo.
4.10.1 . Estudos in vitro
Pré-adipócitos humanos tratados com DDE por 48 h foram induzidos a proliferar [452]. A exposição ao DDE aumentou a diferenciação de pré-adipócitos 3T3-L1 murinos em adipócitos maduros [453], [454], [455]. A exposição ao DDT também induziu adipogênese em pré-adipócitos 3T3-L1 e MSCs [456], [457]. Esses efeitos pró-adipogênicos in vitro de DDE e DDT foram associados à regulação positiva dos principais mediadores da adipogênese, incluindo C/EBP-α, FAS, fator-1 de ligação ao elemento de resposta a esterol e PPARγ [454], [456]. A exposição ao DDE aumentou a captação de ácidos graxos em adipócitos 3T3-L1 e aumentou a expressão e/ou liberação de adipocinas (adiponectina, leptina e resistina) em MSCs de adipócitos 3T3-L1 [457], [458], [459]. No entanto, DDE/DDT não induziu adipogênese em todos os estudos [458], [459].
4.10.2 . Estudos de roedores
A exposição perinatal ao DDT em camundongos aumentou a massa corporal e gorda restrita à prole feminina e atribuída à diminuição do gasto de energia e redução da termogênese [460]. A exposição de ratos ao DDT (25 mg/kg ou 50 mg/kg) nos dias 8-14 de gestação produziu obesidade significativa em machos e fêmeas na geração F3 de mães de baixa dose e machos F3 de mães de alta dose [46]. Numerosos estudos in vivo examinaram alterações no metabolismo lipídico sistêmico como um índice de potencial obesogênico. Uma revisão sistemática determinou que o índice mais consistente de alterações induzidas por DDT/DDE no metabolismo lipídico sistêmico foram as alterações no metabolismo lipídico hepático. A predominância de estudos indicou que a exposição ao DDT/DDE aumentou o colesterol hepático, triacilglicerol, lipídios totais e peso do fígado em modelos experimentais de roedores [461].
4.10.3 . Estudos humanos
Como o DDT foi amplamente utilizado, foi estudado em coortes de nascimento e estudos transversais em todo o mundo. O DDT é altamente lipofílico; por isso, foi frequentemente rastreado na porção lipídica do soro, placenta e tecido adiposo, considerado o principal reservatório para a acumulação de DDT [462]. Estudos transversais em adultos frequentemente relataram associações positivas da carga corporal de DDT/DDE com estimativas de obesidade, como IMC [463], [464], [465], circunferência da cintura [466], depósitos de tecido adiposo visceral e subcutâneo [467], e massa gorda total [468]. Achados opostos ou nulos foram relatados em alguns estudos transversais. Os níveis séricos de DDT/DDE não foram associados ao IMC em tunisianos [469], percentagens de massa gorda do tronco, perna e corpo inteiro na população NHANES (EUA) [470] ou IMC, circunferência da cintura, percentagem de massa gorda ou total e tecido adiposo abdominal subcutâneo em belgas obesos [471]. As associações transversais do DDT com a obesidade podem depender do momento da exposição e da idade da população, com associações negativas durante a fase de exposição eventualmente tornando-se positivas após 2-3 meias-vidas [472].
Os resultados dos estudos longitudinais em adultos foram mais consistentes. Em um estudo de coorte de adultos na Suécia, o p, p’- DDE sérico foi associado tanto a uma circunferência abdominal maior (estudo transversal) quanto a uma obesidade abdominal incidente de 5 anos (estudo longitudinal) [473]. As concentrações séricas de p, p’-DDT e p, p’-DDE de adultos dos EUA correlacionaram-se prospectivamente com o aumento do IMC 18 anos depois e mostraram um padrão de dose-resposta não monotônico [474].
Uma associação positiva foi encontrada em uma população japonesa entre os níveis pós-natais estimados de p,p’- DDE e o escore z do IMC aos 42 meses de idade, principalmente em meninas [475]. Associações positivas de exposição materna a DDT/DDE com crescimento rápido/obesidade durante a infância foram relatadas na coorte de nascimento do INMA (Espanha) [253], [476] e na coorte LIFE Child (Alemanha). Associações prospectivas positivas de níveis maternos de exposição a DDT/DDE e medidas de obesidade foram relatadas em uma diversidade de locais em todo o mundo, por exemplo, África do Sul [477], Estados Unidos [478], [479] meninas belgas, mas não meninos [480], sete agrupados Coortes de nascimentos europeias [481] e Grécia [482].
Uma revisão sistemática de 2017 identificou sete estudos epidemiológicos prospectivos relatando associações positivas entre exposição a p,p’-DDE e adiposidade medida pelo escore z do IMC [461]. Talvez os dados mais interessantes venham da Child Health and Development Cohort, onde as exposições perinatais ao o,p’-DDT na década de 1960 foram positivamente associadas a um maior risco de sobrepeso e obesidade em suas filhas durante a meia-idade [483]. Um relatório recente desta coorte mostrou que a exposição da avó ao DDT pode ter aumentado a obesidade em mulheres adultas jovens e suas netas [484].
Outros estudos não relataram associação entre a exposição materna a organoclorados persistentes, incluindo DDT e obesidade infantil, incluindo populações dos Estados Unidos [485], México [486], coortes agrupadas da Ucrânia, Groenlândia e Polônia e Suécia [487], um estudo norueguês e sueco sobre a população [488] e crianças coreanas [489]. Em uma coorte mãe-filho das Ilhas Faroé, a exposição materna a poluentes persistentes foi associada a escores z de IMC aumentados e/ou risco de sobrepeso aos 18 meses e/ou cinco anos, embora as associações não fossem claras para DDT/DDE [490]. Vários fatores podem explicar esses achados, incluindo os níveis de exposição diferencial mencionados acima, uma vez que associações nulas eram mais prováveis de serem relatadas em populações com níveis de exposição mais altos [485] modificadores de efeito não contabilizados, como tabagismo [491] ou IMC pré-gravidez [492]. As estimativas de exposição com base em uma amostra pontual podem enviesar os resultados para o nulo porque podem não refletir as exposições pré e pós-natais [493].
Ao avaliar as implicações a longo prazo das exposições de DDE/DDT em baixas doses, é crucial considerar a coexposição potencial a outros produtos químicos com propriedades físico-químicas semelhantes e possíveis mecanismos de ação, como outros agrotóxicos organoclorados e certos PCBs. Estes geralmente mostram correlações moderadas a altas [494] que adicionam confusão residual e mascaram efeitos individuais [495]. As concentrações de DDT e seus metabólitos provavelmente variarão significativamente em diferentes países devido a variações em seu uso e quando foi proibido. Os níveis medidos em países com menos uso e onde as medições foram feitas mais recentemente tenderão a ser mais baixos e resultarão em diferenças mínimas entre os quartis de concentrações, tornando as associações com a obesidade difíceis de avaliar.
4.10.4 . Integração e resumo de evidências
Uma revisão sistemática de 2017 de dados in vitro, animais e epidemiológicos sobre exposições ao DDT e obesidade concluiu que as evidências indicavam que o DDT era “presumivelmente” obesogênico para humanos [461]. Os dados in vitro e em animais apoiam fortemente o DDT como obesogênico. Com base no número de estudos prospectivos positivos em humanos, é altamente provável que o DDT seja um obesógeno humano. Estudos em animais e humanos mostraram transmissão obesogênica ao longo de gerações. Assim, um POP banido há quase 50 anos ainda desempenha um papel na atual pandemia de obesidade, o que indica a necessidade de cautela com outras exposições químicas que podem causar efeitos multigeracionais.
4.11 . Dioxinas e PCBs
As policlorodibenzo-p-dioxinas e dibenzofuranos (PCDD/PCDFs), comumente agrupadas como dioxinas, são subprodutos liberados durante a combustão de compostos orgânicos ou a fabricação de organoclorados. PCBs foram usados em transformadores elétricos e capacitores por causa de sua resistência à temperatura e pressão. Dioxinas policloradas, dibenzofuranos e PCBs semelhantes a dioxinas coplanares (dl) compartilham estruturas e toxicidade semelhantes, pois se ligam ao AhR e ativam enzimas do metabolismo xenobiótico [105]. São POPs prototípicos que persistem por muitos anos e afetam negativamente os seres humanos e os ecossistemas. A Convenção de Estocolmo proibiu seu uso e produção em 2001, mas ainda são detectáveis em ecossistemas e matrizes biológicas. Eles são armazenados no tecido adiposo e liberados durante a perda de peso. Como existem 209 PCBs, os estudos geralmente se concentram em um PCB específico ou em uma mistura padrão de PCBs. Enquanto os dl-PCBs com estrutura molecular coplanar podem atuar como dioxinas, ou seja, ativar AhR, os chamados PCBs não semelhante à dioxina (não dl) com estrutura não coplanar têm diferentes modos de ação tóxicos. Assim, os efeitos de misturas de diferentes PCBs dependerão da contribuição relativa de ambos os grupos para sua composição.
4.11.1 . Estudos in vitro
O TCDDioxina (nt.: sempre lembrar que foi esta molécula que estava presente no veneno Agente Laranja da guerra do Vietnã e no desastre de Seveso no norte da Itália) é um agonista prototípico de AhR com alta afinidade de ligação. Apresenta efeitos anti-adipogênicos com expressão diminuída de C/EBPβ, PPARγ2, fatores adipogênicos chave ou aP2 e GLUT4, diminuição da captação de glicose ou atividade de LPL em células 3T3-L1, células C3H10T1/2 e adipócitos primários de rato [496], [497 ], [498]. Os efeitos dos PCBs na adipogênese in vitro são específicos de congêneres. O PCB 126, um dl-PCB que ativa o AhR, exibe respostas complexas. É antiadipogênico em pré-adipócitos humanos [499] e bloqueia o “bege ou beiging” (nt.: o ‘beiging’ está associado à ativação da proteína de desacoplamento, UCP1, e é conhecido por ser importante para prevenir a hipertrofia adiposa e o desenvolvimento de resistência à insulina) em pré-adipócitos humanos. Isso pode interromper a homeostase energética e indiretamente promover o desenvolvimento de obesidade e diabetes [500]. O PCB 126 estimula a liberação de adipocinas de adipócitos 3T3-L1 e células hMADS [105], [500]. Resultados contraditórios foram observados com outro dl-PCB, PCB 77, que apresentou efeitos pró-adipogênicos em células 3T3-L1 em baixa concentração e efeitos antiadipogênicos em concentrações mais altas [501]. Os não-dl-PCBs (PCB 101, 138, 153 e 118) promoveram adipogênese em células 3T3-L1, revisadas em [15]. Os efeitos de não-dl-PCBs na adipogênese podem estar parcialmente relacionados à sua capacidade de ativar outras vias além do AhR envolvidas no controle de funções metabólicas. No geral, os efeitos in vitro dos ligantes AhR na adipogênese não parecem ser consistentes e dependem do sistema celular.
4.11.2 . Estudos de roedores
Os compostos semelhantes ao TCDD afetam a homeostase metabólica e as interações hospedeiro-microbioma. A análise metabolômica de camundongos tratados com 2,3,7,8-tetraclorodibenzofurano (TCDF), um ligante de AhR ambiental com potência semelhante ao TCDD, revelou disfunção metabólica significativa na gliconeogênese, glicogenólise e lipogênese [502]. A composição da microbiota intestinal é alterada em camundongos knockout para AhR [503]. Os ligantes de AhR dietéticos podem moldar a composição da microbiota intestinal e o funcionamento adequado, sugerindo que o TCDD pode alterar tanto a composição do microbioma quanto as interações hospedeiro-microbiota [504].
Estudos iniciais associaram a exposição a altas doses (25–200 µg/kg) de TCDD com hipoglicemia, hipoinsulinemia devido a apoptose de células β e hipofagia, levando à síndrome de emaciação revisada em [505]. Doses mais baixas (10 µg/kg) alteraram as concentrações séricas de lipídios, reduzindo as taxas de síntese hepática e de ácidos graxos adiposos e a atividade das enzimas gliconeogênicas hepáticas [506], [507]. No entanto, resultados opostos foram observados usando PCB 77, outro dl-PCB. PCB-77 aumentou a massa corporal em camundongos C57BL/6 de tipo selvagem, mas não em camundongos Ahr – /- [501]. A quinurenina (KYN), um agonista do AhR produzido devido ao metabolismo do triptofano, causou ganho de peso, fígado gorduroso e hiperglicemia em camundongos alimentados com dieta com baixo teor de gordura [508]. A exposição de camundongos fêmeas ao TCDD durante a lactação e a gravidez aumentou sua suscetibilidade à obesidade e diabetes induzidas por HFD [509]. O TCDD também é obesogênico em camundongos adultos alimentados com HFD [510]. Portanto, os compostos do tipo TCDD podem ter impacto na obesidade in vivo , dependendo das doses utilizadas e do tipo de dieta [511].
Por fim, PCB153 é um obesogênico que exacerbou a esteatose hepática, alterou a expressão de adipocitocinas e interrompeu o metabolismo lipídico hepático em camundongos adultos, mas apenas quando administrado com um HFD [111]. Este estudo também suporta um modelo em que o fígado é onde a sinalização do AhR é importante na obesidade.
4.11.3 . Estudos humanos
Dados epidemiológicos de coortes com exposições acidentais (veteranos da guerra do Vietnã, residentes perto de Seveso) ou ocupacionais (agricultores) a altas doses de dioxina ou POPs relataram um risco aumentado de diabetes e metabolismo de glicose e sinalização de insulina prejudicados, revisados em [512], [513 ], [514], de acordo com dados de estudos com roedores. No entanto, não há dados claros associando a exposição ao TCDD a um risco aumentado de obesidade. Outros agonistas do AhR, como os PCBs, foram associados ao aumento do peso corporal, IMC, massa gorda ou circunferência da cintura em alguns estudos epidemiológicos, revisados em [515], [516]. Uma meta-análise de 2020 descobriu que onze estudos transversais relataram associações positivas entre POPs clorados e obesidade, enquanto sete relataram relações negativas [248]. Um estudo relatou uma relação positiva para PCBs menos clorados e uma relação negativa para PCBs altamente clorados [468]. Estudos adicionais foram menos consistentes. Existem muitas explicações para esses resultados contraditórios, incluindo diferenças nas populações estudadas, co-exposição com outros POPs, como agrotóxicos organoclorados, diferenças nos níveis de exposição, etc. Em geral, os dados de estudos transversais de PCBs são inconclusivos.
4.11.4 . Integração e resumo de evidências
Humanos, roedores e estudos in vitro indicaram que as evidências que favorecem os efeitos pró-adipogênicos associados às dioxinas e PCBs são atualmente fracas. Isso não significa que esses compostos não exibam efeitos obesogênicos em determinadas circunstâncias, por exemplo, quando combinados com HFD. É provável que os efeitos destes compostos sejam dependentes da dose. Dioxinas, furanos e alguns PCBs agem por ativação de AhR, outros PCBs possuem diferentes modos de ação, e seus efeitos devem ser explorados com mais detalhes. Um fator de confusão é a possível co-exposição com outros POPs clorados, como agrotóxicos organoclorados. Embora os efeitos obesogênicos das dioxinas e PCBs não sejam claros, seus efeitos inflamatórios e metabólicos são muito mais consistentes. Assim, em indivíduos obesos, a exposição a esses contaminantes pode aumentar a probabilidade de efeitos metabólicos e patogênicos relacionados à obesidade.
4.12 . Substâncias per e polifluroalquil (PFAS)
Os PFAS são um grande grupo (> 5.000) de compostos químicos sintéticos não regulamentados com múltiplos átomos de flúor ligados a uma cadeia de alquila. PFAS inclui PFOA, PFOS e GenX que são amplamente utilizados em aplicações industriais e produtos de consumo [517]. Os usos incluem embalagens de alimentos, revestimentos para panelas, móveis, instalações de fabricação e processamento, aeroportos e instalações militares que usam espumas de combate a incêndios (nt.: destaque com negrito feito pela tradução). PFAS foram detectados no ar, solo e água, incluindo água potável [518]. A forte ligação carbono-flúor torna o PFAS altamente resistente à degradação; assim, eles são chamados de “forever chemicals/químicos para sempre” com meias-vidas em humanos de meses a anos [519] (nt.: alguns pesquisadores chegam a imaginar que sua degradação pode se dar em 1.000 anos!). O PFAS pode atravessar a placenta e ser detectável nos tecidos fetais e no sangue do cordão umbilical [520], [521], [522]. PFAS pode bioacumular em cadeias alimentares e humanos.
4.12.1 . Estudos in vitro
O PFOA pode induzir a diferenciação em pré-adipócitos 3T3-L1 ativando o PPARγ e desmetilando o promotor PPARγ, regulando positivamente a expressão da proteína PPARγ [65]. O substituto de PFOS, ácido perfluorobutano sulfônico (PFBS), estimulou a diferenciação de adipócitos e aumentou as vias de sinalização dependentes de PPARγ e MER/ERK [523]. Outro estudo mostrou apenas efeitos modestos de PFOA e PFOS na adipogênese em células 3T3-L1 [407]; entretanto, este estudo não mostrou efeito do BPA, que deveria ter sido positivo. PFOA, PFOS, ácido perfluoronanóico (PFNA) e ácido perfluorhexanossulfônico (PFHxS) aumentaram o número de células, diminuíram o tamanho das células, aumentaram os lipídios totais e a expressão aumentada de genes adipogênicos em células 3T3-L1 [524].
PFOA e PFOS ativados de forma robusta PPARα, PPARγ, PXR e CAR. Em contraste, eles ativaram marginalmente LXR e FXR conforme medido pela regulação positiva da expressão do gene alvo em hepatócitos de ratos e humanos [102]. O tratamento com PFOS de células HepG2 aumentou os níveis de triglicerídeos e diminuiu a Akt fosforilada (nt.: proteína -quinase B- desempenha vários importantes processos celulares, incluindo o metabolismo da glicose, apoptose dentre outros), levando eventualmente à resistência à insulina [525]. Esses estudos indicam vários papéis potenciais de PFOA e PFOS na obesidade.
4.12.2 . Estudos de peixe-zebra
Quando os embriões de peixe-zebra foram expostos ao PFOS durante o desenvolvimento, os ácidos graxos saturados láurico (C12:0) e mirístico (C14:0) aumentaram quatro dias após a fertilização (dpf), e os níveis de expressão de todos os três genes PPAR foram reduzidos [526]. A incidência de morfologias de ilhotas aberrantes, áreas de ilhotas principais e adiposidade aumentaram em 15 dpf larvas e 30 dpf juvenis. A exposição in utero ao PFOS provocou a acumulação de gotículas de lípidos hepáticos no peixe-zebra [527].
4.12.3 . Estudos de roedores
De acordo com estudos in vitro , existem dados consistentes mostrando a regulação positiva de genes alvo de PPARα por PFAS, como aqueles envolvidos no metabolismo de ácidos graxos, glicose ou glicogênio peroxissoma, colesterol ou biossíntese de ácidos biliares [528], [529]. No entanto, os efeitos adipogênicos associados ao PFAS foram raros. Em camundongos, PFOS ou PFOA exacerbaram o conteúdo lipídico total e hepático induzido por HFD [530], [531]. PFOS ou PFOA sozinhos diminuíram o teor de ácidos graxos livres no fígado, colesterol total e triglicerídeos em camundongos e ratos [531], [532]. Este efeito hipolipemiante é consistente com a ativação do PPARα. A exposição de camundongos adultos ao PFOA ou PFOS reduziu o WAT devido à redução da ingestão de alimentos e depende do recrutamento de termogênese mediada pelo tecido adiposo marrom [533]. A exposição do desenvolvimento ao PFOA aumentou a leptina e a insulina séricas e aumentou o peso na meia-idade em camundongos [534].
4.12.4 . Estudos humanos
Estudos transversais e longitudinais examinaram associações entre PFAS e peso corporal ou adiposidade em adultos. Em estudos transversais, as concentrações séricas ou plasmáticas de PFAS em adultos foram associadas a maior adiposidade e maior prevalência de excesso de peso [535], síndrome metabólica [536], [537] e diabetes [538]. Estudos em crianças e adolescentes produziram resultados variáveis em relação às associações transversais entre as concentrações séricas ou plasmáticas de PFAS e obesidade em crianças: alguns relataram menor adiposidade com certos PFAS [539], [540]. Outros relataram uma maior prevalência de obesidade [541]. Dois estudos de associação de metaboloma em crianças mostraram PFAS correlacionado com vias metabólicas alteradas, incluindo lipídios e aminoácidos [542], [543]. Outro estudo mostrou que as pessoas com os níveis mais altos de PFAS no sangue tinham taxas metabólicas de repouso mais baixas e recuperavam o peso mais rapidamente após a dieta do que aquelas com os níveis mais baixos de PFAS [544].
Um estudo prospectivo de adultos com risco elevado de diabetes descobriu que as concentrações plasmáticas de PFAS no início do estudo estavam associadas a maior ganho de peso durante os nove anos subsequentes de acompanhamento; no entanto, não foram observados efeitos num subconjunto de participantes aleatorizados para um programa de intervenção no estilo de vida para prevenir a diabetes [545]. Um estudo longitudinal de crianças e adolescentes descobriu que as concentrações plasmáticas de PFOS aos 9 anos de idade se correlacionavam com um maior IMC, dobras cutâneas e circunferência da cintura aos 15 anos [546].
O baixo peso ao nascer é o resultado mais consistente relatado de exposições gestacionais ao PFOA em humanos. Uma revisão sistemática de bebês nascidos de mães com concentrações séricas mais altas de PFOA na gravidez associou a exposição a baixo peso ao nascer [547] ou que a exposição a PFOA ou PFOS levou a baixo peso ao nascer [548] e adiposidade reduzida ao nascimento [549], [550]. O baixo peso ao nascer está associado ao aumento do ganho de peso mais tarde na vida.
Vários estudos relataram que certos PFAS medidos no sangue materno durante a gravidez estavam associados a um maior ganho de peso gestacional [551], [552], [553], [554], [555]. O ganho de peso gestacional está associado a uma maior adiposidade infantil ao nascimento [556]. As concentrações plasmáticas de PFOA foram associadas ao metabolismo da glicose prejudicado e oxidação lipídica entre adultos jovens com sobrepeso e obesos na Califórnia [557].
Vários estudos epidemiológicos relataram que as concentrações pré-natais de PFOA ou PFOS estavam associadas a maior peso e adiposidade entre crianças de 5 a 9 anos [487], [488], [558], [559], adultos jovens [560] e crianças com sobrepeso na idade 5 [488]. O ácido perfluoroundecanóico (PFDA) no plasma materno, mas não o PFNA, foi associado a uma maior adiposidade na prole aos 4-8 anos [561]. Uma meta-análise dos dados da coorte humana relatou uma razão de risco estatisticamente significativa de obesidade infantil de 1,25, comparando exposições de PFOA mais altas e mais baixas no início da vida [559]. Em contraste, outros relataram associações nulas ou inversas [490], [562], [563]. Níveis mais altos de PFAS não foram associados ao aumento do IMC da prole aos 5 anos em uma coorte sueca, enquanto níveis mais baixos foram [488]. Esta relação de dose não monotónica entre os níveis de PFOA e o IMC foi confirmada num estudo diferente [558].
4.12.5 . Integração e resumo de evidências
Os dados in vitro , de peixe-zebra e de roedores indicam que o PFOA e o PFOS são obesogênicos. Embora não sejam totalmente consistentes, os dados humanos suportam PFOA e PFOS como obesogênicos. Apenas alguns dos milhares de PFAS foram examinados; portanto, mais dados são necessários para entender o papel do PFAS na obesidade.
4.13 . Obesogênios adicionais de preocupação
Esta seção contém uma descrição de produtos químicos designados como obesogênicos com base em dados de vários laboratórios e fontes (in vitro , peixe-zebra, roedores, humanos). Existem lacunas de dados que limitam as conclusões tiradas.
4.13.1 . Adoçantes não nutritivos
Os adoçantes podem ter um sabor muito mais doce que o açúcar e conter poucas calorias [564]. A ampla gama de edulcorantes pode ser separada em grupos nutritivos e não nutritivos (Fig. 4). Os adoçantes artificiais são fabricados e usados com mais frequência na indústria alimentícia do que os adoçantes naturais devido à sua relação custo-benefício [565]. Exemplos incluem aspartame, neotame, sacarina, sucralose, acessulfame de potássio e ciclamato [564]. Os adoçantes naturais podem ser produzidos a partir de várias fontes, incluindo seiva de plantas, mel, açúcares de frutas e vegetais, bem como glicosídeos de esteviol, frutose, xilitol, eritritol e yacon (Smallanthus sonchifolius) são frequentemente apontados como “mais saudáveis” devido ao seu índice glicêmico mais baixo [564].

Fig. 4 . Classificação dos edulcorantes nutritivos e não nutritivos . Há uma variedade de adoçantes nutritivos e não nutritivos. Este esquema de classificação mostra as diferentes categorias e onde cada nutriente e não nutritivo se enquadram para ajudar a entender sua estrutura química e química.
Os adoçantes não nutritivos (NNS) substituíram e reduziram a ingestão de sacarose à medida que a obesidade se tornou mais prevalente. NNS são comercializados como alternativas mais saudáveis [566]. Ainda assim, suas ligações com efeitos adversos à saúde, como distúrbios reprodutivos e neurológicos, câncer, alterações na microbiota intestinal e síndrome metabólica, levantaram questões sobre a segurança do NNS [567], [568], [569]. Aspartame, sucralose e sacarina têm sido associados à síndrome metabólica. Embora sejam obesogênicos, eles podem não estar agindo por meio de um mecanismo endócrino.
4.13.2 . Aspartame e Sucralose
Um estudo triangulado de consumo/exposição de aspartame e sucralose em uma coorte humana, estudo in vivo em camundongos e análise de células in vitro (adipócitos 3T3-L1) apresentou evidências de que o consumo materno de NNS durante a gravidez pode programar o risco de obesidade na prole por meio de efeitos na adiposidade e diferenciação de adipócitos [570]. A exposição à sucralose em estágios iniciais de diferenciação em pré-adipócitos 3T3-L1 causou aumento do acúmulo de lipídios e expressão de genes de diferenciação de adipócitos (por exemplo, C/EBPα, FABP4 e FAS). Camundongos C57BL6J grávidas expostos ao aspartame e sucralose em doses relevantes para o consumo humano deram à luz descendentes que desenvolveram peso corporal elevado, adiposidade e resistência à insulina. Isso foi especialmente evidente nos homens, que apresentaram aumentos de gordura corporal de 47% (aspartame) e 15% (sucralose). Por fim, crianças nascidas de 2.298 mães que consumiam regularmente bebidas contendo aspartame e sucralose apresentaram IMC elevado aos três anos de idade [570]. Juntos, esses estudos indicaram que certos adoçantes artificiais consumidos durante a gravidez podem aumentar o risco de obesidade na prole por meio de efeitos na adipogênese por meio de genes-chave de diferenciação de adipócitos. Esses estudos usaram doses de aspartame e sucralose relevantes para o consumo humano na América do Norte, mas abaixo da ingestão diária aceitável (ADI) estabelecida pela Food and Drug Administration (FDA) [570]. Esses achados podem ser menos relevantes para as populações europeias porque a ADI recomendada estabelecida pela Autoridade Europeia para a Segurança dos Alimentos (EFSA) está abaixo das concentrações do estudo.
4.13.3 . Sucralose
A sucralose reduziu o consumo de alimentos, mas aumentou o peso corporal em camundongos CD1 de 21 dias de idade, e foi hipotetizado que a intensidade da doçura da sucralose aumentou a preferência por alimentos com sabor doce, levando ao ganho de peso. A sucralose também reduziu a secreção de hormônios intestinais reguladores do apetite, como o polipeptídeo inibidor gástrico (GIP) [571]. Outro estudo demonstrou alterações no microbioma intestinal resultando em intolerância à glicose após o tratamento com sucralose [572]. A exposição de MSCs à sucralose promoveu uma resposta inflamatória aguda aumentando a adipogênese e a concentração de ROS [573]. Consequentemente, a sucralose pode afetar o sistema endócrino e aumentar o risco de obesidade e DM2 mesmo em doses abaixo da IDA recomendada.
Um estudo in vivo usando ratos machos Sprague Dawley demonstrou que a sucralose pode provocar distúrbios na atividade do eixo da tireoide [574]. Como o eixo da tireoide é necessário para regular o desenvolvimento, o crescimento e o metabolismo energético, sua interrupção pode aumentar o risco de obesidade.
Estudos clínicos descobriram que a sucralose pode aumentar a resistência à insulina. Um ensaio clínico randomizado relatou que o consumo de sucralose aumentou a resistência à insulina após apenas duas semanas de exposição e sem a necessidade de exposição contínua [575]. A dose de sucralose usada neste estudo foi de 15% da ADI recomendada estabelecida pelo Joint FAO/WHO Expert Committee on Food Additives (JECFA). Este estudo levantou preocupações sobre o consumo de sucralose mesmo por curtos períodos e abaixo do nível de consumo de IDA definido, mas o acompanhamento ocorreu logo após o término da dosagem. Mais pesquisas envolvendo um período de estudo mais prolongado e período pós-intervenção serão necessárias para obter resultados adicionais em relação à significância clínica. O consumo de sucralose com carboidratos prejudicou o metabolismo da glicose e reduziu a sensibilidade à insulina, levando ao diabetes. No entanto, o tamanho da amostra de adultos saudáveis foi limitado (n=45) e realizado dentro de uma faixa etária estreita (20-45 anos) [576]. Assim, mais estudos são necessários para fundamentar esse achado.
4.13.4 . Sacarina
O peso corporal de ratos machos adultos tratados com 5 mg/kg de sacarina aumentou 59% e 67% após 60 e 120 dias de exposição, respectivamente [577]. Pensa-se que a sacarina e outros adoçantes artificiais aumentam a ingestão de alimentos e a expressão do receptor de grelina no hipotálamo, levando a excessos [578].
4.14 . Produtos químicos agrícolas
O papel dos agroquímicos (incluindo agrotóxicos) na obesidade foi recentemente revisto [448].
4.14.1 . Clorpirifós
O clorpirifós é um inseticida organofosforado com exposição humana significativa porque é amplamente utilizado em várias culturas de campo em todo o mundo [579]. O clorpirifós e dois de seus metabólitos aumentaram o armazenamento de lipídios e o número de pré-adipócitos 3T3L-1 diferenciados [580]. Esses efeitos ocorreram via regulação de PPARγ e C/EBPα fornecendo um possível mecanismo para os efeitos obesogênicos.
Ratos adultos que receberam 5 mg/kg/dia de clorpirifós por dois meses pesavam mais e apresentavam aumento do peso das bolsas de gordura perirrenal [581]. Camundongos adultos expressando o gene ApoE3 humano, mas não o gene ApoE3 ou 4, comeram mais e tiveram aumento do peso corporal e altos níveis de leptina após exposição ao clorpirifós por 13 semanas [582]. Em um conjunto relacionado de experimentos, a interação do genótipo (gene APOE4), sexo e HFD no ganho de peso estimulado pela exposição pós-natal ao clorpirifós foi avaliada [583]. Apenas os machos do grupo tratado com clorpirifós expostos ao HFD ganharam mais peso do que o grupo controle HFD. Camundongos APOE3 e APOE4 machos foram expostos a clorpirifós (1 mg/kg/dia) nos dias pós-natais 10-15 e novamente aos cinco meses de idade. Apenas camundongos APOE4 tiveram aumento de peso na idade adulta, mas ambos os camundongos APOE3 e APOE4 expostos ao clorpirifós aumentaram a ingestão alimentar. A expressão de NPY foi aumentada em camundongos APOE4 [584]. Ratos e camundongos adultos expostos ao clorpirifós (C57Bl/J6 e CD-1) exibiram um aumento do peso corporal e alterações na composição do microbioma intestinal [585], [586], [587]. Quando o clorpirifós foi administrado a ratos Wistar machos em várias idades (2 meses, 10 meses e 20 meses) por 45 dias, os animais mais velhos foram mais sensíveis aos efeitos metabólicos [588]. A exposição ao clorpirifós durante o desenvolvimento (dia gestacional (GD)7 ao DPN 21) resultou em ganho de peso apenas em homens na idade adulta com uma dose-resposta não monotônica [589]. Esses dados laboratoriais usando diferentes modelos animais indicam que o clorpirifós é um obesogênico e pode atuar por meio de alterações no microbioma intestinal e na ingestão alimentar.
4.14.2 . Neonicotinóides
O inseticida neonicotinóide imidaclopride induz pré-adipócitos 3T3L-1 a se diferenciarem em adipócitos [590]. Além disso, em um modelo de camundongo adulto (C57Bl/6J), os efeitos de um ganho de peso e adiposidade induzidos por HFD foram aumentados pela exposição ao imidaclopride por 12 semanas [591], [592]. A exposição gestacional ao imidaclopride induziu hiperglicemia, resistência à insulina e dislipidemia na prole feminina; no entanto, o peso corporal ou do tecido adiposo não foi examinado [593].
4.14.3 . Permetrina
A permetrina é um inseticida piretróide. A exposição de camundongos adultos C57Bl/6J à permetrina a 50, 500 e 5000 μg/kg/dia resultou em aumento do peso corporal, massa gorda e resistência à insulina, mas apenas em um HFD [594]. A permetrina também aumentou a adipogênese em um modelo in vitro e alterações nos níveis de cálcio intracelular [595], [596].
4.14.4 . Tolilfluanida
O TF é uma fenilsulfamida utilizada como fungicida na agricultura e como biocida de reforço em tintas marinhas. O TF demonstrou promover adipogênese na linhagem celular 3T3-L1, presumivelmente através da ativação da sinalização GR [87]. O tecido adiposo primário murino e humano exposto ao TF ex vivo exibiu resistência à insulina decorrente de uma regulação negativa específica do substrato-1 do receptor de insulina mediada pela ativação da sinalização GR [597]. Em camundongos machos C57BL/6 expostos ao TF por meio de sua dieta por 12 semanas abaixo dos níveis observados sem efeitos adversos, o fungicida aumentou o ganho de peso e a massa gorda enquanto induzia resistência à insulina, intolerância à glicose e perturbava os ritmos circadianos. O WAT desses camundongos mostrou um aumento na expressão gênica dependente de GR [141]. Outro estudo adulto usando um modelo de camundongo transgênico e a mesma concentração de TF que o estudo de desenvolvimento acima não mostrou nenhum ganho de peso na prole [598]. Curiosamente, os efeitos do TF podem depender do conteúdo de macronutrientes da dieta, com o fungicida promovendo o acúmulo visceral de WAT quando camundongos adultos foram alimentados com uma dieta rica em sacarose, mas não com HFD [599].
A exposição ao TF durante o desenvolvimento, na dose de 67 mg/kg/dia através da dieta, semelhante à dose utilizada no estudo em adultos [141], resultou em menor peso ao nascer, peso reduzido ao desmame e adiposidade reduzida na prole feminina adulta sem mudança em homens [600]. É provável que a dose administrada durante a gravidez, embora a mesma administrada a adultos, tenha sido muito alta e, portanto, tóxica para o feto em desenvolvimento. Não há estudos epidemiológicos disponíveis para determinar os efeitos do TF em humanos; no entanto, esses dados indicam que o TF é um obesogênico.
4.15 . Dieta ocidental
A dieta ocidental, caracterizada por alimentos ultraprocessados, pobres em nutrientes (contendo aditivos, corantes e frutose), rica em gordura, pobre em fibras e rica em carboidratos refinados e açúcar, está fortemente associada à obesidade e doenças metabólicas relacionadas [601]. O consumo de alimentos ultraprocessados se correlaciona com o IMC nos EUA e em muitos países europeus [602]. A dieta ocidental pode induzir a obesidade ao comprometer a função das células β pancreáticas, aumentando os AGL no sangue e criando resistência à insulina [603]. A dieta ocidental pode alterar o microbioma e estimular a inflamação induzida pelo intestino, levando ao metabolismo alterado e à obesidade [601]. Os alimentos processados também contêm muitos produtos químicos que não foram testados quanto aos seus efeitos obesogênicos, incluindo alguns obesogênicos conhecidos como BPA e ftalatos, agrotóxicos e frutose [604]. Camundongos adultos alimentados com HFD/high-fat diet por seis semanas ganharam peso. Quando eles foram alterados para ração padrão, eles mostraram ansiedade e maior motivação para sacarose e alimentos ricos em gordura, sugerindo que a dieta estimulou as partes de dependência alimentar de seus cérebros [605]. Uma dieta rica em gordura saturada e pobre em frutas e vegetais pode selecionar contra um microbioma intestinal associado à massa corporal magra. Foi proposto que o consumo excessivo da dieta ocidental sustenta níveis aumentados de KYN/kynurenine (nt.: um metabólito do aminoácido – triptofano usado na produção de niacina). Uma dieta com baixo teor de gordura contendo atividade de AhR induzida por KYN em camundongos, causando ganho de peso, fígado gorduroso e hiperglicemia [508], [606]. Além de suas deficiências nutricionais, a dieta ocidental também é obesogênica porque contém vários obesogênios reais, incluindo agrotóxicos em frutas e vegetais e BPA, ftalatos e PFAS das embalagens. Conservantes, emulsificantes e aditivos encontrados em alimentos processados que podem estar contribuindo para as propriedades obesogênicas da dieta ocidental são descritos abaixo.
4.15.1 . Frutose
Açúcares adicionados ou bebidas adoçadas com açúcar estão associados à resistência à insulina, DHGNA, obesidade visceral e síndrome metabólica, revisado em [607]. A sacarose é composta de partes iguais de glicose e frutose. No entanto, os efeitos obesogênicos do açúcar são impulsionados principalmente pela frutose e não pela glicose [608]. A frutose é metabolizada principalmente no fígado e é um mediador da DHGNA [609]. O excesso de frutose supera a capacidade das mitocôndrias hepáticas e o excesso é convertido em gordura hepática, levando à resistência à insulina [610]. A frutose não desliga o hormônio da fome grelina, então o cérebro não responde adequadamente aos sinais de saciedade [602], [611]. A frutose também é viciante. A frutose, especialmente consumida durante o desenvolvimento e na primeira infância, causa ganho de peso [612]; assim, a frutose pode ser caracterizada como um obesogênio.
4.15.2 . Metil e butilparabeno
Os parabenos são amplamente utilizados como conservantes em alimentos, produtos de higiene pessoal e cosméticos devido às suas propriedades antimicrobianas e antifúngicas e são encontrados em amostras de urina da população em geral [613]. Os parabenos promoveram adipogênese em células 3T3-L1 [614] e MSCs [615]. Exposição de camundongos ao butilparabeno (BP) na faixa de níveis de exposição humana, in utero e durante a amamentação, resultou em aumento do peso corporal, maior massa gorda, diminuição da massa magra e aumento do tamanho dos adipócitos na prole feminina, mas não masculina. O aumento do peso correlacionou-se com o aumento da ingestão semanal de ração, baixos níveis de RNA POMC e regulação negativa do receptor de leptina. Isso sugeriu um efeito nos adipócitos e no centro de saciedade do cérebro, resultando em aumento da ingestão de alimentos [616]. Ratos expostos à BP desde o nascimento até a idade adulta exibiram alterações na microbiota intestinal durante a adolescência, mas o efeito foi perdido na idade adulta [617]. Um estudo de coorte de nascimento indicou que a exposição à pressão arterial levou ao excesso de peso na primeira infância [616]. Esses estudos in vitro , em animais e epidemiologia mostram que os parabenos são obesogênicos.
4.15.3 . Tween 80®/Carboximetilcelulose
Os aditivos alimentares (agentes emulsificantes) Tween 80® e carboximetilcelulose (CMC) são provavelmente obesogênicos devido aos seus efeitos no microbioma. A exposição de camundongos adultos ao CMC ou Tween 80® (1%) por 12 semanas levou ao aumento do peso corporal e do peso da gordura, aumento da ingestão de alimentos, aumento da glicemia em jejum, inflamação de baixo grau e microbiota alterada. De fato, uma microbiota alterada é necessária e suficiente para os efeitos metabólicos induzidos por emulsificantes, como indicado por camundongos livres de germes e transplantes fecais [618]. Esses dados devem ser expandidos e repetidos devido à natureza ubíqua das exposições humanas a esses compostos .
4.15.4 . 3 – terc -butil-4-hidroxianisol
O 3-terc-butil-4-hidroxianisol (3-BHA) é amplamente utilizado como antioxidante em alimentos. A exposição de 18 semanas de camundongos adultos ao 3-BHA resultou em um aumento não monotônico no ganho de peso, aumento do peso da almofada de gordura, acúmulo de lipídios via regulação transcricional da adipogênese e metabolismo lipídico [619]. O 3-BHA também estimulou os pré-adipócitos 3T3-L1 da adipogênese, regulando os eventos a montante da via de sinalização PPARγ [620].
4.15.5 . Glutamato monossódico
O glutamato monossódico (MSG) é um intensificador de sabor usado em todo o mundo. Vários estudos em animais forneceram evidências causais e mecanicistas de que a ingestão parenteral de MSG causou aumento da gordura abdominal, dislipidemia, ganho de peso corporal total, hiperfagia e DM2, afetando o centro de alimentação hipotalâmico [622], [623], [624]. O MSG aumentou a secreção de peptídeo-1 semelhante ao glucagon (GLP-1) da linha celular pGIP/neo: STC-1, indicando uma possível ação no trato gastrointestinal (GI), além de seus efeitos no cérebro [625]. É desafiador mostrar resultados semelhantes em humanos porque não há controle populacional devido à presença onipresente de MSG em alimentos. O MSG é um obesogênico.
4.15.6 . Dioctil sulfosuccinato de sódio
Dioctil sulfosuccinato de sódio (DOSS) é um emulsificante alimentar e amaciante de fezes que é um obesogênio putativo devido à sua capacidade de induzir adipogênese no modelo de pré-adipócitos 3T3-L1 e ativar PPARγ [626]. DOSS foi administrado por via oral durante a gravidez em um modelo de roedor; a prole adulta do sexo masculino (mas não do sexo feminino) apresentou aumento da massa corporal, massa gorda visceral, diminuição da adiponectina plasmática, intolerância à glicose, aumento da leptina e resposta inflamatória [627]. Esses achados indicam que o DOSS deve ser examinado para propriedades obesogênicas em humanos devido à sua presença onipresente em alimentos processados.
4.16 . Cádmio
O Cd é um metal que ativa as vias de sinalização do estrogênio [628]. As ações do Cd no metabolismo foram revisadas [629], [630]. A exposição ocorre através de fontes alimentares, tabagismo e poluição do ar. O Cd tem uma meia-vida longa, chegando a 45 anos em humanos [631]. A exposição do desenvolvimento de camundongos a uma concentração equivalente à média geométrica dos níveis de Cd em mulheres americanas resultou em ganho de peso apenas em fêmeas após a puberdade [632]. A prole feminina também apresentou aumento do peso da gordura perigonadal aos 90 e 120 dias e aumento dos triglicerídeos totais, intolerância à glicose, resistência à insulina e esteatose hepática sem alteração na ingestão alimentar. O Cd também prejudicou o metabolismo da glicose, levando ao aumento da lipólise e da resistência à insulina em roedores e humanos, revisado em [633].
O Cd não estimulou a diferenciação 3T3-L1 [634], sugerindo que não atua diretamente nos adipócitos. A exposição ao Cd durante a gravidez em humanos levou a um risco aumentado de obesidade na prole, que foi recapitulada em um modelo de peixe-zebra [188]. Outro estudo de coorte de 470 participantes descobriu que as concentrações urinárias maternas de Cd durante o primeiro e terceiro trimestres de gravidez não estavam associadas aos escores z do IMC infantil aos 7 anos de idade [253]. Um estudo exploratório em 111 mulheres grávidas árabe-beduínas não encontrou uma associação das concentrações urinárias de Cd com o início da obesidade dois ou seis anos após a avaliação da exposição [635]. Um estudo em uma coorte de adultos do sul da Espanha mostrou uma associação transversal inversa das concentrações de Cd no tecido adiposo com a obesidade [636]. Mais estudos são necessários para esclarecer o papel do Cd na obesidade.
4.17 . Arsênio
O arsênio é um contaminante na água potável para milhões de pessoas em todo o mundo. É um conhecido carcinógeno e diabetogênico [637]. A exposição de pré-adipócitos 3T3-L1 ao arsênio inorgânico (iAS) diminuiu a adipogênese que se correlacionou com a regulação positiva de CHOP10 e inibição da atividade transcricional C/EBP [638]. iAS inibiu a expressão de PPARγ e C/EBP [639]. A exposição de camundongos CD-1 grávidas ao iAS (arsenito de sódio) no padrão de água potável da Agência de Proteção Ambiental dos EUA (EPA) de 10 ppb resultou em aumento do peso corporal, teor de gordura corporal, intolerância à glicose e aumento dos níveis de leptina e insulina em fêmeas [640] e descendência masculina [641]. Camundongos machos adultos C57BL/6J que receberam 50 mg/L via água potável não ganharam peso, mas melhoraram a resistência à insulina em um HFD [642]. O iAS suprimiu a obesidade induzida por HFD em camundongos C57BL/6 jovens e produziu intolerância à glicose [643]. Essas diferenças são provavelmente o resultado do uso de camundongos não consanguíneo (CD-1) versus consanguíneo (C57Bl/6) que diferiram na sensibilidade ao arsênio. O arsênio urinário está negativamente associado ao IMC em um estudo transversal de adolescentes em Taiwan [644]. Embora os resultados dos dois experimentos separados em camundongos CD-1 indiquem que o iAS pode ser um obesogênico, faltam dados mecanicistas e a relação entre iAS e obesidade requer mais estudos [645].
4.18 . Uma mistura de produtos químicos não convencionais da indústria de petróleo e gás
Uma mistura de 23 produtos químicos não convencionais da indústria de petróleo e gás comumente usados e amostras de água estimularam a adipogênese em pré-adipócitos 3T3-L1 por meio de mecanismos independentes e dependentes de PPARγ [646]. Da mesma forma, produtos químicos orgânicos extraídos de areias betuminosas processam a água estimulando o acúmulo de lipídios em células 3T3-L1, e vários compostos foram isolados e mostraram se ligar ao PPARγ [647]. A exposição gestacional a esta mistura em concentrações ambientais realistas aumentou o peso corporal em filhotes de camundongos machos e fêmeas até o início da idade adulta [648], [649]. Um estudo subsequente relatou gasto energético alterado, atividade reduzida e capacidade reduzida de responder a um desafio de dieta rica em gordura e açúcar após a exposição gestacional e lactacional a essa mesma mistura [649].
4.19 . Potenciais obesogênicos
Classificamos os produtos químicos como obesogênicos potenciais se houver apenas dados in vitro ou um único estudo in vivo infundado . Revisões recentes forneceram uma lista de mais de 50 produtos químicos que induziram a diferenciação de adipócitos em ensaios in vitro, fornecendo evidências de seu potencial como obesogênicos [17], [448]. Os seguintes produtos químicos são considerados potenciais obesogênicos.
4.19.1 . Glifosato
O glifosato é o herbicida mais utilizado globalmente, com foco em milho, soja e canola [650]. O glifosato foi negativo em ensaios adipogênicos 3T3-L1 [651], [652]. Curiosamente, três formulações diferentes de glifosato comercial, além do próprio glifosato, inibiram a proliferação de adipócitos e a diferenciação de células 3T3-L1 [652]. Também não há estudos em animais com foco na exposição do desenvolvimento e ganho de peso na prole. Um estudo intrigante expôs ratas grávidas a 25 mg/kg/dia durante os dias 8-14 de gestação [653]. Os descendentes foram então criados dentro da linhagem para gerar descendentes F2 e para gerar a descendência F3. Cerca de 40% dos machos e fêmeas das F2 e F3 apresentaram obesidade abdominal e aumento do tamanho dos adipócitos revelando herança transgeracional. Curiosamente, a prole F1 não apresentou esses efeitos. Esses resultados precisam ser verificados antes que o glifosato possa ser designado como obesogênico.
4.19.2 . Diazinon
Diazinon é um inseticida organofosforado amplamente utilizado. Foi proibido para uso residencial nos EUA em 2004, mas ainda é detectável em trabalhadores e frutas e vegetais [654]. O diazinon (1–100 µM) causou a indução e diferenciação da adipogênese e induziu a expressão de PPARγ e adiponectina na linhagem de células pré-adipócitos 3T3-L1 [655]. Diazinon é, portanto, um potencial obesogênico.
4.19.3 . Endrin
Endrin, um inseticida clorado, induz o acúmulo de lipídios adipócitos em pré-adipócitos 3T3-L1 através da atividade de sinalização GR [87].
4.19.4 . Agrotóxicos de estrobilurina
Os agrotóxicos estrobilurínicos piraclostrobina, azoxistrobina, fluoxastrobina e trifloxistrobina promoveram acúmulo de triglicerídeos e proliferação de pré-adipócitos em células 3T3-L1. Um estudo de seguimento sobre a piraclostrobina descreveu a acumulação de triglicéridos independente da diferenciação através de um mecanismo presumido de disfunção mitocondrial [656].
4.19.5 . Extratos de poeira doméstica
Os extratos de poeira doméstica contêm muitos produtos químicos identificados como EDCs (nt.: sigla em inglês para os disruptores endócrinos), incluindo ftalatos, PFAS e retardadores de chama [657]. Aproximadamente 90% dos extratos de poeira doméstica coletados de coortes humanas separadas no centro da Carolina do Norte promoveram acúmulo significativo de triglicerídeos e/ou proliferação em células 3T3-L1, indicando atividade obesogênica dos produtos químicos na poeira [656]. Avaliações mecanísticas sugeriram que as atividades adipogênicas da poeira doméstica não estão correlacionadas com o agonismo do PPARγ e que a atividade é mediada, pelo menos em parte, pelo antagonismo do TRβ [658].
4.19.6 . Alquilfenóis e álcoois
Alquilfenóis e álcoois são usados para produzir tensoativos etoxilados não iônicos encontrados em emulsificantes, produtos de limpeza doméstica e outros produtos de consumo [659] (nt.: o primeiro que foi constado ser um disruptor endócrino foi o nonilfenol encontrado em praticamente todos os detergentes que se usa nas cozinhas do Brasil, bem como em agrotóxicos, demonstrando que o que se aplica nas lavouras é mais venenoso do que se imagina!). Alquilfenóis, álcoois e etoxilatos em concentrações de 0,1 a 10 µM promoveram diferenciação de adipócitos e acúmulo de triglicerídeos em células murinas 3T3-L1 e duas linhas separadas de células-tronco mesenquimais humanas (hMSC). Este efeito adipogênico dependeu dos comprimentos da cadeia etoxilato, com os etoxilados de cadeia média tendo o impacto mais significativo em todos os três modelos [660]. Esses efeitos parecem ocorrer através de um mecanismo independente de PPARγ. Pesquisas recentes demonstraram efeitos obesogênicos de nonilfenol (nt.: aqui o ingrediente de agrotóxicos e detergentes domésticos mostrando ser objetivamente além de estar feminizando os machos como disruptor endócrino, obesogênicos) e seus etoxilatos em peixes-zebra expostos ao desenvolvimento, com peixes-zebra expostos exibindo aumento do peso corporal e adiposidade em relação aos controles [661]. Outro surfactante amplamente utilizado, o 4-hexilfenol, promoveu a diferenciação dos adipócitos e o acúmulo de lipídios nas células 3T3-L1 e estimulou a captação de ácido oleico nas células hepáticas HepG2 [662].
4.19.7 . Éter diglicidílico de bisfenol A e glicuronídeo de BPA
O éter diglicidílico de bisfenol A (BADGE) é usado para fabricar resinas epóxi, tintas e revestimento de recipientes de alimentos. Ele migra dos recipientes para os produtos e, portanto, é ingerido [663]. Não se decompõe em BPA e, portanto, não é uma fonte de BPA. Adipogênese induzida por BADGE em hMSCs e pré-adipócitos 3T3-L1 [664].
O BPA-glicuronídeo é o principal metabólito do BPA e é considerado biologicamente inativo. No entanto, células 3T3-L1 e pré-adipócitos humanos primários tratados com BPA-glicuronídeo exibem aumento do acúmulo de lipídios, expressão de genes e proteínas adipogênicas. Esses efeitos parecem ser mediados, pelo menos em parte, pela sinalização ER [665].
4.19.8 . Triclosan
O triclosan é um antimicrobiano usado em produtos domésticos e de cuidados pessoais [666]. A exposição ao triclosan ao peixe-zebra induziu DHGNA e inflamação hepática [125]. A exposição de camundongos ao triclosan e HFD resultou em um microbioma disfuncional com Bacteriodetes mais baixos e Firmicutes mais altos, como o encontrado em pacientes com NASH [128]. Uma meta-análise de sete estudos de coorte de nascimento que mediram o triclosan materno não encontrou efeitos no peso ao nascer neonatal [667]. A exposição ao triclosan na infância não afetou o IMC [655] em três estudos. Um estudo transversal em humanos do NHANES mostrou uma associação entre a exposição ao triclosan e o IMC [668]. Outro estudo transversal mostrou que o triclosan e o triclocarban estavam associados a um risco aumentado de obesidade infantil [669]. Assim, os dados são inconclusivos; portanto, o triclosan só pode ser classificado como um obesogênio potencial.
4.19.9 . Triflumizol
O triflumizol, um fungicida imidazol, induz adipogênese em células 3T3-L1 e MSCs humanas e aumenta o peso do tecido adiposo após exposição pré-natal em um modelo de camundongo [670]. É um ativador PPARγ conhecido que fornece um possível mecanismo para sua atividade obesogênica [670] .
4,20 . Atrazina
A atrazina é um herbicida de triazina. A administração crônica de atrazina em um modelo de rato adulto resultou em diminuição da taxa metabólica basal, aumento do peso corporal e resistência à insulina: um HFD exacerbou a resistência à insulina e a obesidade [671].
5 . Obesógenos e Obesidade Humana
As seções acima resumiram os dados que apoiam o papel dos obesogênicos no desenvolvimento e manutenção da obesidade. Estudos em animais demonstraram relações causais entre exposições a obesogênio e ganho de WAT, e estudos in vitro revelaram alguns mecanismos causais. Estudos epidemiológicos prospectivos mostrando resultados semelhantes comprovam uma relação causal entre a exposição ao obesogênio e a obesidade humana. Estudos em humanos e animais também mostraram que no útero e as exposições no início da vida foram os momentos mais sensíveis para a exposição porque isso alterou irreversivelmente a programação de várias partes do sistema metabólico, aumentando a suscetibilidade ao ganho de peso. Os efeitos sobre o desenvolvimento de algumas exposições a obesogênios persistem ao longo de gerações. A exposição ao obesogênio adulto pode causar ganho de peso. Esta seção integra os dados acima para apresentar um quadro mais coeso das ações e efeitos do obesogênio. A Fig. 6 apresenta uma visão geral dos locais e mecanismos conhecidos para obesogênicos. Destacamos exemplos de como os dados sobre locais e mecanismos de ações obesogênicas em estudos com animais imitam aspectos da etiologia da obesidade em humanos, que foram descritos na revisão complementar, Obesidade I. Alguns dados apresentados acima são repetidos nesta seção para integrar e destacar os efeitos dos obesogênios em vias humanas específicas.

Fig. 5 . Múltiplas ações de obesogênios. Os obesógenos além de aumentar o número e o tamanho dos adipócitos também afetam outros tecidos e processos. Vários dos principais efeitos dos obesogênios são mostrados aqui. Estes não são todos os tecidos e processos afetados, mas mostram os amplos efeitos dos produtos químicos obesogênicos. Os produtos químicos mostrados foram relatados como tendo esse efeito, mas isso não significa que outros produtos químicos também não tenham esses efeitos. Por exemplo, os três produtos químicos mostrados são os únicos que foram examinados por seus efeitos em vias e genes em adipócitos. Pode ser que outros obesogênicos também estimulem a produção de adipócitos disfuncionais. As cores são apenas para destacar o mesmo produto químico em vários mecanismos.

Fig. 6 . Composto de sítios e mecanismos de obesogênios. Os obesogênios, conforme descrito no texto, podem atuar por meio de diversos mecanismos e atuarem em diversos tecidos. Alguns mecanismos são diretos, como mecanismos de receptores e alterações epigenéticas e alguns, como sirtuínas, estresse oxidativo, inflamação, ritmos circadianos, alterações na ingestão alimentar e dependência alimentar e aumento do número e tamanho das células de gordura, podem resultar dos mecanismos. Os obesógenos têm ações diretas e indiretas em vários tecidos, como fígado, pâncreas, músculo, microbioma intestinal e cérebro. Assim, os obesogênios podem romper todos os locais e tecidos conhecidos por estarem envolvidos no controle do metabolismo.
Os seres humanos mantêm seu peso por longos períodos, apesar das mudanças em sua dieta. A capacidade de manter o peso resulta de um ponto de ajuste do peso corporal, um valor fisiológico em torno do qual o peso normal flutua. Os seres humanos têm dificuldade em perder peso, e é difícil manter a perda de peso. As pessoas obesas têm apenas uma chance anual de 15% de perder 5% do seu peso total sem cirurgia, e 83-87% daqueles que perdem com sucesso grandes quantidades de peso recuperam-no dentro de alguns anos [672], [673]. É mais difícil manter um peso normal hoje do que há 30 anos [674]. As razões para essa mudança nas últimas décadas são multifatoriais, mas a programação do desenvolvimento do metabolismo, resultando em um ponto de ajuste alterado para a manutenção do peso, é provavelmente a responsável. As ações do TBT imitam essa situação humana. Filhotes de camundongos grávidas que receberam TBT no útero aumentaram a gordura mais tarde na vida. Quatro gerações após a exposição ao TBT, os camundongos machos eram resistentes à perda de gordura em comparação com os controles, e esses animais eram extremamente sensíveis a uma HFD [44]. A HFD levou a um rápido ganho de peso nos animais TBT em comparação com os controles, e quando o teor de gordura da dieta foi reduzido, os machos do grupo TBT perderam menos peso do que os controles. Assim, a exposição ao TBT foi paralela à situação humana em que é mais fácil ganhar peso em uma HFD e mais difícil perder esse peso.
Indivíduos obesos preferem alimentos com alto teor de gordura e açúcar, têm maior desejo e antecipação por comida, trabalharão mais por comida, tendem a ser comedores emocionais com aumento da alimentação em resposta à ansiedade, depressão e mudanças de humor e obtêm uma recompensa maior da ingestão de alimentos do que indivíduos não obesos [675]. Exposições de desenvolvimento ao BPA podem influenciar o sistema de recompensa dopaminérgico e a rede de impulsividade do córtex [166]. A exposição ao BPA em crianças foi associada à hiperatividade e TDAH [167], que envolvem os mesmos circuitos neurológicos [171]. As concentrações séricas de BADGE.2H(2)0 foram positivamente associadas à incidência de transtorno de compulsão alimentar periódica em um estudo transversal de pacientes obesos [168].
Vários exemplos de efeitos de obesogênios em roedores que imitam a situação humana são mostrados na (Fig.5) acima.
A ingestão de alimentos é controlada pelos neurônios do apetite e da saciedade no cérebro. A exposição do desenvolvimento ao BPA resultou em ganho de peso devido ao aumento da ingestão de alimentos em alguns modelos animais, juntamente com alterações nos neurônios do apetite e da saciedade no cérebro: uma redução no número de neurônios da saciedade e um aumento nos neurônios do apetite. Camundongos expostos ao BPA foram insensíveis aos efeitos da leptina na expressão de POMC e exibiram inervação reduzida de POMC do PVN em comparação com os controles. Isso foi resgatado em mulheres pela administração pós-natal de leptina [244]. Machos e fêmeas expostos ao BPA foram resistentes aos efeitos da injeção de leptina no peso corporal [244]. O exame do mecanismo para o aumento da ingestão de alimentos após exposição ao DEHP em camundongos adultos revelou um aumento nos genes NPY e AgRP e uma diminuição da expressão de POMC, genes-chave envolvidos na regulação da ingestão de alimentos e peso corporal [285]. Ratos adultos machos expostos ao TBT por 54 dias exibiram aumento do peso corporal e massa gorda com níveis de mRNA de POMC, AgRP e CART no cérebro deprimidos. As fêmeas aumentaram a ingestão de alimentos, o que foi correlacionado com o aumento do NPY, indicando ações específicas no controle do comportamento alimentar [386]. As exposições ao OPFR também alteraram os controles cerebrais do comportamento alimentar [427]. Esses resultados são diretamente aplicáveis à situação humana de comer em excesso.
Comer demais com foco no papel da HFD é frequentemente apontado como uma causa da obesidade. O imidaclopride é um agrotóxico neonicotinóide que promove a obesidade induzida por HFD [591]. A HFD causou ganho de peso em um modelo de camundongo de exposição pré-natal à nicotina [198], um modelo adulto de exposição a clorpirifós [585], exposição de desenvolvimento à permetrina [594], atrazina [676], DDT [460] e BBP [263].
Epidemiologia e estudos em animais descobriram que a exposição a obesogênios durante o desenvolvimento pode resultar em ganho de peso precoce que persiste ao longo da vida. Em alguns casos, o ganho de peso não ocorreu até a puberdade ou mais tarde na vida. A exposição do desenvolvimento ao estrogênio sintético DES causou ganho de peso em camundongos, mas não até depois que o animal recebeu um segundo golpe – aumento da exposição ao estrogênio na puberdade. A exposição do desenvolvimento ao DES reprogramou as vias de estrogênio, sensibilizando os animais aos estrogênios. Na puberdade, os adipócitos com receptores de estrogênio aumentaram a absorção de gordura, levando à obesidade no camundongo adulto. Esses animais pesavam até 90 g em comparação com 30 g dos controles [672].
A redução do exercício é frequentemente destacada como mecanismo de ganho de peso, que é imitado em animais. A exposição ao BPA ou à nicotina causou redução da atividade e diminuição do gasto de energia. Camundongos expostos ao BPA no útero dormiam mais, moviam-se menos, andavam mais devagar e gastavam menos energia [677]. Da mesma forma, a exposição ao DDT durante o desenvolvimento diminuiu o gasto de energia ao diminuir a temperatura corporal central e o consumo de oxigênio [460]. A HFD exagerou esses efeitos do DDT.
A obesidade em humanos é sexualmente dimórfica, sendo mais prevalente em mulheres resultante, pelo menos parcialmente, da sensibilidade aos estrogênios [678]. A ação dos obesógenos também pode ser sexualmente dimórfica, como demonstrado pelo TBT e clorpirifós, que causam obesidade apenas em homens e DDT e Cd, que causam obesidade apenas em mulheres.
Os obesógenos podem atingir o microbioma intestinal diretamente [133], [134] e as exposições aos obesogênios demonstraram afetar a composição da microbiota intestinal, levando à obesidade. Estes incluem metais pesados, poluição do ar, nanopartículas e numerosos obesogênios conhecidos: BPS (e até certo ponto outros bisfenóis), estrogênios naturais, ftalatos, congêneres individuais de PCB e suas misturas PAHs, PFAS, retardadores de chama bromados, agrotóxicos, TCCDioxinas e dibenzofuranos [133], [134].
A obesidade está frequentemente associada a níveis mais elevados de resistência à insulina [679]. A exposição ao BPA, DEHP, PM2,5, PFOS, atrazina, Cd, permetrina e a dieta ocidental estão associadas à resistência à insulina.
Muitos indivíduos obesos têm sinalização de leptina prejudicada, levando à resistência [680]. A exposição ao BPA, PM2.5, alguns OPFRs, PFOA, clorpirifós, Cd e BP pode levar à alteração da sinalização da leptina.
Um estudo humano chave vinculou a exposição ao obesogênio e o ganho de peso. Um ensaio clínico randomizado de dois anos que comparou quatro dietas mostrou que os indivíduos perderam aproximadamente o mesmo peso em qualquer uma das dietas nos primeiros seis meses e recuperaram aproximadamente a mesma quantidade de peso nos 18 meses seguintes. Criticamente, os níveis de PFAS foram medidos nos participantes. Indivíduos com os níveis mais altos de PFAS recuperaram mais peso do que aqueles com os níveis mais baixos de PFAS. Este efeito foi associado à diminuição da taxa metabólica de repouso durante a perda de peso e aumento reduzido durante o ganho de peso [544] e forneceu mais suporte humano para a hipótese do obesogênio.
Existem duas áreas principais onde existem dados animais, mas faltam dados humanos. Estudos em animais mostraram que DDT, TBT, BPA e uma mistura de BPA e ftalatos provocam herança epigenética transgeracional. Resultados recentes de um estudo epidemiológico humano de longa duração associaram a exposição de uma avó ao DDT durante a gravidez a um aumento da incidência de obesidade nas netas adultas jovens [484] , indicando que os obesogênios podem causar efeitos multigeracionais em humanos.
Em todos os estudos em que os adipócitos foram examinados detalhadamente, BPA, TBT, ftalatos e TPhP induziram adipócitos disfuncionais, o que poderia aumentar outras doenças metabólicas se isso ocorresse em humanos. Não há dados em humanos examinando a funcionalidade dos adipócitos em indivíduos normais versus obesos.
6 . Estratégias de intervenção e prevenção
A mitigação do impacto dos obesógenos no risco de obesidade e complicações devido à diversidade de produtos químicos ligados ao desenvolvimento da doença exigirá uma variedade de abordagens [681]. Essas abordagens incluem intervenções para reduzir as exposições, antagonizando os efeitos adversos dos obesogênios, facilitando a excreção do obesogênio e eliminando os estressores que amplificam a interrupção metabólica mediada pelo obesogênio. Central para esses esforços é necessário identificar substâncias químicas que promovam a obesidade e então reduzir sua exposição. Devemos desenvolver e implantar novas políticas públicas para lidar com as ameaças metabólicas representadas pelos obesogênicos [682].
É crucial desenvolver sistemas de teste in vitro e in silico que prevejam de forma confiável a ação do obesogênio in vivo. A identificação das principais características dos obesogênicos, juntamente com o desenvolvimento de novos métodos de teste sofisticados, pode ajudar no desenvolvimento de estruturas de teste em camadas que podem validar abordagens integradas de teste e avaliação (IATA). Embora essenciais, essas metodologias de identificação são insuficientes sem in vitro e acompanhamento de coorte humano, seguido de ação regulatória. A obesidade é um fator de risco significativo para várias doenças críticas que impõem morbidade e mortalidade substanciais, incluindo câncer, distúrbios musculoesqueléticos, disfunções metabólicas e doenças cardiovasculares, que justificam coletivamente tal classificação. Portanto, a identificação e classificação dos obesogênicos como substâncias de grande preocupação devem ser consideradas pelos órgãos reguladores. Até o momento, a Agência Europeia de Produtos Químicos (ECHA) considera agentes cancerígenos, mutagênicos e reprotóxicos (nt.: ou seja, que sejam tóxicos para a realidade do processo reprodutivo) como de grande preocupação, juntamente com substâncias muito persistentes. Os EDCs foram incluídos (https://www.echa.europa.eu/candidate-list-table) e, com base nesta revisão, os obesogênios devem ser considerados uma categoria separada.
Reduzir as exposições a obesogênios é fundamental para qualquer esforço de intervenção bem-sucedido. As estratégias de redução da exposição devem ser em larga escala e envolver ações regulatórias para identificar e eliminar substâncias tóxicas que aumentam o risco de doenças metabólicas em nível populacional. A modificação comportamental informada pelo conhecimento dos produtos químicos obesogênicos e as fontes de exposição, bem como os esforços individuais para minimizar o envolvimento, podem reduzir seus níveis de obesogênio. Estudos de intervenção de curto prazo mostraram que a redução de fontes conhecidas de obesogênio comum reduziu com sucesso os níveis de BPA, ftalatos, parabenos e triclosan [683], [684]. A redução individual dos níveis de obesogênio é baseada no conhecimento das fontes dessa exposição e na ausência de exposições inesperadas decorrentes de contaminação[685]. Embora a ação individual seja essencial, pode ser insuficiente para melhorar a saúde da população. Ação regulatória, incluindo a rotulagem do produto, será necessária para reduzir o risco social.
Onde o mecanismo de toxicidade metabólica é conhecido para um obesogênio, as intervenções podem ser direcionadas para abordar essa via específica para mitigar as consequências da exposição. Por exemplo, estudos em animais mostraram que o antioxidante N-acetilcisteína pode atenuar a disfunção metabólica induzida por arsênico e PCB [686], [687]. À medida que aprendemos mais sobre os mecanismos de ação dos obesógenos, a viabilidade de adaptar as intervenções a essas vias melhorará. No entanto, um desafio persistente a ser superado é que a maioria dos indivíduos está exposta a múltiplos tóxicos com capacidade de perturbar o metabolismo que podem operar através de vários mecanismos que podem interagir de maneiras imprevisíveis.
Intervenções para facilitar a eliminação ativa de obesogênios ou inibir seus efeitos podem ser benéficas para reduzir seus impactos na saúde. O papel da nutrição na redução da toxicidade das exposições químicas foi revisto [688], assim como o uso de antioxidantes para combater a inflamação causada por PCBs [689] e antioxidantes na redução da toxicidade do BPA [690]. Outros revisaram o papel dos polifenóis contra os efeitos de vários EDCs [691].
Um estudo controlado randomizado descobriu que a suplementação de vitamina C (1000 mg/dia por dois meses) reduziu os níveis de PCB e DDT/DDE (mas não PBDE) em mulheres da Califórnia [692]. O diurético hidroclorotiazida e o inibidor do cotransportador de sódio-glicose-2 dapagliflozina aumentaram a excreção de metabólitos de ftalatos urinários [693].
Em roedores, várias substâncias foram protetoras contra os vários efeitos metabólicos do BPA e outros EDCs. Por exemplo, extrato de semente de uva, resveratrol ou vitamina E reverteram alguns aumentos induzidos pelo BPA na pressão arterial, colesterol total, colesterol LDL, gordura corporal, leptina, adiponectina, insulina e glicemia em ratos [694]. O óleo de Nigella sativa e a timoquinona ajudaram a reduzir muitas das perturbações metabólicas causadas pelo BPA em ratos [695], assim como o licopeno [696] e o ginseng vermelho coreano em camundongos [697]. A curcumina inibiu a adipogênese induzida por BBP em células 3T3-L1 [698] e o suplemento alimentar Potentilla rugulosa. O extrato de Nakai suprimiu a indução de adipogênese mediada por BPA, BPS e BPF em células 3T3-L1 [699]. O flavonóide icariin aliviou a função de barreira intestinal interrompida induzida pelo BPA em camundongos [700]. Os probióticos quase eliminaram a toxicidade metabólica de uma mistura de ftalatos e BPA em ratos [701].
A crocina, um componente do açafrão, é protetora contra a toxicidade hepática induzida pelo BPA em ratos [702]. A melatonina neutralizou parcialmente as alterações metabólicas no fígado de rato causadas pela frutose e BPA (separadamente e em conjunto) [703]. O extrato fitoterápico Asparagus officinalis protegeu contra danos nos rins e fígado induzidos pelo BPA em ratos [704]. Nas células do fígado, a curcumina reduziu os efeitos da resistência à insulina desencadeada pelo BPA [705]. Algumas substâncias também protegem contra os efeitos do BPA durante o desenvolvimento. O litospermato B de magnésio, um composto ativo de danshen/sálvia vermelha, protegeu a prole de ratos contra os efeitos metabólicos do BPA no útero [706].
Estudos de caso e pequenos ensaios em humanos mostraram utilidade potencial para a gordura não absorvível olestra [707], a colestiramina sequestrante de ácidos biliares [708] e arroz integral fermentado [709]. Olestra foi usado com sucesso para aumentar a eliminação de POP em pessoas expostas a altos níveis de POPs [707], [710]. Estudos em humanos e animais sugerem um benefício potencial da fibra dietética, particularmente fibras fermentáveis [711]. Abordagens focadas em interromper a circulação entero-hepática de obesogênios persistentes podem ser produtivas quando associadas à perda de peso, que libera esses tóxicos da gordura.
Os efeitos metabólicos adversos de alguns obesogênios podem ser amplificados ou desmascarados por dietas deletérias, como dietas ricas em gordura e ocidentais. Dietas mais saudáveis podem mitigar os impactos metabólicos dos obesogênios. No entanto, mais estudos são necessários para demonstrar os efeitos atenuantes de dietas saudáveis na interrupção metabólica induzida por obesogênio, incluindo os potenciais efeitos de melhoria de dietas conhecidas por conferir benefícios metabólicos, como a “Dieta Mediterrânea”. Componentes dietéticos específicos podem proteger contra disfunções induzidas por obesógenos, como sulforafano de vegetais Brassica e resveratrol. Garantir a ingestão adequada e evitar deficiências de micronutrientes que inibem a absorção/ação do obesogênio ou amplificam os efeitos do obesogênio, respectivamente, também são essenciais [681]. De fato, os ésteres de butirato de resveratrol reduziram o ganho de peso, o acúmulo de lipídios, aumentaram os níveis de leptina e os efeitos nocivos sobre o microbioma resultantes da exposição ao BPA no desenvolvimento em ratas [712].
Ensaios de intervenção humana destinados a examinar os efeitos das exposições químicas ambientais no metabolismo são necessários. Por exemplo, em um experimento cruzado, os pesquisadores deram níveis baixos e “presumivelmente seguros” de BPA para homens adultos e mulheres não grávidas, e sua resposta à insulina estimulada pela glicose foi afetada [713]. Em um estudo cruzado, duplo-cego, randomizado, estudantes universitários que receberam BPA tiveram alterações imediatas nos níveis de insulina, glicose e peptídeo-c (um marcador da função das células β) [714]. Em um estudo cruzado randomizado, idosos que consumiram duas bebidas de latas contendo BPA apresentaram pressão arterial sistólica significativamente mais alta duas horas depois do que quando beberam bebidas em copo [715]; essas mudanças estavam ligadas a efeitos epigenéticos[716].
Houve ensaios de intervenção humana sobre a poluição do ar. Vinte e cinco adultos saudáveis que viviam na zona rural de Michigan foram transferidos para um local urbano por 4 a 5 horas durante cinco dias. Exposições mais elevadas a PM2,5 foram associadas a um aumento da resistência à insulina [305]. Em um estudo cruzado cego, a exposição ao ozônio durante o exercício aumentou os níveis de hormônio do estresse e afetou o metabolismo lipídico [717]. Um estudo cruzado randomizado e duplo-cego expôs estudantes universitários saudáveis ao ar “normal” filtrado ou não filtrado em dormitórios em Xangai, China. Dentro de nove dias de exposição, foram observadas diferenças significativas na resistência à insulina, níveis de glicose, lipídios, pressão arterial e ácidos graxos, entre outros marcadores metabólicos [718].
Um estudo cruzado de dieta orgânica de 40 dias randomizado por cluster reduziu os níveis de carga corporal de agrotóxicos das crianças, reduziu o IMC e reduziu o estresse oxidativo e os marcadores de inflamação. Como a ingestão calórica também foi menor durante a dieta orgânica, essa associação pode não ser devido à dieta orgânica, mas à ingestão calórica [719]. Essa importante área de novas pesquisas precisa ser expandida porque pode fornecer as evidências necessárias tanto para a aceitação quanto para neutralizar a ação dos obesogênicos.
As intervenções com medicamentos ou dietas devem ser avaliadas com cautela para equilibrar os benefícios potenciais com os possíveis riscos relacionados aos medicamentos ou às dietas. Se a intervenção dietética já demonstrou ter outros benefícios metabólicos, os efeitos preventivos positivos sobre os obesogênios constituirão um benefício adicional. Se os medicamentos apresentarem toxicidade, as vantagens e os riscos devem ser cuidadosamente ponderados.
7 . Direções futuras
7.1 . Necessidades gerais para o campo obesogênico (CAIXA 1)
Esta seção descreve pontos que devem ser melhorados em estudos in vitro, in vivo e epidemiológicos comumente usados em campos de obesogênios, os novos métodos necessários e quais dados são necessários para avançar no campo de obesogênios e obesidade. Isso implica a necessidade de ter métodos de teste validados para identificar obesogênios ausentes.
Caixa 1
Recomendações Gerais para o Campo Obesogênico.
• Desenvolver um kit de biomonitoramento pessoal de baixo custo prontamente disponível para avaliar exposições a EDCs.
• Atualizar os protocolos de teste baseados em diretrizes.
• Melhorar as mensagens para o público e os médicos.
• Melhorar a coordenação entre pesquisadores usando sistemas de modelo ( in vitro , animal e computacional) e pesquisadores humanos.
• Melhorar a comunicação e a coordenação entre pesquisadores de obesogênicos e cientistas e clínicos básicos.
• Trabalhar com organizações nacionais e internacionais para avaliar evidências de produtos químicos específicos como obesogênicos e desenvolver listas de produtos químicos obesogênicos.
• Mudar a narrativa para um foco na prevenção e não no tratamento.
Um kit de biomonitoramento pessoal de baixo custo e fácil de usar (por exemplo, US$ 100) que pode medir muitos EDCs e obesogênios com resultados interpretáveis seria valioso para consumidores e médicos. Capacitar as pessoas com o conhecimento de quais substâncias químicas elas têm em seus corpos que podem estar causando ou contribuindo para doenças pode influenciar seu comportamento, estimulando a ação de médicos e formuladores de políticas para reduzir as exposições. Poderia também promover medidas para reduzir as exposições a nível pessoal e familiar. É fundamental agilizar os estudos sobre a interpretação desses níveis de biomonitoramento, definindo valores de orientação robustos com base em trabalho humano e experimental sólido.
O campo obesogênico sofre com a falta de comunicação com a comunidade sobre a importância de reduzir as exposições aos obesogênicos. Também precisa haver uma melhor coordenação e colaboração entre pesquisadores de animais e humanos, particularmente entre pesquisadores de obesogênios e pesquisadores básicos e clínicos que trabalham com obesidade e distúrbios metabólicos. A cooperação aprimorada poderia quebrar os armazenamentos científicos e levar a projetos de pesquisa conjuntos que poderiam responder a perguntas sobre o papel dos obesogênicos na pandemia de obesidade.
Finalmente, embora deva ser evidente, a prevenção é a melhor maneira de reduzir ou eliminar a pandemia de obesidade. A prevenção salva vidas e dinheiro enquanto custa muito menos do que qualquer terapia medicamentosa ou intervenção cirúrgica.
7.2 . Modelos animais in vitro: lacunas/necessidades de dados (CAIXA 2)
Muitos experimentos em ratos e camundongos se concentraram na exposição a um produto químico ambiental no útero e no exame da obesidade em seus descendentes ao longo da vida. Isso faz sentido porque a gestação e a primeira infância em humanos é a janela de exposição mais sensível. No entanto, pré-concepção, puberdade, menopausa e velhice também são momentos em que os níveis hormonais estão mudando e onde pode haver maior sensibilidade às exposições ambientais. Os adultos também respondem aos obesogênios, embora geralmente em níveis mais altos. Como o objetivo é imitar a situação humana em modelos animais, os estudos devem se concentrar na exposição durante várias janelas, inclusive antes da concepção, no útero e na idade adulta e até mesmo da fase no útero até ao longo da vida.
Caixa 2
In Vitro , Recomendações de Modelos Animais.
• Usar células humanas in vitro para definir compromisso e diferenciação em adipócitos.
• Determinar quais obesogênios estimulam o desenvolvimento de adipócitos disfuncionais.
• Usar sistemas humanos in vitro para avaliar a sensibilidade e resistência à insulina.
• Trabalhar em direção a culturas 3D e tecnologias organ-on-chip.
• Usar modelos humanos para investigar mecanismos de ação de obesogênios.
• Medir diferentes depósitos de gordura, fígado, pâncreas, cérebro e GI, bem como hormônios, moléculas bioativas, níveis de lipídios, células imunes e inflamação.
• Avaliar as mudanças epigenéticas como biomarcadores de exposição, efeito e modelagem de previsão.
• Avaliar a interação dos obesogênios com a dieta.
• Avaliar os efeitos dos obesogênios na perda de peso e no jejum.
• Avaliar os efeitos de misturas químicas relevantes para humanos.
• Avaliar os efeitos das exposições em várias janelas de sensibilidade, incluindo herança transgeracional.
• Avaliar as exposições ao longo da vida útil, bem como durante as janelas sensíveis.
Os modelos animais devem incluir animais suficientes de ambos os sexos de múltiplas linhagens para detectar fenótipos e examinar as diferenças sexuais. Pelo menos 4 a 5 doses de produto químico devem ser usadas para permitir a detecção de respostas de dose não monotônicas (nt.: as doses que não correspondem à toxicologia clássica de aumenta a dose, aumento a toxicidade). Os níveis de produtos químicos e metabólitos devem ser medidos no sangue e na urina. Os testes devem incluir concentrações na faixa de exposições humanas ou uma ampla faixa de doses se as exposições humanas não estiverem bem estabelecidas. A modelagem toxicocinética deve ser empregada para avaliar as doses alcançadas nos tecidos-alvo. Muitos endpoints sobrepostos ao longo da vida útil devem ser avaliados. Além do peso corporal, os endpoints críticos incluem composição corporal (gordura vs. magra), pesos de depósitos de gordura individuais para avaliar potenciais efeitos diferenciais em tecidos adiposos do tipo subcutâneo ou visceral e ensaios de expressão gênica de almofadas de gordura. Atividade, comportamento alimentar, possível compulsão alimentar e dependência, o microbioma intestinal, a gordura do fígado e os efeitos em todos os sistemas e tecidos críticos que controlam o metabolismo devem ser examinados [15]. Examinar a interação entre exposições químicas e dieta, incluindo dietas ricas em gordura e açúcar, ajudará a extrapolar os dados para humanos. Será construtivo avaliar os efeitos da exposição ao obesogênio na perda de peso ao longo do tempo e na perda de peso durante o jejum. Uma vez que os seres humanos estão expostos a misturas de produtos químicos, será importante desenvolver métodos sensíveis para avaliar os efeitos das misturas, particularmente misturas de produtos químicos com base nos níveis humanos relatados.
Poucos trabalhos estudaram explicitamente os comportamentos alimentares (tamanho, duração, frequência), padrões de refeição (ciclos ingestivos horários/diurnos) ou circuitos hipotalâmico-encefálicos após a exposição perinatal ao obesogênio. A maioria dos estudos se concentrou na ingestão alimentar total cumulativa em um período curto (alguns dias) ou longo prazo (~6 meses) com um exame subsequente da expressão hipotalâmica de neuropeptídeos envolvidos na ingestão alimentar. São necessários dados adicionais sobre como os obesogênios afetam a resposta alimentar a peptídeos periféricos (leptina, grelina, colecistocinina, etc.) ou a realimentação induzida pelo jejum.
À medida que os testes aumentam, mais obesogênios putativos serão encontrados. Portanto, mais testes devem ser uma prioridade. Uma combinação de ensaios in vitro e triagem in silico que são selecionados para validar os resultados será necessária para priorizar produtos químicos para testes in vivo . Seria vantajoso desenvolver características-chave (KCs) de obesogênios, semelhantes aos KCs estabelecidos para EDCs [6] e tóxicos reprodutivos [720], [721]. Protocolos baseados em diretrizes atualizados com endpoints mais relevantes e sensíveis para definir quais produtos químicos são obesogênicos também são necessários. Isso exigiria mudanças nas diretrizes da FDA/Food and Drugs Administration e da EPA/Environmental Protection Agency para testes de produtos químicos na indústria, mas esses testes regulatórios aprimorados poderiam manter os obesogênios prejudiciais fora do mercado. Como alguns obesogênicos e EDCs podem agir transgeracionalmente, os protocolos de teste devem levar em conta e serem sensíveis a esses efeitos. Os produtos químicos devem ser administrados a mães grávidas em cada geração e ao longo da vida e gerações para imitar a situação humana para avaliar os efeitos transgeracionais potencialmente cumulativos.
7.3 . Epidemiologia humana: lacunas/necessidades de dados (CAIXA 3)
Um aspecto fundamental dos estudos epidemiológicos é a avaliação precisa da exposição. Muitos obesogênicos potenciais têm meias-vidas curtas. Os estudos epidemiológicos representam um problema porque a urina de ponto único é inadequada para uma avaliação precisa da exposição [722]. Uma vez que a avaliação inadequada da exposição é provavelmente a principal razão para a inconsistência entre os estudos de epidemiologia, melhorá-la será fundamental para avançar no campo. O desenvolvimento de protocolos com bioespécimes repetidos é um caminho a seguir [259].
Caixa 3
Recomendações para a Área de Epidemiologia.
• Melhorar a capacidade de medir exposições a produtos químicos.
• Padronizar a coleta de biomarcadores e técnicas de avaliação de exposição.
• Continuar a avaliar a saúde da prole de estudos de coorte de nascimento ao longo da vida.
• Avaliar a interação da nutrição com as exposições obesogênicas.
• Avaliar vários endpoints sobrepostos que correspondem aos medidos em modelos animais.
• Usar coortes de nascimento para estudar os efeitos da exposição ao desenvolvimento no ganho de peso induzido pela nutrição e jejum e perda de peso em crianças e adultos.
• Usar estudos prospectivos em adultos para definir os efeitos da exposição precoce no ganho de peso induzido pela nutrição e jejum e perda de peso em adultos.
• Coordenar com médicos e cientistas básicos para desenvolver protocolos para avaliar a hipótese obesogênica.
Outra melhoria nos estudos epidemiológicos sobre obesogênios seria estudar os efeitos de misturas de contaminantes em estudos de coorte de díade mãe-filho e estudos realizados em populações adultas [723]. Poucos estudos epidemiológicos investigaram os efeitos obesogênicos de misturas de diferentes famílias químicas. Embora um tamanho de amostra de centenas possa ser suficiente para compostos únicos, são necessários tamanhos de amostra maiores para avaliar os efeitos da mistura com poder suficiente.
Estudos de múltiplas exposições obesogênicas enfrentam desafios estatísticos e metodológicos que precisam ser considerados em estudos futuros, conforme revisado em [724], [725], [726], [727]. As limitações potenciais estão relacionadas à classificação errônea de exposições com alta variabilidade intrapessoal (por exemplo, para os produtos químicos de meia-vida curta, como o BPA), causalidade reversa devido a fatores farmacocinéticos (por exemplo, diferentes vias de exposição que afetam a taxa de excreção) ou incapacidade do biomarcador para representar a exposição durante o período relevante. Além desses desafios, deve-se considerar o isolamento dos efeitos potenciais de uma exposição ao obesogênio de outra quando as exposições são correlacionadas devido a fontes comuns e existem desafios estatísticos (como dados ausentes e exposição abaixo do nível de detecção). Estudos futuros devem examinar as interações entre os obesogênicos com base em vias biológicas comuns relacionadas à obesidade, em vez de puramente em considerações estatísticas [725].
Outro desafio é minimizar a quantidade de sangue necessária para as análises químicas. Seria útil medir múltiplos obesogênios em 225 µl de plasma, que está comumente disponível no biobanco de sangue moderno. Uma vez que muito poucos estudos epidemiológicos com milhares de indivíduos são iniciados com o objetivo principal de estudar os obesogênios, é essencial usar os biobancos existentes em estudos de coorte já estabelecidos. A padronização aprimorada da coleta de amostras, armazenamento e protocolos de laboratório será útil. Ter acesso a biobancos e um único laboratório ou uma rede de laboratórios consistentes em protocolo e equipamentos para análises de amostras permitirá maior comparabilidade entre estudos em nível global. Tal abordagem foi desenvolvida no projeto HBM4EU [728].
A distribuição ectópica de gordura no abdome ou no fígado é mais prejudicial que o tecido adiposo subcutâneo; portanto, é importante usar métodos objetivos e minimamente invasivos para medir os diferentes depósitos de gordura em humanos. Não devemos confiar apenas no IMC para medir os resultados da obesidade quando uma avaliação mais sofisticada da distribuição de gordura e antropometria pode ser obtida pela medição do diâmetro da cintura, tomografia computadorizada ou ressonância magnética (RM). Uma vez que tais imagens são caras, é crucial associar-se a estudos em que tais medições já tenham sido realizadas ou estejam planejadas [467]. Também é essencial avaliar a interação das exposições químicas com as dietas e os efeitos do sexo e da genética.
Melhores interações, coordenação e colaborações entre epidemiologistas e pesquisadores de animais melhorarão o progresso futuro. Estudos experimentais controlados com animais podem mostrar relações causais e indicar locais, mecanismos e desfechos a serem medidos em estudos epidemiológicos. Alguns dos mesmos parâmetros devem ser medidos em estudos em humanos e animais. O desenvolvimento de uma bateria de desfechos sobrepostos (fisiologia, endocrinologia, epigenética, metabolômica) que podem ser avaliados em estudos com animais e humanos é garantido. Muitos estudos em humanos se concentram no jejum e na eficácia de várias dietas. Esses estudos devem incluir a avaliação das exposições ao obesogênio tanto in utero quanto na idade adulta para associar as exposições ao obesogênio com a suscetibilidade de ganhar e perder peso e seus efeitos na perda de peso em jejum.
Se os estudos de coorte de nascimento pudessem relacionar exposições in utero à sensibilidade da prole ao ganho de peso e problemas com perda de peso, esses dados poderiam convencer os médicos e reguladores a avaliar as exposições e reduzir as exposições para melhorar a saúde metabólica.
Os estudos longitudinais de coorte de nascimentos precisam se concentrar no nascimento e na primeira infância, mas é imperativo acompanhar os sujeitos até a idade adulta; estudos ao longo da vida são necessários.
Outra questão em estudos epidemiológicos é o viés de publicação; estudos com resultados estatisticamente significativos são mais propensos a serem publicados do que os não significativos [729]. Esse problema pode ser resolvido pelo pré-registro de protocolos para estudos observacionais (como é comumente feito para ensaios clínicos), facilitando a incorporação de todos os resultados em metanálises [730].
Embora todas as sugestões acima ajudem a avançar no campo dos obesogênios, talvez a maior necessidade seja mais estudos de coorte de nascimentos para avaliar os efeitos das exposições de desenvolvimento no ganho e perda de peso. Muitos estudos de coorte mostraram que a exposição durante o desenvolvimento a uma substância química específica estava associada ao ganho de peso na infância até a adolescência. Os participantes poderiam ser reavaliados em suas idades atuais, separados em exposições baixas e altas no útero e, em seguida, colocados em dietas controladas por um tempo limitado. A questão é se os participantes com o nível mais alto de produtos químicos no útero ganhar ou perder peso (particularmente gordura) de forma diferente daqueles com as exposições mais baixas? Os participantes poderiam então ser colocados em um regime de baixa caloria por duas semanas, e a perda de peso/composição corporal medida para avaliar se a exposição ao obesogênio no desenvolvimento afeta o peso/perda de gordura. É antiético tratar deliberadamente humanos com produtos químicos tóxicos; portanto, esta abordagem poderia ser o próximo melhor desenho experimental. Estratégias semelhantes podem ser desenvolvidas para exposições atuais, isoladas e combinadas.
8 . Implicações clínicas e um caminho a seguir
Apesar do crescente conhecimento sobre os obesogênios, a tradução desses dados para a prática clínica é essencialmente inexistente. Abordar essa lacuna de conhecimento entre médicos e formuladores de políticas pode trazer novas ferramentas e abordagens para conter a onda de obesidade. Isso é crítico porque o atual manejo clínico de pacientes obesos é lamentavelmente inadequado. O manejo farmacológico da obesidade melhorou com novos medicamentos e formulações de medicamentos. No entanto, os tratamentos atuais são muitas vezes insuficientes. Até 55-65% dos pacientes não conseguiram atingir até 5% de perda de peso em ensaios clínicos [723], [724]. Embora os medicamentos para perda de peso sejam subutilizados nos cuidados clínicos [731], a eficácia modesta das terapias atualmente disponíveis sugere que os tratamentos farmacológicos serão insuficientes para aliviar a obesidade. Embora a cirurgia metabólica possa ser altamente eficaz, os riscos cirúrgicos e pós-cirúrgicos desses procedimentos, juntamente com seu alto custo e a escala da pandemia de obesidade, deixam claro que a cirurgia não pode resolver essa ameaça significativa à saúde. O surgimento da obesidade pediátrica com seus efeitos adversos à saúde ao longo da vida complica ainda mais o manejo clínico porque essa população tem poucas opções de tratamento. As intervenções para perda de peso tornam-se menos eficazes ao longo do tempo, levando à recuperação do peso. Isso ressalta os desafios de tratar a obesidade usando nossas abordagens atuais [721] e indica que são necessárias novas abordagens, inclusive abordando todos os fatores de risco de obesidade, incluindo produtos químicos obesogênicos no meio ambiente.
O foco na prevenção é um componente oportuno e essencial de qualquer abordagem de saúde pública para interromper a pandemia de obesidade. Ao longo da última década, a evolução do pensamento médico reconheceu a importância dos determinantes sociais (ou estruturais) da saúde – condições nas quais as pessoas vivem suas vidas que afetam os riscos e resultados da saúde. Estes incluem vizinhança e ambientes construídos, mas as diretrizes clínicas que consideram “ambientes” muitas vezes negligenciam as exposições químicas [732]. Isso está começando a mudar, e as evidências apresentadas nesta e em nossas revisões complementares, Obesidade I e III, indicam que tais exposições devem ser explicitamente consideradas. Intervenções apropriadas nos níveis individual e político devem ser desenvolvidas para reduzir a exposição a produtos químicos obesogênicos.
Reconhecer e abordar os fatores ambientais de risco de doença pode ser especialmente importante no combate à obesidade. A crença cultural predominante de que a obesidade é uma falha pessoal vai diretamente contra os princípios dos determinantes sociais da saúde [733]. A internalização dessas crenças na sociedade e nos sistemas de saúde resulta em resultados clínicos mais pobres [733]. Uma vez que a prática médica aprecie melhor os fatores ambientais do risco de obesidade, os médicos terão o poder de mudar a narrativa de responsabilidade pessoal autodestrutiva e se concentrar em interromper os mecanismos de promoção da obesidade discutidos aqui. Isso pode melhorar a saúde da sociedade enquanto trabalha no melhor interesse de cada paciente.
Caberá aos médicos aconselhar os pacientes a reduzirem as ameaças obesogênicas às suas vidas e confrontarem de que os cuidados médicos podem levar à exposição ao obesogênio [261]. Os pacientes não reconhecem o potencial de medicamentos e dispositivos médicos como fonte de exposição ao obesogênio e EDC. Publicações que documentam as exposições de bebês em unidades de terapia intensiva neonatal ao BPA e ftalatos de equipamentos médicos não levaram a mudanças no projeto ou no uso de equipamentos médicos que liberam esses produtos químicos [734]. Os médicos devem defender mais conhecimento e transparência sobre essas ameaças ocultas. As obrigações éticas como prestadores de serviços de saúde exigem que os médicos atuem no melhor interesse do paciente, maximizando os benefícios, minimizando os riscos e capacitando os pacientes a tomar decisões informadas sobre sua saúde. A natureza enigmática das exposições ao EDC associadas à assistência médica viola essas promessas e deve ser abordada.
Atender às necessidades dos pacientes que sofrem de obesidade requer uma abordagem multifacetada para tratar aqueles que são obesos, evitando que outros se tornem obesos. Isso, sem dúvida, inclui atenção à dieta, atividade física e riscos genéticos subjacentes. No entanto, uma abordagem bem-sucedida também deve abordar outros fatores que amplificam o risco de obesidade, incluindo exposições ambientais obesogênicas. Várias intervenções podem reduzir e mitigar as exposições para pacientes individuais [681]. Mas os médicos também devem deixar suas salas de exames e defender políticas públicas que eliminem a exposição a produtos químicos obesogênicos em toda a sociedade. Nossas falhas em lidar com a pandemia de obesidade são evidentes. Novas abordagens que incorporam a saúde ambiental na prática clínica e nas políticas públicas podem melhorar esse desempenho sombrio, traduzindo a ciência emergente em melhor saúde e bem-estar para todos.
9 . Conclusões
Fatores genéticos e ambientais desempenham papéis na pandemia de obesidade. A obesidade é multifatorial; nenhum fator genético ou ambiental conhecido por si só pode causar a pandemia global de obesidade. Uma questão-chave persistente é qual porcentagem de obesidade é devido à genética, estresse, supernutrição, falta de exercício, vírus, drogas ou obesogênicos? É praticamente impossível responder a essa pergunta para quaisquer fatores contribuintes, porque eles provavelmente trabalham juntos com efeitos diferentes, dependendo do equilíbrio dos fatores. Os antecedentes genéticos e a supernutrição desempenham um papel significativo; podemos ver o impacto de dietas ricas em açúcar e gorduras e altamente processadas na obesidade. No entanto, é difícil determinar os efeitos exatos dos obesogênicos na obesidade porque cada substância química é diferente, as pessoas são diferentes e as exposições variam regional e globalmente. Importante,
Que dados apoiam o papel dos obesogênicos na pandemia de obesidade? Os dados são suficientes para garantir um foco na redução das exposições para reduzir o escopo da obesidade? Dados in vitro podem indicar que um produto químico é um potencial obesogênico. Dados de animais podem revelar relações causais entre exposição e ganho de peso posterior, aumento da adiposidade e obesidade. Dados in vitro e em animais também indicam quais tecidos, hormônios e vias são alterados por obesogênios. Estudos de coorte de nascimento fornecem dados humanos robustos que ligam exposições durante o desenvolvimento ao ganho de peso e obesidade mais tarde na vida. Não podemos realizar “ensaios clínicos” reais onde a exposição a obesogênios e seus efeitos são monitorados ao longo do tempo. Assim, nos concentramos em avaliar a força dos dados para cada obesogênio. Quando há vários estudos in vitro, em animais e em humanos, que existem para múltiplos obesogênios, deve-se concluir que um produto químico é um obesogênio que provavelmente afeta o ganho de peso humano. Devemos informar o público, médicos e formuladores de políticas para reduzir suas exposições a esses produtos químicos para melhorar a saúde individual e reduzir a carga social de doenças.
Assim como a classificação de carcinógenos, será útil identificar diferentes classes de obesogênicos para fins de pesquisa e regulamentação. Esta revisão apresenta duas categorias: obesogênicos e obesogênicos potenciais. Propomos agora dividir os obesogênicos em Classe 1 e Classe 2 para ajudar pesquisadores e agências reguladoras a determinarem o status dos dados e as necessidades de pesquisa. Descrevemos essas classes e sugerimos ações preventivas na Tabela 2.
Tabela 2. Categorização de obesogênicos de acordo com os dados. Os obesogênicos são divididos em duas classes, classe I e II, dependendo da extensão dos dados. Essas categorias indicam o status dos regulamentos e a necessidade de mais testes. Produtos químicos com apenas dados in vitro são designados como potenciais obesogênicos.
| Obesogênico | Obesogênico | Obesogênicos Potenciais | |
|---|---|---|---|
| Classe 1 | Classe 2 | ||
| Evidência epidemiológica | Médio a forte | Fraco ou ausente | ausente |
| Evidência animal | Forte | Médio a forte | Geralmente ausente |
| Evidência in vitro | Forte | Forte | Médio a forte |
| Previsões in silico | Não requerido | Útil | Pode estar presente |
| Ação regulatória | De ser banido | A ser regulamentado | Lista de suspeitos |
| Pesquisar | Como um modelo | Prioridade: estudos humanos | Prioridade: estudos experimentais e humanos |
| exemplos | Fumar, (nicotina) | TBT | BPS BPF, BPAF |
| BPA | Adoçantes não nutritivos | Glifosato | |
| Poluição do Ar (PAH, PM2.5) | BBP | DiBP | |
| Frutose | Endrin | ||
| Ftalatos (DEHP) | Clorpirifós | Pó doméstico | |
| PBDE | Atrazina | Diazinon | |
| OPFRs (TPhP) | Neonicotinóides | Alquilfenóis | |
| DDT | Permetrina | DISTINTIVO | |
| PFOA, PFOS | Metil e butil parabeno | BPA Glucuronido | |
| PCB | Interpolação 80® | Trifloxistrobina | |
| MSG (glutamato | Carboximetilcelulose | Praclostrobina | |
| monossódico) | 3-BHA | Azoxistrobina | |
| TBBPA, TCBPA | Triclosan | ||
| Tolifluanida | |||
| DOSS | |||
| Cádmio | |||
| Arsênico | |||
| DBT | |||
| βHCH | |||
| Triflumizol | |||
| TCDD, TCDF | |||
| Óleo, mistura de “fracking” de gás | |||
| PFAS | |||
| HCB | |||
| βBCH | |||
| TBBPA, TCBPA |
Propomos que os obesogênios de Classe 1 com dados in vitro, modelo animal e humanos significativos sejam banidos ou a exposição significativamente reduzida. Os obesógenos de classe 2 requerem mais dados, e esperamos que a discussão apresentada acima estimule pesquisas para obter as informações necessárias. Potenciais obesogênios precisam de mais testes o mais rápido possível para determinar se são obesogênicos e requerem ação regulatória.
Em resumo, o foco no campo da obesidade tem sido reduzir a obesidade por meio de medicamentos, cirurgia ou dietas. Essas intervenções não foram eficazes, pois a maioria das pessoas não consegue perder peso, e mesmo aqueles que perdem com sucesso quantidades substanciais de peso o recuperam. Uma abordagem melhor seria evitar que a obesidade ocorra em primeiro lugar.
O QUADRO 4 resume nosso pensamento atual: Uma hipótese alternativa para a obesidade. Uma vantagem significativa da hipótese obesogênica é que a obesidade resulta de um distúrbio endócrino e, portanto, é passível de foco na prevenção. Na medida em que os obesogênios resultam em ganho de peso, a redução das exposições deve evitar esse ganho de peso. Sabemos que as janelas de desenvolvimento (in utero e primeira infância) são os períodos mais sensíveis para a ação obesogênica. Esta revisão fornece uma lista de produtos químicos que podem aumentar nossa suscetibilidade ao sobrepeso e à obesidade. Sabemos como reduzir a exposição a esses produtos químicos. O biomonitoramento aprimorado pode fornecer “alertas precoces” de que a exposição ocorreu antes mesmo de a doença ser observada, o que pode ser usado para desenvolver políticas de prevenção. Portanto, sabemos o que fazer e quando fazê-lo. O que resta é mudar a narrativa e o foco de apenas intervenção para prevenção.
Caixa 4
Uma hipótese alternativa para a obesidade.
• A sabedoria convencional é que a obesidade é um distúrbio do balanço energético, causado meramente pelo consumo de mais calorias do que as gastas. Por essa lógica, o combate à epidemia de obesidade exige que indivíduos obesos e com sobrepeso aprendam a comer menos e a se exercitar mais, e que nosso ambiente mude para facilitar esses comportamentos específicos.
• Esse foco na dieta e no aumento do exercício não afetou a epidemia global de obesidade porque não aborda a causa subjacente do aumento da alimentação e da falta de exercício.
• Propomos uma hipótese alternativa que se concentra no(s) mecanismo(s) responsável(is) pela alteração do comportamento alimentar. Essa hipótese alternativa afirma que a obesidade é um distúrbio de crescimento, na verdade, causado por defeitos hormonais/enzimáticos desencadeados por exposições a produtos químicos ambientais e alimentos específicos em nossa dieta.
• Os produtos químicos ambientais (obesógenos) e alimentos específicos em nossa dieta alteram o ponto de ajuste para ganhar peso, por exemplo, quanta comida é necessária para aumentar o peso e quanta dieta é necessária para perder peso em virtude de seus efeitos no controle hormonal do metabolismo.
• Por essa lógica, o combate à epidemia de obesidade exige que os indivíduos reduzam as exposições a produtos químicos ambientais e alimentos específicos durante os momentos sensíveis em que o sistema regulador adiposo-GI-músculo-pancreático é estabelecido e regulado.
• Não é o número, mas o tipo de calorias
• Não é intervenção e sim prevenção!
Financiamento.
Alison Holloway, Institutos Canadenses de Pesquisa em Saúde, PTF155981.
Christopher D. Kassotis, NIH, R00 ES030405.
Trey Howell, NIH, R15ES026790, R21ES030786.
Helene Le Mentic, Programa de Pesquisa e Inovação Horizonte 2020 da União Europeia, Oberon #825712.
Troy Roepke, NIH, R01MH123544,P30ES005022, USDA/NIFA NJ6195.
Robert Sargis, NIH, R01ES028879, R21ES030884,P30ES027792.
Craig R. Tomlinson, P30NCI23108, NCCC Pruty Pilot Award.
Jan Vondracek, Czech Science Foundation #21–00533s, Instituto de Biofísica da Academia Tcheca de Ciências, RVO-68081707, Programa de Pesquisa e Inovação Horizonte 2020 da União Europeia, Oberon #825712.
Juan P. Arrebola, Ramony Cajal Program RYC-2016–20155.
Patrick Babin, Programa de Pesquisa e Inovação Horizonte 2020 da União Europeia, Oberon #825712.
Mathew Cave, NIH, R35ES028373, R01ES032189, T32ES011564, P42ES023716, P30ES030283, R21ES031510.
Saurabh Chatterjee, NIH, P20GM103641, P01ES028942, P01AT003961, DoD-IIRFA W81XWH1810374.
David Collier, NIH, P30ES025128.
Lisa Connolly, Programa de Pesquisa e Inovação Horizonte 2020 da União Europeia, PROTECTD #722634.
Xavier Coumoul, Programa de Pesquisa e Inovação Horizonte 2020 da União Europeia, Oberon #825712.
[NOTA DO WEBSITE: COMO EXPLICITAMOS NO TEXTO OBESIDADE I, AO SE TRANSCREVER AS REFERÊNCIAS, ALTERA-SE COMPLETAMENTE A CONFIGURAÇÃO DAS CITAÇÕES. E COMO AQUI AINDA É MAIOR POR SEREM 740 TRABALHOS CIENTÍFICOS, TORNA-SE UM TRABALHO HERCÚLEO E ATÉ DESNECESSÁRIO PORQUE SE PODE ACESSAR O LINK ORIGINAL CITADO NO INÍCIO OU LER ASSIM MESMO].
Referências
M. Ng, T. Fleming, M. Robinson, B. Thomson, N. Graetz, C. Margono, E.C. Mullany, S. Biryukov, C. Abbafati, S.F. Abera, J.P. Abraham, N.M. Abu- Rmeileh, T. Achoki, F.S. AlBuhairan, Z.A. Alemu, R. Alfonso, M.K. Ali, R. Ali, N.A. Guzman, W. Ammar, P. Anwari, A. Banerjee, S. Barquera, S. Basu, D.A. Bennett, Z. Bhutta, J. Blore, N. Cabral, I.C. Nonato, J.C. Chang, R. Chowdhury, K.J. Courville, M.H. Criqui, D.K. Cundiff, K.C. Dabhadkar, L. Dandona, A. Davis, A. Dayama, S.D. Dharmaratne, E.L. Ding, A.M. Durrani, A. Esteghamati, F. Farzadfar, D.F. Fay, V.L. Feigin, A. Flaxman, M.H. Forouzanfar, A. Goto, M.A. Green, R. Gupta, N. Hafezi-Nejad, G.J. Hankey, H.C. Harewood, R. Havmoeller, S. Hay, L. Hernandez, A. Husseini, B.T. Idrisov, N. Ikeda, F. Islami, E. Jahangir, S.K. Jassal, S.H. Jee, M. Jeffreys, J.B. Jonas, E.K. Kabagambe, S.E. Khalifa, A.P. Kengne, Y.S. Khader, Y.H. Khang, D. Kim, R.W. Kimokoti, J.M. Kinge, Y. Kokubo, S. Kosen, G. Kwan, T. Lai, M. Leinsalu, Y. Li, X. Liang, S. Liu, G. Logroscino, P.A. Lotufo, Y. Lu, J. Ma, N.K. Mainoo, G.A. Mensah, T.R. Merriman, A.H. Mokdad, J. Moschandreas, M. Naghavi, A. Naheed, D. Nand, K.M. Narayan, E.L. Nelson, M.L. Neuhouser, M.I. Nisar, T. Ohkubo, S.O. Oti, A. Pedroza, D. Prabhakaran, N. Roy, U. Sampson, H. Seo, S.G. Sepanlou, K. Shibuya, R. Shiri, I. Shiue, G.M. Singh, J.A. Singh, V. Skirbekk, N.J. Stapelberg, L. Sturua, B.L. Sykes, M. Tobias, B.X. Tran, L. Trasande, H. Toyoshima, S. van de Vijver, T.J. Vasankari, J.L. Veerman, G. Velasquez-Melendez, V.V. Vlassov, S.E. Vollset, T. Vos, C. Wang, X. Wang, E. Weiderpass, A. Werdecker, J.L. Wright, Y.C. Yang, H. Yatsuya, J. Yoon, S.J. Yoon, Y. Zhao, M. Zhou, S. Zhu, A.D. Lopez, C.J. Murray, E. Gakidou
Global, regional, and national prevalence of overweight and obesity in children and adults during 1980–2013: a systematic analysis for the Global Burden of Disease Study 2013
Lancet, 384 (9945) (2014), pp. 766-781
ArticleDownload PDFGoogle Scholar[2]
M.W. Schwartz, R.J. Seeley, L.M. Zeltser, A. Drewnowski, E. Ravussin, L.M. Redman, R.L. Leibel
Obesity Pathogenesis: An Endocrine Society Scientific Statement
Endocr. Rev., 38 (4) (2017), pp. 267-296 View PDF
CrossRefView Record in ScopusGoogle Scholar[3]
M. Blüher
Obesity: global epidemiology and pathogenesis
Nat. Rev. Endocrinol., 15 (5) (2019), pp. 288-298 View PDF
CrossRefView Record in ScopusGoogle Scholar[4]
E.P. Williams, M. Mesidor, K. Winters, P.M. Dubbert, S.B. Wyatt
Overweight and Obesity: Prevalence
Consequences, and Causes of a Growing Public Health Problem, Current obesity reports, 4 (3) (2015), pp. 363-370 View PDF
CrossRefView Record in ScopusGoogle Scholar[5]
R.T. Zoeller, T.R. Brown, L.L. Doan, A.C. Gore, N.E. Skakkebaek, A.M. Soto
Endocrine-disrupting chemicals and public health protection: a statement of principles from the Endocrine Society
Endocrinology, 153 (2012)
M.A. La Merrill, L.N. Vandenberg, M.T. Smith, W. Goodson, P. Browne, H.B. Patisaul, K.Z. Guyton, A. Kortenkamp, V.J. Cogliano, T.J. Woodruff, L. Rieswijk, H. Sone, K.S. Korach, A.C. Gore, L. Zeise, R.T. Zoeller
Consensus on the key characteristics of endocrine-disrupting chemicals as a basis for hazard identification
Nat. Rev. Endocrinol., 16 (1) (2020), pp. 45-57 View PDF
CrossRefView Record in ScopusGoogle Scholar[7]
A.C. Gore, V.A. Chappell, S.E. Fenton, J.A. Flaws, A. Nadal, G.S. Prins, J. Toppari, R.T. Zoeller
Executive Summary to EDC-2: The Endocrine Society’s Second Scientific Statement on Endocrine-Disrupting Chemicals
Endocr. Rev., 36 (6) (2015), pp. E1-E150 View PDF
H.C.J. Godfray, A.E.A. Stephens, P.D. Jepson, S. Jobling, A.C. Johnson, P. Matthiessen, J.P. Sumpter, C.R. Tyler, A.R. McLean
A restatement of the natural science evidence base on the effects of endocrine disrupting chemicals on wildlife
Proceedings. Biological sciences, 286 (1897) (2019), p. 20182416 View PDF
CrossRefView Record in ScopusGoogle Scholar[9]
L.N. Vandenberg, T. Colborn, T.B. Hayes, J.J. Heindel, D.R. Jacobs, D.H. Lee
Hormones and endocrine-disrupting chemicals: low-dose effects and nonmonotonic dose responses
Endocr. Rev., 33 (2012)
S. Villar-Pazos, J. Martinez-Pinna, M. Castellano-Munoz, P. Alonso-Magdalena, L. Marroqui, I. Quesada, J.A. Gustafsson, A. Nadal
Molecular mechanisms involved in the non-monotonic effect of bisphenol-a on ca2+ entry in mouse pancreatic beta-cells
Sci. Rep., 7 (1) (2017), p. 11770
View Record in ScopusGoogle Scholar[11]
F.S. vom Saal, L.N. Vandenberg
Update on the Health Effects of Bisphenol A: Overwhelming Evidence of Harm
Endocrinology, 162 (3) (2021), pp. 1-25
J.J. Heindel, B. Blumberg
Environmental Obesogens: Mechanisms and Controversies
Annu. Rev. Pharmacol. Toxicol., 59 (2019), pp. 89-106 View PDF
J.J. Heindel, B. Blumberg, M. Cave, R. Machtinger, A. Mantovani, M.A. Mendez, A. Nadal, P. Palanza, G. Panzica, R. Sargis, L.N. Vandenberg, F.S. vom Saal
Metabolism disrupting chemicals and metabolic disorders
Reprod. Toxicol., 68 (2017), pp. 3-33
ArticleDownload PDFView Record in ScopusGoogle Scholar[14]P.D. Darbre, Endocrine Disruptors and Obesity, Current obesity reports (2017).
A. Veiga-Lopez, Y. Pu, J. Gingrich, V. Padmanabhan
Obesogenic Endocrine Disrupting Chemicals: Identifying Knowledge Gaps
Trends in endocrinology and metabolism: TEM, 29 (9) (2018), pp. 607-625
ArticleDownload PDFView Record in ScopusGoogle Scholar[16]
R. Chamorro-Garcia, B. Blumberg
Current Research Approaches and Challenges in the Obesogen Field
Front Endocrinol (Lausanne), 10 (2019), p. 167
View Record in ScopusGoogle Scholar[17]
A.A. Amato, H.B. Wheeler, B. Blumberg
Obesity and endocrine-disrupting chemicals
Endocr Connect, 10 (2) (2021), pp. R87-R105 View PDF
CrossRefView Record in ScopusGoogle Scholar[18]
R.J. Egusquiza, B. Blumberg
Environmental Obesogens and Their Impact on Susceptibility to Obesity: New Mechanisms and Chemicals
Endocrinology, 161 (3) (2020)
O. Papalou, E.A. Kandaraki, G. Papadakis, E. Diamanti-Kandarakis
Endocrine Disrupting Chemicals: An Occult Mediator of Metabolic Disease
Front Endocrinol (Lausanne), 10 (2019), p. 112
View Record in ScopusGoogle Scholar[20]
J.J. Heindel
History of the Obesogen Field: Looking Back to Look Forward
Front. Endocrinol., 10 (14) (2019)
M.A. Hanson, P.D. Gluckman
Early Developmental Conditioning of Later Health and Disease
Physiology or Pathophysiology? (2014)
Google Scholar[22]J.J. Heindel, J. Balbus, L. Birnbaum, M.N. Brune-Drisse, P. Grandjean, K. Gray, P.J. Landrigan, P.D. Sly, W. Suk, D. Cory Slechta, C. Thompson, M. Hanson, Developmental Origins of Health and Disease: Integrating Environmental Influences, Endocrinology 156(10) (2015) 3416-21.
J.J. Heindel
Role of exposure to environmental chemicals in the developmental basis of reproductive disease and dysfunction
Semin Reprod Med, 24 (3) (2006), pp. 168-177 View PDF
CrossRefView Record in ScopusGoogle Scholar[24]
J. Stel, J. Legler
The Role of Epigenetics in the Latent Effects of Early Life Exposure to Obesogenic Endocrine Disrupting Chemicals
Endocrinology (2015), p. en20151434
C.P. Martinez-Jimenez, J. Sandoval
Epigenetic crosstalk: a molecular language in human metabolic disorders
Frontiers in bioscience (Scholar edition), 7 (2015), pp. 46-57
View Record in ScopusGoogle Scholar[26]
L. Statello, C.J. Guo, L.L. Chen, M. Huarte
Gene regulation by long non-coding RNAs and its biological functions
Nat. Rev. Mol. Cell Biol., 22 (2) (2021), pp. 96-118 View PDF
CrossRefView Record in ScopusGoogle Scholar[27]
G. Romano, D. Veneziano, G. Nigita, S.P. Nana-Sinkam
RNA Methylation in ncRNA: Classes
Detection, and Molecular Associations, Front Genet, 9 (2018), p. 243
View Record in ScopusGoogle Scholar[28]
R. Sonkar, C.A. Powell, M. Choudhury
Benzyl butyl phthalate induces epigenetic stress to enhance adipogenesis in mesenchymal stem cells
Mol. Cell. Endocrinol., 431 (2016), pp. 109-122
ArticleDownload PDFView Record in ScopusGoogle Scholar[29]
J. Zhang, M. Choudhury
Benzyl Butyl Phthalate Induced Early lncRNA H19 Regulation in C3H10T1/2 Stem Cell Line
Chem. Res. Toxicol., 34 (1) (2021), pp. 54-62 View PDF
M. Verbanck, M. Canouil, A. Leloire, V. Dhennin, X. Coumoul, L. Yengo, P. Froguel, O. Poulain-Godefroy
Low-dose exposure to bisphenols A, F and S of human primary adipocyte impacts coding and non-coding RNA profiles
PLoS ONE, 12 (6) (2017), Article e0179583 View PDF
CrossRefView Record in ScopusGoogle Scholar[31]
M. Susiarjo, F. Xin, A. Bansal, M. Stefaniak, C. Li, R.A. Simmons, M.S. Bartolomei
Bisphenol A exposure disrupts metabolic health across multiple generations in the mouse
Endocrinology (2015), p. en20142027
R.I. Joh, C.M. Palmieri, I.T. Hill, M. Motamedi
Regulation of histone methylation by noncoding RNAs
BBA, 1839 (12) (2014), pp. 1385-1394
ArticleDownload PDFView Record in ScopusGoogle Scholar[33]
T. Squillaro, G. Peluso, U. Galderisi, G. Di Bernardo
Long non-coding RNAs in regulation of adipogenesis and adipose tissue function
Elife, 9 (2020)
J.L. Rinn, M. Kertesz, J.K. Wang, S.L. Squazzo, X. Xu, S.A. Brugmann, L.H. Goodnough, J.A. Helms, P.J. Farnham, E. Segal, H.Y. Chang
Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs
Cell, 129 (7) (2007), pp. 1311-1323
ArticleDownload PDFView Record in ScopusGoogle Scholar[35]
T.R. Mercer, M.E. Dinger, S.M. Sunkin, M.F. Mehler, J.S. Mattick
Specific expression of long noncoding RNAs in the mouse brain
PNAS, 105 (2) (2008), pp. 716-721 View PDF
CrossRefView Record in ScopusGoogle Scholar[36]
C.M. Clemson, J.N. Hutchinson, S.A. Sara, A.W. Ensminger, A.H. Fox, A. Chess, J.B. Lawrence
An architectural role for a nuclear noncoding RNA: NEAT1 RNA is essential for the structure of paraspeckles
Mol. Cell, 33 (6) (2009), pp. 717-726
ArticleDownload PDFGoogle Scholar[37]G. Chen, Z. Wang, D. Wang, C. Qiu, M. Liu, X. Chen, Q. Zhang, G. Yan, Q. Cui, LncRNADisease: a database for long-non-coding RNA-associated diseases, Nucleic acids research 41(Database issue) (2013) D983-6.
L. Sun, L.A. Goff, C. Trapnell, R. Alexander, K.A. Lo, E. Hacisuleyman, M. Sauvageau, B. Tazon-Vega, D.R. Kelley, D.G. Hendrickson, B. Yuan, M. Kellis, H.F. Lodish, J.L. Rinn
Long noncoding RNAs regulate adipogenesis
PNAS, 110 (9) (2013), pp. 3387-3392 View PDF
CrossRefView Record in ScopusGoogle Scholar[39]
X.Y. Zhao, S. Li, G.X. Wang, Q. Yu, J.D. Lin
A long noncoding RNA transcriptional regulatory circuit drives thermogenic adipocyte differentiation
Mol. Cell, 55 (3) (2014), pp. 372-382
ArticleDownload PDFView Record in ScopusGoogle Scholar[40]
S.N. Wijesinghe, T. Nicholson, K. Tsintzas, S.W. Jones
Involvements of long noncoding RNAs in obesity-associated inflammatory diseases
Obes. Rev., 22 (4) (2021), Article e13156
View Record in ScopusGoogle Scholar[41]
C.F. Woeller, E. Flores, S.J. Pollock, R.P. Phipps
Editor’s Highlight: Thy1 (CD90) Expression is Reduced by the Environmental Chemical Tetrabromobisphenol-A to Promote Adipogenesis Through Induction of microRNA-103
Toxicological sciences : an official journal of the Society of Toxicology, 157 (2) (2017), pp. 305-319 View PDF
CrossRefView Record in ScopusGoogle Scholar[42]
M.K. Skinner
Environmental Epigenetics and a Unified Theory of the Molecular Aspects of Evolution: A Neo-Lamarckian Concept that Facilitates Neo-Darwinian Evolution
Genome biology and evolution, 7 (5) (2015), pp. 1296-1302 View PDF
CrossRefView Record in ScopusGoogle Scholar[43]
R. Chamorro-Garcia, M. Sahu, R.J. Abbey, J. Laude, N. Pham, B. Blumberg
Transgenerational inheritance of increased fat depot size, stem cell reprogramming, and hepatic steatosis elicited by prenatal exposure to the obesogen tributyltin in mice
Environ. Health Perspect., 121 (3) (2013), pp. 359-366 View PDF
CrossRefView Record in ScopusGoogle Scholar[44]
R. Chamorro-Garcia, C. Diaz-Castillo, B.M. Shoucri, H. Kach, R. Leavitt, T. Shioda, B. Blumberg
Ancestral perinatal obesogen exposure results in a transgenerational thrifty phenotype in mice
Nat. Commun., 8 (1) (2017), p. 2012
R. Chamorro-García, N. Poupin, M. Tremblay-Franco, C. Canlet, R. Egusquiza, R. Gautier, I. Jouanin, B.M. Shoucri, B. Blumberg, D. Zalko
Transgenerational metabolomic fingerprints in mice ancestrally exposed to the obesogen TBT
Environ. Int., 157 (2021), Article 106822
ArticleDownload PDFView Record in ScopusGoogle Scholar[46]
M.K. Skinner, M. Manikkam, R. Tracey, C. Guerrero-Bosagna, M. Haque, E.E. Nilsson
Ancestral dichlorodiphenyltrichloroethane (DDT) exposure promotes epigenetic transgenerational inheritance of obesity
BMC Med, 11 (2013), p. 228 View PDF
CrossRefView Record in ScopusGoogle Scholar[47]
R. Tracey, M. Manikkam, C. Guerrero-Bosagna, M.K. Skinner
Hydrocarbons (jet fuel JP-8) induce epigenetic transgenerational inheritance of obesity, reproductive disease and sperm epimutations
Reprod. Toxicol., 36 (2013), pp. 104-116
ArticleDownload PDFView Record in ScopusGoogle Scholar[48]
M. Manikkam, R. Tracey, C. Guerrero-Bosagna, M.K. Skinner
Plastics derived endocrine disruptors (BPA, DEHP and DBP) induce epigenetic transgenerational inheritance of obesity, reproductive disease and sperm epimutations
PLoS ONE, 8 (1) (2013), Article e55387 View PDF
CrossRefView Record in ScopusGoogle Scholar[49]
S.E. King, E. Nilsson, D. Beck, M.K. Skinner
Adipocyte epigenetic alterations and potential therapeutic targets in transgenerationally inherited lean and obese phenotypes following ancestral exposures
Adipocyte, 8 (1) (2019), pp. 362-378 View PDF
CrossRefView Record in ScopusGoogle Scholar[50]
Y. Xu, W. Wang, M. Chen, J. Zhou, X. Huang, S. Tao, B. Pan, Z. Li, X. Xie, W. Li, H. Kan, Z. Ying
Developmental programming of obesity by maternal exposure to concentrated ambient PM(2.5) is maternally transmitted into the third generation in a mouse model
Part. Fibre Toxicol., 16 (1) (2019), p. 27
ArticleDownload PDFGoogle Scholar[51]
A. Bansal, C. Li, F. Xin, A. Duemler, W. Li, C. Rashid, M.S. Bartolomei, R.A. Simmons
Transgenerational effects of maternal bisphenol: a exposure on offspring metabolic health
Journal of developmental origins of health and disease, 10 (2) (2019), pp. 164-175 View PDF
CrossRefView Record in ScopusGoogle Scholar[52]
O. Rechavi, L. Houri-Ze’evi, S. Anava, W.S.S. Goh, S.Y. Kerk, G.J. Hannon, O. Hobert
Starvation-induced transgenerational inheritance of small RNAs in C. elegans
Cell, 158 (2) (2014), pp. 277-287
ArticleDownload PDFView Record in ScopusGoogle Scholar[53]
A. Tauffenberger, J.A. Parker
Heritable transmission of stress resistance by high dietary glucose in Caenorhabditis elegans
PLoS Genet., 10 (5) (2014), Article e1004346 View PDF
CrossRefView Record in ScopusGoogle Scholar[54]
X. Zhou, J. Li, X. Zhang, C. Zhang, J. Bai, Y. Zhao, Y. Zhu, J. Zhang, X. Xiao
Bisphenol S promotes fat storage in multiple generations of Caenorhabditis elegans in a daf-16/nhr-49 dependent manner
Comp. Biochem. Physiol. C: Toxicol. Pharmacol., 109175 (2021)
M.Y. Chen, H.P. Liu, J. Cheng, S.Y. Chiang, W.P. Liao, W.Y. Lin
Transgenerational impact of DEHP on body weight of Drosophila
Chemosphere, 221 (2019), pp. 493-499
ArticleDownload PDFView Record in ScopusGoogle Scholar[56]
J. Camacho, L. Truong, Z. Kurt, Y.W. Chen, M. Morselli, G. Gutierrez, M. Pellegrini, X. Yang, P. Allard
The Memory of Environmental Chemical Exposure in C. elegans Is Dependent on the Jumonji Demethylases jmjd-2 and jmjd-3/utx-1
Cell reports, 23 (8) (2018), pp. 2392-2404
ArticleDownload PDFView Record in ScopusGoogle Scholar[57]
M. Ben Maamar, E. Nilsson, I. Sadler-Riggleman, D. Beck, J.R. McCarrey, M.K. Skinner
Developmental origins of transgenerational sperm DNA methylation epimutations following ancestral DDT exposure
Dev. Biol., 445 (2) (2018), pp. 280-293
M.K. Skinner, M. Ben Maamar, I. Sadler-Riggleman, D. Beck, E. Nilsson, M. McBirney, R. Klukovich, Y. Xie, C. Tang, W. Yan
Alterations in sperm DNA methylation, non-coding RNA and histone retention associate with DDT-induced epigenetic transgenerational inheritance of disease
Epigenetics Chromatin, 11 (1) (2018), p. 8 View PDF
B.R. Carone, L. Fauquier, N. Habib, J.M. Shea, C.E. Hart, R. Li, C. Bock, C. Li, H. Gu, P.D. Zamore, A. Meissner, Z. Weng, H.A. Hofmann, N. Friedman, O.J. Rando
Paternally induced transgenerational environmental reprogramming of metabolic gene expression in mammals
Cell, 143 (7) (2010), pp. 1084-1096
ArticleDownload PDFView Record in ScopusGoogle Scholar[60]
C. Diaz-Castillo, R. Chamorro-Garcia, T. Shioda, B. Blumberg
Transgenerational Self-Reconstruction of Disrupted Chromatin Organization After Exposure To An Environmental Stressor in Mice
Sci. Rep., 9 (1) (2019), p. 13057
View Record in ScopusGoogle Scholar[61]
X. Shao, M. Wang, X. Wei, S. Deng, N. Fu, Q. Peng, Y. Jiang, L. Ye, J. Xie, Y. Lin
Peroxisome Proliferator-Activated Receptor-γ: Master Regulator of Adipogenesis and Obesity
Curr. Stem Cell Res. Ther., 11 (3) (2016), pp. 282-289 View PDF
CrossRefView Record in ScopusGoogle Scholar[62]
P. Gao, L. Wang, N. Yang, J. Wen, M. Zhao, G. Su, J. Zhang, D. Weng
Peroxisome proliferator-activated receptor gamma (PPARγ) activation and metabolism disturbance induced by bisphenol A and its replacement analog bisphenol S using in vitro macrophages and in vivo mouse models
Environ. Int., 134 (2020), Article 105328
ArticleDownload PDFView Record in ScopusGoogle Scholar[63]
L.A. Hoepner
Bisphenol a: A narrative review of prenatal exposure effects on adipogenesis and childhood obesity via peroxisome proliferator-activated receptor gamma
Environ. Res., 173 (2019), pp. 54-68
ArticleDownload PDFView Record in ScopusGoogle Scholar[64]
Q. Wen, X. Xie, C. Zhao, Q. Ren, X. Zhang, D. Wei, B. Emanuelli, Y. Du
The brominated flame retardant PBDE 99 promotes adipogenesis via regulating mitotic clonal expansion and PPARgamma expression
The Science of the total environment, 670 (2019), pp. 67-77
ArticleDownload PDFView Record in ScopusGoogle Scholar[65]
Y. Ma, J. Yang, Y. Wan, Y. Peng, S. Ding, Y. Li, B. Xu, X. Chen, W. Xia, Y. Ke, S. Xu
Low-level perfluorooctanoic acid enhances 3T3–L1 preadipocyte differentiation via altering peroxisome proliferator activated receptor gamma expression and its promoter DNA methylation
Journal of applied toxicology : JAT, 38 (3) (2018), pp. 398-407 View PDF
CrossRefView Record in ScopusGoogle Scholar[66]
A. Lyssimachou, J.G. Santos, A. André, J. Soares, D. Lima, L. Guimarães, C.M.R. Almeida, C. Teixeira, L.F.C. Castro, M.M. Santos
The Mammalian “Obesogen” Tributyltin Targets Hepatic Triglyceride Accumulation and the Transcriptional Regulation of Lipid Metabolism in the Liver and Brain of Zebrafish
PLoS ONE, 10 (12) (2015), p. e0143911 View PDF
E.D. Rosen, P. Sarraf, A.E. Troy, G. Bradwin, K. Moore, D.S. Milstone, B.M. Spiegelman, R.M. Mortensen
PPAR gamma is required for the differentiation of adipose tissue in vivo and in vitro
Mol. Cell, 4 (4) (1999), pp. 611-617
ArticleDownload PDFView Record in ScopusGoogle Scholar[68]
P. Tontonoz, S. Singer, B.M. Forman, P. Sarraf, J.A. Fletcher, C.D. Fletcher, R.P. Brun, E. Mueller, S. Altiok, H. Oppenheim, R.M. Evans, B.M. Spiegelman
Terminal differentiation of human liposarcoma cells induced by ligands for peroxisome proliferator-activated receptor gamma and the retinoid X receptor
PNAS, 94 (1) (1997), pp. 237-241
View Record in ScopusGoogle Scholar[69]
C.D. Kassotis, L. Masse, S. Kim, J.J. Schlezinger, T.F. Webster, H.M. Stapleton
Characterization of adipogenic chemicals in three different cell culture systems: implications for reproducibility based on cell source and handling
Sci. Rep., 7 (2017), p. 42104
View Record in ScopusGoogle Scholar[70]
T. Kanayama, N. Kobayashi, S. Mamiya, T. Nakanishi, J. Nishikawa
Organotin compounds promote adipocyte differentiation as agonists of the peroxisome proliferator-activated receptor [gamma]/retinoid X receptor pathway
Mol. Pharmacol., 67 (2005), pp. 766-774 View PDF
CrossRefView Record in ScopusGoogle Scholar[71]
F. Grun, B. Blumberg
Environmental obesogens: organotins and endocrine disruption via nuclear receptor signaling
Endocrinology, 147 (6 Suppl) (2006), pp. S50-S55
View Record in ScopusGoogle Scholar[72]
B.M. Shoucri, V.T. Hung, R. Chamorro-Garcia, T. Shioda, B. Blumberg
Retinoid X receptor activation during adipogenesis of female mesenchymal stem cells programs a dysfunctional adipocyte
Endocrinology (2018)
S. Kim, A. Li, S. Monti, J.J. Schlezinger
Tributyltin induces a transcriptional response without a brite adipocyte signature in adipocyte models
Arch. Toxicol., 92 (9) (2018), pp. 2859-2874 View PDF
CrossRefView Record in ScopusGoogle Scholar[74]
S.M. Regnier, E. El-Hashani, W. Kamau, X. Zhang, N.L. Massad, R.M. Sargis
Tributyltin differentially promotes development of a phenotypically distinct adipocyte
Obesity (Silver Spring), 23 (9) (2015), pp. 1864-1871 View PDF
CrossRefView Record in ScopusGoogle Scholar[75]
N. Fuentes, P. Silveyra
Estrogen receptor signaling mechanisms
Adv Protein Chem Struct Biol, 116 (2019), pp. 135-170
ArticleDownload PDFView Record in ScopusGoogle Scholar[76]
E.R. Hugo, T.D. Brandebourg, J.G. Woo, J. Loftus, J.W. Alexander, N. Ben-Jonathan
Bisphenol A at environmentally relevant doses inhibits adiponectin release from human adipose tissue explants and adipocytes
Environ. Health Perspect., 116 (12) (2008), pp. 1642-1647 View PDF
CrossRefView Record in ScopusGoogle Scholar[77]
P.S. Cooke, A. Naaz
Role of estrogens in adipocyte development and function
Exp Biol Med (Maywood), 229 (11) (2004), pp. 1127-1135 View PDF
CrossRefView Record in ScopusGoogle Scholar[78]
M.N. Dieudonne, R. Pecquery, M.C. Leneveu, Y. Giudicelli
Opposite effects of androgens and estrogens on adipogenesis in rat preadipocytes: evidence for sex and site-related specificities and possible involvement of insulin-like growth factor 1 receptor and peroxisome proliferator-activated receptor gamma2
Endocrinology, 141 (2) (2000), pp. 649-656
View Record in ScopusGoogle Scholar[79]
D.A. Roncari, R.L. Van
Promotion of human adipocyte precursor replication by 17beta-estradiol in culture
J Clin Invest, 62 (3) (1978), pp. 503-508 View PDF
CrossRefView Record in ScopusGoogle Scholar[80]
E.E. Hatch, R. Troisi, J.R. Palmer, L.A. Wise, L. Titus, W.C. Strohsnitter, W. Ricker, M. Hyer, R.N. Hoover
Prenatal diethylstilbestrol exposure and risk of obesity in adult women
J Dev Orig Health Dis, 6 (3) (2015), pp. 201-207
View Record in ScopusGoogle Scholar[81]
S. Lee, C. Kim, H. Shin, Y. Kho, K. Choi
Comparison of thyroid hormone disruption potentials by bisphenols A, S, F, and Z in embryo-larval zebrafish
Chemosphere, 221 (2019), pp. 115-123
ArticleDownload PDFView Record in ScopusGoogle Scholar[82]
K. Blouin, A. Boivin, A. Tchernof
Androgens and body fat distribution
J. Steroid Biochem. Mol. Biol., 108 (3–5) (2008), pp. 272-280
ArticleDownload PDFView Record in ScopusGoogle Scholar[83]
M.W. O’Reilly, P.J. House, J.W. Tomlinson
Understanding androgen action in adipose tissue
J. Steroid Biochem. Mol. Biol., 143 (2014), pp. 277-284
ArticleDownload PDFView Record in ScopusGoogle Scholar[84]
K. John, J.S. Marino, E.R. Sanchez, T.D. Hinds Jr.
The glucocorticoid receptor: cause of or cure for obesity?, American journal of physiology
Endocrinology and metabolism, 310 (4) (2016), pp. E249-E257 View PDF
CrossRefView Record in ScopusGoogle Scholar[85]
D. Contador, F. Ezquer, M. Espinosa, M. Arango-Rodriguez, C. Puebla, L. Sobrevia, P. Conget
Dexamethasone and rosiglitazone are sufficient and necessary for producing functional adipocytes from mesenchymal stem cells
Exp Biol Med (Maywood), 240 (9) (2015), pp. 1235-1246 View PDF
CrossRefView Record in ScopusGoogle Scholar[86]
M. Asada, A. Rauch, H. Shimizu, H. Maruyama, S. Miyaki, M. Shibamori, H. Kawasome, H. Ishiyama, J. Tuckermann, H. Asahara
DNA binding-dependent glucocorticoid receptor activity promotes adipogenesis via Kruppel-like factor 15 gene expression
Lab. Invest., 91 (2) (2011), pp. 203-215 View PDF
CrossRefView Record in ScopusGoogle Scholar[87]
R.M. Sargis, D.N. Johnson, R.A. Choudhury, M.J. Brady
Environmental Endocrine Disruptors Promote Adipogenesis in the 3T3-L1 Cell Line through Glucocorticoid Receptor Activation, Obesity (Silver Spring
Md.), 18 (7) (2010), pp. 1283-1288 View PDF
CrossRefView Record in ScopusGoogle Scholar[88]
K.A. Iwen, E. Schroder, G. Brabant
Thyroid hormones and the metabolic syndrome
European thyroid journal, 2 (2) (2013), pp. 83-92 View PDF
CrossRefView Record in ScopusGoogle Scholar[89]
M.J. Obregon
Thyroid hormone and adipocyte differentiation
Thyroid, 18 (2) (2008), pp. 185-195 View PDF
CrossRefView Record in ScopusGoogle Scholar[90]
A.I. Shulman, D.J. Mangelsdorf
Retinoid x receptor heterodimers in the metabolic syndrome
The New England journal of medicine, 353 (6) (2005), pp. 604-615
View Record in ScopusGoogle Scholar[91]
R. Mullur, Y.Y. Liu, G.A. Brent
Thyroid hormone regulation of metabolism
Physiol. Rev., 94 (2) (2014), pp. 355-382 View PDF
CrossRefView Record in ScopusGoogle Scholar[92]
J. Gao, W. Xie
Targeting xenobiotic receptors PXR and CAR for metabolic diseases
Trends Pharmacol. Sci., 33 (10) (2012), pp. 552-558
ArticleDownload PDFView Record in ScopusGoogle Scholar[93]
A. Moreau, M.J. Vilarem, P. Maurel, J.M. Pascussi
Xenoreceptors CAR and PXR activation and consequences on lipid metabolism, glucose homeostasis, and inflammatory response
Mol. Pharm., 5 (1) (2008), pp. 35-41 View PDF
K. Saito, K. Kobayashi, Y. Mizuno, Y. Fukuchi, T. Furihata, K. Chiba
Peroxisome proliferator-activated receptor alpha (PPARalpha) agonists induce constitutive androstane receptor (CAR) and cytochrome P450 2B in rat primary hepatocytes
Drug Metab. Pharmacokinet., 25 (1) (2010), pp. 108-111
ArticleDownload PDFCrossRefView Record in ScopusGoogle Scholar[95]
J.E. Hardesty, B. Wahlang, K.C. Falkner, H. Shi, J. Jin, D. Wilkey, M. Merchant, C. Watson, R.A. Prough, M.C. Cave
Hepatic signalling disruption by pollutant Polychlorinated biphenyls in steatohepatitis
Cell. Signal., 53 (2019), pp. 132-139
ArticleDownload PDFView Record in ScopusGoogle Scholar[96]
C. Lukowicz, S. Ellero-Simatos, M. Régnier, A. Polizzi, F. Lasserre, A. Montagner, Y. Lippi, E.L. Jamin, J.-F. Martin, C. Naylies, C. Canlet, L. Debrauwer, J. Bertrand-Michel, T. Al Saati, V. Théodorou, N. Loiseau, L. Mselli-Lakhal, H. Guillou, L. Gamet-Payrastre
Metabolic Effects of a Chronic Dietary Exposure to a Low-Dose Pesticide Cocktail in Mice: Sexual Dimorphism and Role of the Constitutive Androstane Receptor
Environ. Health Perspect., 126 (6) (2018), p. 067007 View PDF
CrossRefView Record in ScopusGoogle Scholar[97]
H. Wang, J. Chen, K. Hollister, L.C. Sowers, B.M. Forman
Endogenous bile acids are ligands for the nuclear receptor FXR/BAR
Mol. Cell, 3 (5) (1999), pp. 543-553
ArticleDownload PDFView Record in ScopusGoogle Scholar[98]
Y. Jiao, Y. Lu, X.Y. Li
Farnesoid X receptor: a master regulator of hepatic triglyceride and glucose homeostasis
Acta Pharmacol. Sin., 36 (1) (2015), pp. 44-50 View PDF
CrossRefView Record in ScopusGoogle Scholar[99]
J. Prawitt, S. Caron, B. Staels
How to modulate FXR activity to treat the Metabolic Syndrome
Drug Discov Today: Disease Mechanisms, 6 (1–4) (2009), pp. e55-e64
ArticleDownload PDFView Record in ScopusGoogle Scholar[100]
G. Rizzo, M. Disante, A. Mencarelli, B. Renga, A. Gioiello, R. Pellicciari, S. Fiorucci
The farnesoid X receptor promotes adipocyte differentiation and regulates adipose cell function in vivo
Mol. Pharmacol., 70 (4) (2006), pp. 1164-1173 View PDF
CrossRefView Record in ScopusGoogle Scholar[101]
B. Cariou, K. van Harmelen, D. Duran-Sandoval, T.H. van Dijk, A. Grefhorst, M. Abdelkarim, S. Caron, G. Torpier, J.C. Fruchart, F.J. Gonzalez, F. Kuipers, B. Staels
The farnesoid X receptor modulates adiposity and peripheral insulin sensitivity in mice
J. Biol. Chem., 281 (16) (2006), pp. 11039-11049
ArticleDownload PDFCrossRefView Record in ScopusGoogle Scholar[102]
J.A. Bjork, J.L. Butenhoff, K.B. Wallace
Multiplicity of nuclear receptor activation by PFOA and PFOS in primary human and rodent hepatocytes
Toxicology, 288 (1–3) (2011), pp. 8-17
ArticleDownload PDFView Record in ScopusGoogle Scholar[103]
B.E. McIntosh, J.B. Hogenesch, C.A. Bradfield
Mammalian Per-Arnt-Sim proteins in environmental adaptation
Annu. Rev. Physiol., 72 (2010), pp. 625-645 View PDF
CrossRefView Record in ScopusGoogle Scholar[104]
K. Rathore, M. Cekanova
Effects of environmental carcinogen benzo(a)pyrene on canine adipose-derived mesenchymal stem cells
Res. Vet. Sci., 103 (2015), pp. 34-43
ArticleDownload PDFView Record in ScopusGoogle Scholar[105]
M.J. Kim, V. Pelloux, E. Guyot, J. Tordjman, L.-C. Bui, A. Chevallier, C. Forest, C. Benelli, K. Clément, R. Barouki
Inflammatory Pathway Genes belong to Major Targets of Persistent Organic Pollutants in Adipose Cells
Environ. Health Perspect. (2012)
Google Scholar[106]J. Kanno, Introduction to the concept of signal toxicity, J Toxicol Sci 41(Special) (2016) SP105-SP109.
Google Scholar[107]e.e.e. European Association for the Study of the Liver. Electronic address, C. Clinical Practice Guideline Panel, m. Panel, E.G.B. representative, EASL Clinical Practice Guideline: Occupational liver diseases, J Hepatol 71(5) (2019) 1022-1037.
B. Wahlang, J.I. Beier, H.B. Clair, H.J. Bellis-Jones, K.C. Falkner, C.J. McClain, M.C. Cave
Toxicant-associated Steatohepatitis
Toxicol. Pathol., 41 (2) (2013), pp. 343-360 View PDF
CrossRefView Record in ScopusGoogle Scholar[109]
B. Wahlang, J. Jin, J.I. Beier, J.E. Hardesty, E.F. Daly, R.D. Schnegelberger, K.C. Falkner, R.A. Prough, I.A. Kirpich, M.C. Cave
Mechanisms of Environmental Contributions to Fatty Liver Disease
Current environmental health reports, 6 (3) (2019), pp. 80-94 View PDF
CrossRefView Record in ScopusGoogle Scholar[110]
M. Cave, K.C. Falkner, M. Ray, S. Joshi-Barve, G. Brock, R. Khan, M. Bon Homme, C.J. McClain
Toxicant-associated steatohepatitis in vinyl chloride workers
Hepatology, 51 (2) (2010), pp. 474-481 View PDF
CrossRefView Record in ScopusGoogle Scholar[111]
B. Wahlang, K.C. Falkner, B. Gregory, D. Ansert, D. Young, D.J. Conklin, A. Bhatnagar, C.J. McClain, M. Cave
Polychlorinated biphenyl 153 is a diet-dependent obesogen that worsens nonalcoholic fatty liver disease in male C57BL6/J mice
The Journal of Nutritional Biochemistry, 24 (9) (2013), pp. 1587-1595
ArticleDownload PDFView Record in ScopusGoogle Scholar[112]
C.E. Foulds, L.S. Trevino, B. York, C.L. Walker
Endocrine-disrupting chemicals and fatty liver disease
Nat Rev Endocrinol advance online publication (2017)
C.W. Wang, H.Y. Chuang, K.W. Liao, M.L. Yu, C.Y. Dai, W.T. Chang, C.H. Tsai, H.C. Chiang, P.C. Huang
Urinary thiodiglycolic acid is associated with increased risk of non-alcoholic fatty liver disease in children living near a petrochemical complex
Environ. Int., 131 (2019), Article 104978
ArticleDownload PDFView Record in ScopusGoogle Scholar[114]
T.H. Yuan, J.L. Chen, R.H. Shie, Y.P. Yeh, Y.H. Chen, C.C. Chan
Liver fibrosis associated with potential vinyl chloride and ethylene dichloride exposure from the petrochemical industry
The Science of the total environment, 739 (2020), Article 139920
ArticleDownload PDFView Record in ScopusGoogle Scholar[115]X. Li, C. Zhang, K. Wang, H.J. Lehmler, Fatty liver and impaired hepatic metabolism alter the congener-specific distribution of polychlorinated biphenyls (PCBs) in mice with a liver-specific deletion of cytochrome P450 reductase, Environmental pollution (Barking, Essex : 1987) 266(Pt 1) (2020) 115233.
J. Allard, D. Le Guillou, K. Begriche, B. Fromenty
Drug-induced liver injury in obesity and nonalcoholic fatty liver disease
Adv. Pharmacol., 85 (2019), pp. 75-107
ArticleDownload PDFView Record in ScopusGoogle Scholar[117]
J.E. Hardesty, L. Al-Eryani, B. Wahlang, K.C. Falkner, H. Shi, J. Jin, B.J. Vivace, B.P. Ceresa, R.A. Prough, M.C. Cave
Epidermal Growth Factor Receptor Signaling Disruption by Endocrine and Metabolic Disrupting Chemicals
Toxicological sciences : an official journal of the Society of Toxicology, 162 (2) (2018), pp. 622-634 View PDF
CrossRefView Record in ScopusGoogle Scholar[118]
J.E. Hardesty, B. Wahlang, R.A. Prough, K.Z. Head, D. Wilkey, M. Merchant, H. Shi, J. Jin, M.C. Cave
Effect of Epidermal Growth Factor Treatment and Polychlorinated Biphenyl Exposure in a Dietary-Exposure Mouse Model of Steatohepatitis
Environ. Health Perspect., 129 (3) (2021), p. 37010
J.J. Lim, X. Li, H.J. Lehmler, D. Wang, H. Gu, J.Y. Cui
Gut Microbiome Critically Impacts PCB-induced Changes in Metabolic Fingerprints and the Hepatic Transcriptome in Mice
Toxicological sciences : an official journal of the Society of Toxicology, 177 (1) (2020), pp. 168-187 View PDF
CrossRefView Record in ScopusGoogle Scholar[120]
J. Bassler, A. Ducatman, M. Elliott, S. Wen, B. Wahlang, J. Barnett, M.C. Cave
Environmental perfluoroalkyl acid exposures are associated with liver disease characterized by apoptosis and altered serum adipocytokines, Environmental pollution (Barking
Essex, 247 (2019) (1987), pp. 1055-1063
R. Jin, R. McConnell, C. Catherine, S. Xu, D.I. Walker, N. Stratakis, D.P. Jones, G.W. Miller, C. Peng, D.V. Conti, M.B. Vos, L. Chatzi
Perfluoroalkyl substances and severity of nonalcoholic fatty liver in Children: An untargeted metabolomics approach
Environ. Int., 134 (2020), Article 105220
ArticleDownload PDFView Record in ScopusGoogle Scholar[122]N. Stratakis, V.C. D, R. Jin, K. Margetaki, D. Valvi, A.P. Siskos, L. Maitre, E. Garcia, N. Varo, Y. Zhao, T. Roumeliotaki, M. Vafeiadi, J. Urquiza, S. Fernandez-Barres, B. Heude, X. Basagana, M. Casas, S. Fossati, R. Grazuleviciene, S. Andrusaityte, K. Uppal, R.R.C. McEachan, E. Papadopoulou, O. Robinson, L.S. Haug, J. Wright, M.B. Vos, H.C. Keun, M. Vrijheid, K.T. Berhane, R. McConnell, L. Chatzi, Prenatal Exposure to Perfluoroalkyl Substances Associated With Increased Susceptibility to Liver Injury in Children, Hepatology 72(5) (2020) 1758-1770.
T.A. Katz, S.L. Grimm, A. Kaushal, J. Dong, L.S. Trevino, R.K. Jangid, A.V. Gaitan, J.P. Bertocchio, Y. Guan, M.J. Robertson, R.M. Cabrera, M.J. Finegold, C.E. Foulds, C. Coarfa, C.L. Walker
Hepatic Tumor Formation in Adult Mice Developmentally Exposed to Organotin
Environ. Health Perspect., 128 (1) (2020), p. 17010
M.E. Franco, M.T. Fernandez-Luna, A.J. Ramirez, R. Lavado
Metabolomic-based assessment reveals dysregulation of lipid profiles in human liver cells exposed to environmental obesogens
Toxicol. Appl. Pharmacol., 398 (2020), Article 115009
ArticleDownload PDFView Record in ScopusGoogle Scholar[125]
L. Sun, Y. Ling, J. Jiang, D. Wang, J. Wang, J. Li, X. Wang, H. Wang
Differential mechanisms regarding triclosan vs. bisphenol A and fluorene-9-bisphenol induced zebrafish lipid-metabolism disorders by RNA-Seq
Chemosphere, 251 (2020), Article 126318
ArticleDownload PDFView Record in ScopusGoogle Scholar[126]
J. Qin, S. Ru, W. Wang, L. Hao, Y. Ru, J. Wang, X. Zhang
Long-term bisphenol S exposure aggravates non-alcoholic fatty liver by regulating lipid metabolism and inducing endoplasmic reticulum stress response with activation of unfolded protein response in male zebrafish
Environ. Pollut., 263 (2020), Article 114535
ArticleDownload PDFView Record in ScopusGoogle Scholar[127]
M. Huff, W.A. da Silveira, O. Carnevali, L. Renaud, G. Hardiman
Systems Analysis of the Liver Transcriptome in Adult Male Zebrafish Exposed to the Plasticizer (2-Ethylhexyl) Phthalate (DEHP)
Sci. Rep., 8 (1) (2018), p. 2118
View Record in ScopusGoogle Scholar[128]
M.F. Yueh, F. He, C. Chen, C. Vu, A. Tripathi, R. Knight, M. Karin, S. Chen, R.H. Tukey
Triclosan leads to dysregulation of the metabolic regulator FGF21 exacerbating high fat diet-induced nonalcoholic fatty liver disease
PNAS, 117 (49) (2020), pp. 31259-31266 View PDF
CrossRefView Record in ScopusGoogle Scholar[129]
H. Shi, J. Jan, J.E. Hardesty, K.C. Falkner, R.A. Prough, A.N. Balamurugan, S.P. Mokshagundam, S.T. Chari, M.C. Cave
Polychlorinated biphenyl exposures differentially regulate hepatic metabolism and pancreatic function: Implications for nonalcoholic steatohepatitis and diabetes
Toxicol. Appl. Pharmacol., 363 (2019), pp. 22-33
ArticleDownload PDFView Record in ScopusGoogle Scholar[130]
G.Y. Go, S.J. Lee, A. Jo, J.R. Lee, J.S. Kang, M. Yang, G.U. Bae
Bisphenol A and estradiol impede myoblast differentiation through down-regulating Akt signaling pathway
Toxicol. Lett., 292 (2018), pp. 12-19
ArticleDownload PDFView Record in ScopusGoogle Scholar[131]
V. Mullainadhan, M.P. Viswanathan, B. Karundevi
Effect of Bisphenol-A (BPA) on insulin signal transduction and GLUT4 translocation in gastrocnemius muscle of adult male albino rat
Int. J. Biochem. Cell Biol., 90 (2017), pp. 38-47
ArticleDownload PDFView Record in ScopusGoogle Scholar[132]
B. Li, J. Guo, Z. Xi, J. Xu, Z. Zuo, C. Wang
Tributyltin in male mice disrupts glucose homeostasis as well as recovery after exposure: mechanism analysis
Arch. Toxicol., 91 (10) (2017), pp. 3261-3269 View PDF
CrossRefView Record in ScopusGoogle Scholar[133]K. Chiu, G. Warner, R.A. Nowak, J.A. Flaws, W. Mei, The Impact of Environmental Chemicals on the Gut Microbiome, Toxicological sciences : an official journal of the Society of Toxicology (176(2)) (2020) 253-284.
C.S. Rosenfeld
Gut Dysbiosis in Animals Due to Environmental Chemical Exposures
Front. Cell. Infect. Microbiol., 7 (2017), p. 396
View Record in ScopusGoogle Scholar[135]
S.P. Claus, H. Guillou, S. Ellero-Simatos
The gut microbiota: a major player in the toxicity of environmental pollutants?
npj Biofilms Microbiomes, 2 (2016), p. 16003
View Record in ScopusGoogle Scholar[136]
K.H. Liu, J.A. Owens, B. Saeedi, C.E. Cohen, M.P. Bellissimo, C. Naudin, T. Darby, S. Druzak, K. Maner-Smith, M. Orr, X. Hu, J. Fernandes, M.C. Camacho, S. Hunter-Chang, D. VanInsberghe, C. Ma, T. Ganesh, S.M. Yeligar, K. Uppal, Y.-M. Go, J.A. Alvarez, M.B. Vos, T.R. Ziegler, M.H. Woodworth, C.S. Kraft, R.M. Jones, E. Ortlund, A.S. Neish, D.P. Jones
Microbial metabolite delta-valerobetaine is a diet-dependent obesogen
Nature Metabolism, 3 (12) (2021), pp. 1694-1705 View PDF
CrossRefView Record in ScopusGoogle Scholar[137]
K.A. Fader, R. Nault, C.M. Doskey, R.R. Fling, T.R. Zacharewski
2,3,7,8-Tetrachlorodibenzo-p-dioxin abolishes circadian regulation of hepatic metabolic activity in mice
Sci. Rep., 9 (1) (2019), p. 6514
View Record in ScopusGoogle Scholar[138]
Y. Jin, Z. Zeng, Y. Wu, S. Zhang, Z. Fu
Oral Exposure of Mice to Carbendazim Induces Hepatic Lipid Metabolism Disorder and Gut Microbiota Dysbiosis
Toxicological sciences : an official journal of the Society of Toxicology, 147 (1) (2015), pp. 116-126 View PDF
C. Wang, C.-X. Xu, S.L. Krager, K.M. Bottum, D.-F. Liao, S.A. Tischkau
Aryl Hydrocarbon Receptor Deficiency Enhances Insulin Sensitivity and Reduces PPAR-α Pathway Activity in Mice
Environ. Health Perspect., 119 (12) (2011), pp. 1739-1744 View PDF
CrossRefView Record in ScopusGoogle Scholar[140]
C. Wang, Z.M. Zhang, C.X. Xu, S.A. Tischkau
Interplay between Dioxin-mediated signaling and circadian clock: a possible determinant in metabolic homeostasis
Int. J. Mol. Sci., 15 (7) (2014), pp. 11700-11712 View PDF
CrossRefView Record in ScopusGoogle Scholar[141]
S.M. Regnier, A.G. Kirkley, H. Ye, E. El-Hashani, X. Zhang, B.A. Neel, W. Kamau, C.C. Thomas, A.K. Williams, E.T. Hayes, N.L. Massad, D.N. Johnson, L. Huang, C. Zhang, R.M. Sargis
Dietary exposure to the endocrine disruptor tolylfluanid promotes global metabolic dysfunction in male mice
Endocrinology, 156 (3) (2015), pp. 896-910 View PDF
CrossRefView Record in ScopusGoogle Scholar[142]
R. Kopp, I.O. Martínez, J. Legradi, J. Legler
Exposure to endocrine disrupting chemicals perturbs lipid metabolism and circadian rhythms
J Environ Sci (China), 62 (2017), pp. 133-137
ArticleDownload PDFView Record in ScopusGoogle Scholar[143]
N. Loganathan, A. Salehi, J.A. Chalmers, D.D. Belsham
Bisphenol A Alters Bmal1, Per2, and Rev-Erba mRNA and Requires Bmal1 to Increase Neuropeptide Y Expression in Hypothalamic Neurons
Endocrinology, 160 (1) (2019), pp. 181-192 View PDF
CrossRefView Record in ScopusGoogle Scholar[144]
L.N. Bottalico, A.M. Weljie
Cross-species physiological interactions of endocrine disrupting chemicals with the circadian clock
Gen. Comp. Endocrinol., 301 (2021), Article 113650
ArticleDownload PDFView Record in ScopusGoogle Scholar[145]
D. Nesan, K.M. Feighan, M.C. Antle, D.M. Kurrasch
Gestational low-dose BPA exposure impacts suprachiasmatic nucleus neurogenesis and circadian activity with transgenerational effects
Sci. Adv., 7 (22) (2021)
X. Yin, Y. Liu, R. Zeb, F. Chen, H. Chen, K.J. Wang
The intergenerational toxic effects on offspring of medaka fish Oryzias melastigma from parental benzo[a]pyrene exposure via interference of the circadian rhythm, Environmental pollution (Barking
Essex, 267 (2020) (1987), Article 115437
A. Bansal, J. Henao-Mejia, R.A. Simmons
Immune System: An Emerging Player in Mediating Effects of Endocrine Disruptors on Metabolic Health
Endocrinology, 159 (1) (2018), pp. 32-45 View PDF
CrossRefView Record in ScopusGoogle Scholar[148]
P.A. Thompson, M. Khatami, C.J. Baglole, J. Sun, S.A. Harris, E.Y. Moon, F. Al-Mulla, R. Al-Temaimi, D.G. Brown, A. Colacci, C. Mondello, J. Raju, E.P. Ryan, J. Woodrick, A.I. Scovassi, N. Singh, M. Vaccari, R. Roy, S. Forte, L. Memeo, H.K. Salem, A. Amedei, R.A. Hamid, L. Lowe, T. Guarnieri, W.H. Bisson
Environmental immune disruptors, inflammation and cancer risk
Carcinogenesis, 36 (Suppl 1) (2015), pp. S232-S253 View PDF
CrossRefView Record in ScopusGoogle Scholar[149]
M.C. Petriello, J.A. Brandon, J. Hoffman, C. Wang, H. Tripathi, A. Abdel-Latif, X. Ye, X. Li, L. Yang, E. Lee, S. Soman, J. Barney, B. Wahlang, B. Hennig, A.J. Morris
Dioxin-like PCB 126 Increases Systemic Inflammation and Accelerates Atherosclerosis in Lean LDL Receptor-Deficient Mice
Toxicological sciences : an official journal of the Society of Toxicology, 162 (2) (2018), pp. 548-558 View PDF
CrossRefView Record in ScopusGoogle Scholar[150]
S.M. Snedeker, A.G. Hay
Do interactions between gut ecology and environmental chemicals contribute to obesity and diabetes?
Environ. Health Perspect., 120 (3) (2012), pp. 332-339 View PDF
CrossRefView Record in ScopusGoogle Scholar[151]
D.A. Winer, S. Winer, H.J. Dranse, T.K. Lam
Immunologic impact of the intestine in metabolic disease
J Clin Invest, 127 (1) (2017), pp. 33-42
View Record in ScopusGoogle Scholar[152]
E. Čolak, D. Pap
The role of oxidative stress in the development of obesity and obesity-related metabolic disorders
Journal of Medical Biochemistry, 40 (1) (2021), pp. 1-9 View PDF
CrossRefView Record in ScopusGoogle Scholar[153]
X. Li, P. Fang, J. Mai, E.T. Choi, H. Wang, X.-F. Yang
Targeting mitochondrial reactive oxygen species as novel therapy for inflammatory diseases and cancers
Journal of Hematology & Oncology, 6 (1) (2013), p. 19
S. Javadov, A.V. Kozlov, A.K.S. Camara
Mitochondria in Health and Diseases
Cells, 9 (5) (2020), p. 1177 View PDF
CrossRefView Record in ScopusGoogle Scholar[155]
L. Marroqui, E. Tuduri, P. Alonso-Magdalena, I. Quesada, A. Nadal, R.S. Dos Santos
Mitochondria as target of endocrine-disrupting chemicals: implications for type 2 diabetes
The Journal of endocrinology, 239 (2) (2018), pp. R27-R45 View PDF
CrossRefView Record in ScopusGoogle Scholar[156]
S. Bucher, D. Le Guillou, J. Allard, G. Pinon, K. Begriche, A. Tête, O. Sergent, D. Lagadic-Gossmann, B. Fromenty
Possible Involvement of Mitochondrial Dysfunction and Oxidative Stress in a Cellular Model of NAFLD Progression Induced by Benzo[a]pyrene/Ethanol CoExposure
Oxid. Med. Cell. Longevity, 2018 (2018), p. 4396403
View Record in ScopusGoogle Scholar[157]
Z. Zhou, J.M. Goodrich, R.S. Strakovsky
Mitochondrial Epigenetics and Environmental Health: Making a Case for Endocrine Disrupting Chemicals
Toxicol. Sci., 178 (1) (2020), pp. 16-25 View PDF
CrossRefView Record in ScopusGoogle Scholar[158]
M.A. Suter, A. Chen, M.S. Burdine, M. Choudhury, R.A. Harris, R.H. Lane, J.E. Friedman, K.L. Grove, A.J. Tackett, K.M. Aagaard
A maternal high-fat diet modulates fetal SIRT1 histone and protein deacetylase activity in nonhuman primates
FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 26 (12) (2012), pp. 5106-5114 View PDF
CrossRefView Record in ScopusGoogle Scholar[159]
E.M. Kratz, K. Sołkiewicz, A. Kubis-Kubiak, A. Piwowar
Sirtuins as Important Factors in Pathological States and the Role of Their Molecular Activity Modulators
Int. J. Mol. Sci., 22 (2) (2021), p. 630 View PDF
S. Imai, C.M. Armstrong, M. Kaeberlein, L. Guarente
Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase
Nature, 403 (6771) (2000), pp. 795-800
View Record in ScopusGoogle Scholar[161]
A. Chalkiadaki, L. Guarente
Sirtuins mediate mammalian metabolic responses to nutrient availability
Nat. Rev. Endocrinol., 8 (5) (2012), pp. 287-296 View PDF
CrossRefView Record in ScopusGoogle Scholar[162]
A. Kurylowicz
In Search of New Therapeutic Targets in Obesity Treatment: Sirtuins
Int. J. Mol. Sci., 17 (4) (2016), p. 572 View PDF
CrossRefView Record in ScopusGoogle Scholar[163]
A.A. Kendrick, M. Choudhury, S.M. Rahman, C.E. McCurdy, M. Friederich, J.L. Van Hove, P.A. Watson, N. Birdsey, J. Bao, D. Gius, M.N. Sack, E. Jing, C.R. Kahn, J.E. Friedman, K.R. Jonscher
Fatty liver is associated with reduced SIRT3 activity and mitochondrial protein hyperacetylation
Biochem. J., 433 (3) (2011), pp. 505-514
View Record in ScopusGoogle Scholar[164]
J. Zhang, M. Choudhury
The plasticizer BBP selectively inhibits epigenetic regulator sirtuin during differentiation of C3H10T1/2 stem cell line
Toxicol. In Vitro, 39 (2017), pp. 75-83
ArticleDownload PDFCrossRefGoogle Scholar[165]
J. Zhang, H.I. Ali, Y.S. Bedi, M. Choudhury
The plasticizer BBP selectively inhibits epigenetic regulator sirtuins
Toxicology, 338 (2015), pp. 130-141
ArticleDownload PDFView Record in ScopusGoogle Scholar[166]
W. Adriani, D. Della Seta, F. Dessi-Fulgheri, F. Farabollini, G. Laviola
Altered profiles of spontaneous novelty seeking, impulsive behavior, and response to D-amphetamine in rats perinatally exposed to Bisphenol A
Environ. Health Perspect., 111 (4) (2003), pp. 395-401
View Record in ScopusGoogle Scholar[167]
A. Rodríguez-Carrillo, V. Mustieles, R. Pérez-Lobato, J.M. Molina-Molina, I. Reina-Pérez, F. Vela-Soria, S. Rubio, N. Olea, M.F. Fernández
Bisphenol A and cognitive function in school-age boys: Is BPA predominantly related to behavior?
NeuroToxicology, 74 (March) (2019), pp. 162-171
ArticleDownload PDFView Record in ScopusGoogle Scholar[168]
Q. Leyrolle, R. Cserjesi, M.D.G.H. Mulders, G. Zamariola, S. Hiel, M.A. Gianfrancesco, J. Rodriguez, D. Portheault, C. Amadieu, S. Leclercq, L.B. Bindels, A.M. Neyrinck, P.D. Cani, O. Karkkainen, K. Haninheva, N. Lanthier, P. Trefois, N. Paquot, M. Cnop, J.P. Thissen, O. Klein, O. Luminet, N.M. Delzenne
Specific gut microbial, biological, and psychiatric profiling related to binge eating disorders: A cross-sectional study in obese patients
Clinical Nutrition, 85 (2020), pp. 162-169
View Record in ScopusGoogle Scholar[169]
A.A. Krentzel, J.A. Willett, A.G. Johnson, J. Meitzen
Estrogen receptor alpha, G-protein coupled estrogen receptor 1, and aromatase: Developmental, sex, and region-specific differences across the rat caudate–putamen, nucleus accumbens core and shell
Journal of Comparative Neurology, 529 (4) (2021), pp. 786-801 View PDF
CrossRefView Record in ScopusGoogle Scholar[170]
L.M. Wise, D. Hernández-Saavedra, S.M. Boas, Y.X. Pan, J.M. Juraska
Perinatal High-Fat Diet and Bisphenol A: Effects on Behavior and Gene Expression in the Medial Prefrontal Cortex
Dev. Neurosci., 41 (1–2) (2019), pp. 1-16 View PDF
CrossRefView Record in ScopusGoogle Scholar[171]N. Fowler, N. Russell, C.L. Sisk, A.W. Johnson, K.L. Klump, The Binge Eating-Prone/Binge Eating-Resistant Animal Model: A Valuable Tool for Examining Neurobiological Underpinnings of Binge Eating, in: N.M. Avena, N.M. Avena (Eds.), Animal Models of Eating Disorders, New York, NY, 2021, pp. 7-24.
M.D. Griffin, S.R. Pereira, M.K. DeBari, R.D. Abbott
Mechanisms of action, chemical characteristics, and model systems of obesogens
BMC Biomed Eng, 2 (2020), p. 6
View Record in ScopusGoogle Scholar[173]C.M. Ribeiro, B.T.S. Beserra, N.G. Silva, C.L. Lima, P.R.S. Rocha, M.S. Coelho, F.d.A.R. Neves, A.A. Amato, Exposure to endocrine-disrupting chemicals and anthropometric measures of obesity: a systematic review and meta-analysis, BMJ Open 10(6) (2020) e033509.
Google Scholar[174]W. Perng, A. Cantoral, D.C. Soria-Contreras, L. Betanzos-Robledo, K. Kordas, Y. Liu, A.M. Mora, C. Corvalan, A. Pereira, M.A. Cardoso, J.E. Chavarro, C.V. Breton, J.D. Meeker, K.G. Harley, B. Eskenazi, K.E. Peterson, M.M. Tellez-Rojo, Exposure to obesogenic endocrine disrupting chemicals and obesity among youth of Latino or Hispanic origin in the United States and Latin America: A lifecourse perspective, Obes Rev 22 Suppl 3(Suppl 3) (2021) e13245.
N.E. De Long, R.A. Stepita, V.H. Taylor, A.C. Holloway
Major depressive disorder and diabetes: does serotonin bridge the gap?
Curr. Diabetes Rev., 11 (2) (2015), pp. 71-78
View Record in ScopusGoogle Scholar[176]
A.A. Verhaegen, L.F. Van Gaal
Drug-induced obesity and its metabolic consequences: a review with a focus on mechanisms and possible therapeutic options
J. Endocrinol. Invest. (2017)
M. Solmi, M. Fornaro, E.G. Ostinelli, C. Zangani, G. Croatto, F. Monaco, D. Krinitski, P. Fusar-Poli, C.U. Correll
Safety of 80 antidepressants, antipsychotics, anti-attention-deficit/hyperactivity medications and mood stabilizers in children and adolescents with psychiatric disorders: a large scale systematic meta-review of 78 adverse effects
World Psychiatry, 19 (2) (2020), pp. 214-232 View PDF
CrossRefView Record in ScopusGoogle Scholar[178]
H. Himmerich, J. Minkwitz, K.C. Kirkby
Weight Gain and Metabolic Changes During Treatment with Antipsychotics and Antidepressants
Endocr. Metab. Immune Disord. Drug Targets, 15 (4) (2015), pp. 252-260 View PDF
CrossRefView Record in ScopusGoogle Scholar[179]
M. De Hert, M. Dobbelaere, E.M. Sheridan, D. Cohen, C.U. Correll
Metabolic and endocrine adverse effects of second-generation antipsychotics in children and adolescents: A systematic review of randomized, placebo controlled trials and guidelines for clinical practice
European psychiatry : the journal of the Association of European Psychiatrists, 26 (3) (2011), pp. 144-158
ArticleDownload PDFCrossRefGoogle Scholar[180]
J.M. Martínez-Ortega, S. Funes-Godoy, F. Díaz-Atienza, L. Gutiérrez-Rojas, L. Pérez-Costillas, M. Gurpegui
Weight gain and increase of body mass index among children and adolescents treated with antipsychotics: a critical review
Eur. Child Adolesc. Psychiatry, 22 (8) (2013), pp. 457-479 View PDF
CrossRefView Record in ScopusGoogle Scholar[181]
S.J. Pan, Y.L. Tan, S.W. Yao, Y. Xin, X. Yang, J. Liu, J. Xiong
Fluoxetine induces lipid metabolism abnormalities by acting on the liver in patients and mice with depression
Acta Pharmacol. Sin., 39 (9) (2018), pp. 1463-1472 View PDF
CrossRefView Record in ScopusGoogle Scholar[182]
M. Flechtner-Mors, C.P. Jenkinson, A. Alt, G. Adler, H.H. Ditschuneit
Metabolism in adipose tissue in response to citalopram and trimipramine treatment–an in situ microdialysis study
J. Psychiatr. Res., 42 (7) (2008), pp. 578-586
ArticleDownload PDFView Record in ScopusGoogle Scholar[183]
V. Medici, S.A. McClave, K.R. Miller
Common Medications Which Lead to Unintended Alterations in Weight Gain or Organ Lipotoxicity
Curr. Gastroenterol. Rep., 18 (1) (2016), p. 2
A.J.S. Coats
Beta-blockers, hypertension, and weight gain: the farmer, the chicken, and the egg
Hong Kong Med J, 26 (1) (2020), pp. 6-7
View Record in ScopusGoogle Scholar[185]
M. Christ-Crain, B. Kola, F. Lolli, C. Fekete, D. Seboek, G. Wittmann, D. Feltrin, S.C. Igreja, S. Ajodha, J. Harvey-White, G. Kunos, B. Muller, F. Pralong, G. Aubert, G. Arnaldi, G. Giacchetti, M. Boscaro, A.B. Grossman, M. Korbonits
AMP-activated protein kinase mediates glucocorticoid-induced metabolic changes: a novel mechanism in Cushing’s syndrome
FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 22 (6) (2008), pp. 1672-1683 View PDF
CrossRefView Record in ScopusGoogle Scholar[186]
R.R. Newbold, E. Padilla-Banks, W.N. Jefferson
Environmental estrogens and obesity
Mol. Cell. Endocrinol., 304 (1–2) (2009), pp. 84-89
ArticleDownload PDFView Record in ScopusGoogle Scholar[187]
J.P. Mackenbach, R.A. Damhuis, J.V. Been
The effects of smoking on health: growth of knowledge reveals even grimmer picture
Ned. Tijdschr. Geneeskd., 160 (2017), p. D869
View Record in ScopusGoogle Scholar[188]
A.J. Green, C. Hoyo, C.J. Mattingly, Y. Luo, J.-Y. Tzeng, S.K. Murphy, D.B. Buchwalter, A. Planchart
Cadmium exposure increases the risk of juvenile obesity: a human and zebrafish comparative study
International Journal of Obesity, 42 (7) (2018), pp. 1285-1295 View PDF
CrossRefView Record in ScopusGoogle Scholar[189]J.-Y. Kim, S.-J. Kim, M.A. Bae, J.-R. Kim, K.-H. Cho, Cadmium exposure exacerbates severe hyperlipidemia and fatty liver changes in zebrafish via impairment of high-density lipoproteins functionality, Toxicology in Vitro 47 (2018) 249-258 %U https://linkinghub.elsevier.com/retrieve/pii/S0887233317303582.
S. Bucher, A. Tête, N. Podechard, M. Liamin, D. Le Guillou, M. Chevanne, C. Coulouarn, M. Imran, I. Gallais, M. Fernier, Q. Hamdaoui, M.-A. Robin, O. Sergent, B. Fromenty, D. Lagadic-Gossmann
Co-exposure to benzo[a]pyrene and ethanol induces a pathological progression of liver steatosis in vitro and in vivo
Sci. Rep., 8 (1) (2018), p. 5963
View Record in ScopusGoogle Scholar[191]
M. Behl, D. Rao, K. Aagaard, T.L. Davidson, E.D. Levin, T.A. Slotkin, S. Srinivasan, D. Wallinga, M.F. White, V.R. Walker, K.A. Thayer, A.C. Holloway
Evaluation of the association between maternal smoking, childhood obesity, and metabolic disorders: a national toxicology program workshop review
Environ. Health Perspect., 121 (2) (2013), pp. 170-180 View PDF
CrossRefView Record in ScopusGoogle Scholar[192]
A.P. Sinha-Hikim, I. Sinha-Hikim, T.C. Friedman
Connection of Nicotine to Diet-Induced Obesity and Non-Alcoholic Fatty Liver Disease: Cellular and Mechanistic Insights
Front. Endocrinol., 8 (2017)
C.R. Pinheiro, E.G. Moura, A.C. Manhães, M.C. Fraga, S. Claudio-Neto, V. Younes-Rapozo, A.P. Santos-Silva, B.M. Lotufo, E. Oliveira, P.C. Lisboa
Maternal nicotine exposure during lactation alters food preference, anxiety-like behavior and the brain dopaminergic reward system in the adult rat offspring
Physiol. Behav., 149 (2015), pp. 131-141
ArticleDownload PDFView Record in ScopusGoogle Scholar[194]
K.W. Lee, M. Abrahamowicz, G.T. Leonard, L. Richer, M. Perron, S. Veillette, E. Reischl, L. Bouchard, D. Gaudet, T. Paus, Z. Pausova
Prenatal exposure to cigarette smoke interacts with OPRM1 to modulate dietary preference for fat
J. Psychiatry Neurosci., 40 (1) (2015), pp. 38-45
H.J. Chen, G.L. Li, W.X. Zhang, J. Fan, L. Hu, L. Zhang, J. Zhang, Y.E. Yan
Maternal nicotine exposure during pregnancy and lactation induces brown adipose tissue whitening in female offspring
Toxicol. Appl. Pharmacol., 409 (2020), Article 115298
ArticleDownload PDFView Record in ScopusGoogle Scholar[196]
L.Z. Huang, U.H. Winzer-Serhan
Nicotine regulates mRNA expression of feeding peptides in the arcuate nucleus in neonatal rat pups
Dev Neurobiol, 67 (3) (2007), pp. 363-377 View PDF
CrossRefView Record in ScopusGoogle Scholar[197]
V. Younes-Rapozo, E.G. Moura, A.C. Manhães, C.R. Pinheiro, A.P. Santos-Silva, E. de Oliveira, P.C. Lisboa
Maternal nicotine exposure during lactation alters hypothalamic neuropeptides expression in the adult rat progeny
Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 58 (2013), pp. 158-168
ArticleDownload PDFView Record in ScopusGoogle Scholar[198]
E. Somm, V.M. Schwitzgebel, D.M. Vauthay, E.J. Camm, C.Y. Chen, J.P. Giacobino, S.V. Sizonenko, M.L. Aubert, P.S. Huppi
Prenatal nicotine exposure alters early pancreatic islet and adipose tissue development with consequences on the control of body weight and glucose metabolism later in life
Endocrinology, 149 (12) (2008), pp. 6289-6299 View PDF
CrossRefView Record in ScopusGoogle Scholar[199]
J. Fan, J. Ping, W.X. Zhang, Y.S. Rao, H.X. Liu, J. Zhang, Y.E. Yan
Prenatal and lactation nicotine exposure affects morphology and function of brown adipose tissue in male rat offspring
Ultrastruct. Pathol., 40 (5) (2016), pp. 288-295 View PDF
CrossRefView Record in ScopusGoogle Scholar[200]
T.C. Peixoto, E.G. Moura, P.N. Soares, I.M. Bertasso, C.B. Pietrobon, F.A.H. Caramez, R.A. Miranda, E. Oliveira, A.C. Manhães, P.C. Lisboa
Nicotine exposure during breastfeeding reduces sympathetic activity in brown adipose tissue and increases in white adipose tissue in adult rats: Sex-related differences
Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 140 (2020), Article 111328
ArticleDownload PDFView Record in ScopusGoogle Scholar[201]
N. Ma, C.J. Nicholson, M. Wong, A.C. Holloway, D.B. Hardy
Fetal and neonatal exposure to nicotine leads to augmented hepatic and circulating triglycerides in adult male offspring due to increased expression of fatty acid synthase
Toxicol. Appl. Pharmacol., 275 (1) (2014), pp. 1-11
ArticleDownload PDFGoogle Scholar[202]
M. Blüher
Adipose tissue dysfunction contributes to obesity related metabolic diseases, Best practice & research
Clinical endocrinology & metabolism, 27 (2) (2013), pp. 163-177
ArticleDownload PDFView Record in ScopusGoogle Scholar[203]
J.D. Cameron, É. Doucet, K.B. Adamo, M. Walker, A. Tirelli, J.D. Barnes, K. Hafizi, M. Murray, G.S. Goldfield
Effects of prenatal exposure to cigarettes on anthropometrics, energy intake, energy expenditure, and screen time in children
Physiol. Behav., 194 (2018), pp. 394-400
ArticleDownload PDFView Record in ScopusGoogle Scholar[204]
G. Moschonis, A.C. Kaliora, K. Karatzi, A. Michaletos, C.P. Lambrinou, A.K. Karachaliou, G.P. Chrousos, C. Lionis, Y. Manios
Perinatal, sociodemographic and lifestyle correlates of increased total and visceral fat mass levels in schoolchildren in Greece: the Healthy Growth Study
Public Health Nutr., 20 (4) (2017), pp. 660-670
View Record in ScopusGoogle Scholar[205]E. Oken, E.B. Levitan, M.W. Gillman, Maternal smoking during pregnancy and child overweight: systematic review and meta-analysis, International journal of obesity (2005) 32(2) (2008) 201-10.
S. Rayfield, E. Plugge
Systematic review and meta-analysis of the association between maternal smoking in pregnancy and childhood overweight and obesity
J. Epidemiol. Community Health, 71 (2) (2017), pp. 162-173 View PDF
CrossRefView Record in ScopusGoogle Scholar[207]
E.M. Philips, S. Santos, L. Trasande, J.J. Aurrekoetxea, H. Barros, A. von Berg, A. Bergström, P.K. Bird, S. Brescianini, C. Ní Chaoimh, M.A. Charles, L. Chatzi, C. Chevrier, G.P. Chrousos, N. Costet, R. Criswell, S. Crozier, M. Eggesbø, M.P. Fantini, S. Farchi, F. Forastiere, M.M.H.J. van Gelder, V. Georgiu, K.M. Godfrey, D. Gori, W. Hanke, B. Heude, D. Hryhorczuk, C. Iñiguez, H. Inskip, A.M. Karvonen, L.C. Kenny, I. Kull, D.A. Lawlor, I. Lehmann, P. Magnus, Y. Manios, E. Melén, M. Mommers, C.S. Morgen, G. Moschonis, D. Murray, E.A. Nohr, A.M. Nybo Andersen, E. Oken, A.J.J.M. Oostvogels, E. Papadopoulou, J. Pekkanen, C. Pizzi, K. Polanska, D. Porta, L. Richiardi, S.L. Rifas-Shiman, N. Roeleveld, F. Rusconi, A.C. Santos, T.I.A. Sørensen, M. Standl, C. Stoltenberg, J. Sunyer, E. Thiering, C. Thijs, M. Torrent, T.G.M. Vrijkotte, J. Wright, O. Zvinchuk, R. Gaillard, V.W.V. Jaddoe
Changes in parental smoking during pregnancy and risks of adverse birth outcomes and childhood overweight in Europe and North America: An individual participant data meta-analysis of 229,000 singleton births
PLoS Med., 17 (8) (2020), Article e1003182 View PDF
CrossRefView Record in ScopusGoogle Scholar[208]
M. Vrijheid, S. Fossati, L. Maitre, S. Marquez, T. Roumeliotaki, L. Agier, S. Andrusaityte, S. Cadiou, M. Casas, M. de Castro, A. Dedele, D. Donaire-Gonzalez, R. Grazuleviciene, L.S. Haug, R. McEachan, H.M. Meltzer, E. Papadopouplou, O. Robinson, A.K. Sakhi, V. Siroux, J. Sunyer, P.E. Schwarze, I. Tamayo-Uria, J. Urquiza, M. Vafeiadi, A. Valentin, C. Warembourg, J. Wright, M.J. Nieuwenhuijsen, C. Thomsen, X. Basagana, R. Slama, L. Chatzi
Early-Life Environmental Exposures and Childhood Obesity: An Exposome-Wide Approach
Environ. Health Perspect., 128 (6) (2020), p. 67009
Google Scholar[209]L. Albers, C. Sobotzki, O. Kuß, T. Ajslev, R.F. Batista, H. Bettiol, B. Brabin, S.L. Buka, V.C. Cardoso, V.L. Clifton, G. Devereux, S.E. Gilman, L.E. Grzeskowiak, J. Heinrich, S. Hummel, G.W. Jacobsen, G. Jones, G. Koshy, C.S. Morgen, E. Oken, T. Paus, Z. Pausova, S.L. Rifas-Shiman, A.J. Sharma, A.A. da Silva, T.I. Sørensen, E. Thiering, S. Turner, T. Vik, R. von Kries, Maternal smoking during pregnancy and offspring overweight: is there a dose-response relationship? An individual patient data meta-analysis, International journal of obesity (2005) 42(7) (2018) 1249-1264.
H.J. Chen, G.L. Li, A. Sun, D.S. Peng, W.X. Zhang, Y.E. Yan
Age Differences in the Relationship between Secondhand Smoke Exposure and Risk of Metabolic Syndrome: A Meta-Analysis
Int. J. Environ. Res. Public Health, 16 (8) (2019)
N.B. Oldereid, U.B. Wennerholm, A. Pinborg, A. Loft, H. Laivuori, M. Petzold, L.B. Romundstad, V. Söderström-Anttila, C. Bergh
The effect of paternal factors on perinatal and paediatric outcomes: a systematic review and meta-analysis
Human reproduction update, 24 (3) (2018), pp. 320-389 View PDF
CrossRefView Record in ScopusGoogle Scholar[212]
S.R. Nadhiroh, K. Djokosujono, D.M. Utari
The association between secondhand smoke exposure and growth outcomes of children: A systematic literature review
Tob Induc Dis, 18 (2020), p. 12
M. Chaiton, A. Holloway
Population attributable risk of smoking during pregnancy on obesity in offspring
Can. J. Public Health, 107 (3) (2016), Article e336 View PDF
CrossRefView Record in ScopusGoogle Scholar[214]H.R. Harris, W.C. Willett, K.B. Michels, Parental smoking during pregnancy and risk of overweight and obesity in the daughter, International journal of obesity (2005) 37(10) (2013) 1356-63.
M. Pérez-Bermejo, I. Mas-Pérez, M.T. Murillo-Llorente
The Role of the Bisphenol A in Diabetes and Obesity
Biomedicines, 9 (6) (2021)
W. Qiu, S. Liu, F. Yang, P. Dong, M. Yang, M. Wong, C. Zheng
Metabolism disruption analysis of zebrafish larvae in response to BPA and BPA analogs based on RNA-Seq technique
Ecotoxicol. Environ. Saf., 174 (2019), pp. 181-188
ArticleDownload PDFView Record in ScopusGoogle Scholar[217]
Z. Ji, J. Liu, S. Sakkiah, W. Guo, H. Hong
BPA Replacement Compounds: Current Status and Perspectives
ACS Sustainable Chem. Eng., 9 (6) (2021), pp. 2433-2446 View PDF
CrossRefView Record in ScopusGoogle Scholar[218]
R. Mesnage, A. Phedonos, M. Arno, S. Balu, J.C. Corton, M.N. Antoniou
Editor’s Highlight: Transcriptome Profiling Reveals Bisphenol A Alternatives Activate Estrogen Receptor Alpha in Human Breast Cancer Cells
Toxicological sciences : an official journal of the Society of Toxicology, 158 (2) (2017), pp. 431-443 View PDF
CrossRefView Record in ScopusGoogle Scholar[219]
E. Ougier, F. Zeman, J.P. Antignac, C. Rousselle, R. Lange, M. Kolossa-Gehring, P. Apel
Human biomonitoring initiative (HBM4EU): Human biomonitoring guidance values (HBM-GVs) derived for bisphenol A
Environ. Int., 154 (2021), Article 106563
ArticleDownload PDFView Record in ScopusGoogle Scholar[220]
R. Bousoumah, V. Leso, I. Iavicoli, P. Huuskonen, S. Viegas, S.P. Porras, T. Santonen, N. Frery, A. Robert, S. Ndaw
Biomonitoring of occupational exposure to bisphenol A, bisphenol S and bisphenol F: A systematic review
The Science of the total environment, 783 (2021), Article 146905
ArticleDownload PDFView Record in ScopusGoogle Scholar[221]
C.J. Hines, M.V. Jackson, J.A. Deddens, J.C. Clark, X. Ye, A.L. Christianson, J.W. Meadows, A.M. Calafat
Urinary Bisphenol A (BPA) Concentrations among Workers in Industries that Manufacture and Use BPA in the USA
Ann Work Expo Health, 61 (2) (2017), pp. 164-182 View PDF
CrossRefView Record in ScopusGoogle Scholar[222]
M. Longo, F. Zatterale, J. Naderi, C. Nigro, F. Oriente, P. Formisano, C. Miele, F. Beguinot
Low-dose Bisphenol-A Promotes Epigenetic Changes at Ppargamma Promoter in Adipose Precursor Cells
Nutrients, 12 (11) (2020)
L. Huc, A. Lemarié, F. Guéraud, C. Héliès-Toussaint
Low concentrations of bisphenol A induce lipid accumulation mediated by the production of reactive oxygen species in the mitochondria of HepG2 cells
Toxicol. In Vitro, 26 (5) (2012), pp. 709-717
ArticleDownload PDFView Record in ScopusGoogle Scholar[224]
L. Peyre, P. Rouimi, G. de Sousa, C. Héliès-Toussaint, B. Carré, S. Barcellini, M.-C. Chagnon, R. Rahmani
Comparative study of bisphenol A and its analogue bisphenol S on human hepatic cells: A focus on their potential involvement in nonalcoholic fatty liver disease
Food Chem. Toxicol., 70 (2014), pp. 9-18
ArticleDownload PDFView Record in ScopusGoogle Scholar[225]
J.G. Boucher, M. Husain, A. Rowan-Carroll, A. Williams, C.L. Yauk, E. Atlas
Identification of mechanisms of action of bisphenol a-induced human preadipocyte differentiation by transcriptional profiling
Obesity (Silver Spring), 22 (11) (2014), pp. 2333-2343 View PDF
CrossRefView Record in ScopusGoogle Scholar[226]
M.A. Martinez, J. Blanco, J. Rovira, V. Kumar, J.L. Domingo, M. Schuhmacher
Bisphenol A analogues (BPS and BPF) present a greater obesogenic capacity in 3T3-L1 cell line
Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 140 (2020), Article 111298
ArticleDownload PDFView Record in ScopusGoogle Scholar[227]
D.G. Skledar, A. Carino, J. Trontelj, J. Troberg, E. Distrutti, S. Marchiano, T. Tomasic, A. Zega, M. Finel, S. Fiorucci, L.P. Masic
Endocrine activities and adipogenic effects of bisphenol AF and its main metabolite
Chemosphere, 215 (2019), pp. 870-880
ArticleDownload PDFView Record in ScopusGoogle Scholar[228]
A. Riu, M. Grimaldi, A. le Maire, G. Bey, K. Phillips, A. Boulahtouf, E. Perdu, D. Zalko, W. Bourguet, P. Balaguer
Peroxisome proliferator-activated receptor gamma is a target for halogenated analogs of bisphenol A
Environ. Health Perspect., 119 (9) (2011), pp. 1227-1232 View PDF
CrossRefView Record in ScopusGoogle Scholar[229]
F. Ariemma, V. D’Esposito, D. Liguoro, F. Oriente, S. Cabaro, A. Liotti, I. Cimmino, M. Longo, F. Beguinot, P. Formisano, R. Valentino
Low-Dose bisphenol-A impairs adipogenesis and generates dysfunctional 3T3-L1 adipocytes
PLoS ONE, 11 (3) (2016), pp. 1-16
View Record in ScopusGoogle Scholar[230]
A. Martella, C. Silvestri, F. Maradonna, G. Gioacchini, M. Allarà, G. Radaelli, D.R. Overby, V. Di Marzo, O. Carnevali
Bisphenol A Induces Fatty Liver by an Endocannabinoid-Mediated Positive Feedback Loop
Endocrinology, 157 (5) (2016), pp. 1751-1763 View PDF
CrossRefView Record in ScopusGoogle Scholar[231]L. Renaud, W.A.d. Silveira, E.S. Hazard, J. Simpson, S. Falcinelli, D. Chung, O. Carnevali, G. Hardiman, The Plasticizer Bisphenol A Perturbs the Hepatic Epigenome: A Systems Level Analysis of the miRNome, Genes 8(10) (2017).
S. Santangeli, V. Notarstefano, F. Maradonna, E. Giorgini, G. Gioacchini, I. Forner-Piquer, H.R. Habibi, O. Carnevali
Effects of diethylene glycol dibenzoate and Bisphenol A on the lipid metabolism of Danio rerio
Sci. Total Environ., 636 (2018), pp. 641-655
ArticleDownload PDFView Record in ScopusGoogle Scholar[233]
W. Wang, X. Zhang, Z. Wang, J. Qin, W. Wang, H. Tian, S. Ru
Bisphenol S induces obesogenic effects through deregulating lipid metabolism in zebrafish (Danio rerio) larvae
Chemosphere, 199 (2018), pp. 286-296
ArticleDownload PDFCrossRefGoogle Scholar[234]
A. Riu, C.W. McCollum, C.L. Pinto, M. Grimaldi, A. Hillenweck, E. Perdu, D. Zalko, L. Bernard, V. Laudet, P. Balaguer, M. Bondesson, J.-A. Gustafsson
Halogenated Bisphenol-A Analogs Act as Obesogens in Zebrafish Larvae (Danio rerio)
Toxicol. Sci. (2014)
S. Tian, S. Yan, Z. Meng, S. Huang, W. Sun, M. Jia, M. Teng, Z. Zhou, W. Zhu
New insights into bisphenols induced obesity in zebrafish (Danio rerio): Activation of cannabinoid receptor CB1
J. Hazard. Mater., 418 (2021), Article 126100
ArticleDownload PDFView Record in ScopusGoogle Scholar[236]
J.R. Rochester, A.L. Bolden
Bisphenol S and F: A Systematic Review and Comparison of the Hormonal Activity of Bisphenol A Substitutes
Environ. Health Perspect., 123 (7) (2015), pp. 643-650 View PDF
CrossRefView Record in ScopusGoogle Scholar[237]
P. Alonso-Magdalena, M. Garcia-Arevalo, I. Quesada, A. Nadal
Bisphenol-A treatment during pregnancy in mice: a new window of susceptibility for the development of diabetes in mothers later in life
Endocrinology, 156 (5) (2015), pp. 1659-1670 View PDF
CrossRefView Record in ScopusGoogle Scholar[238]
P.N.H. Wassenaar, L. Trasande, J. Legler
Systematic Review and Meta-Analysis of Early-Life Exposure to Bisphenol A and Obesity-Related Outcomes in Rodents
Environ. Health Perspect., 125 (10) (2017), Article 106001 View PDF
CrossRefView Record in ScopusGoogle Scholar[239]
B.M. Angle, R.P. Do, D. Ponzi, R.W. Stahlhut, B.E. Drury, S.C. Nagel, W.V. Welshons, C.L. Besch-Williford, P. Palanza, S. Parmigiani, F.S. vom Saal, J.A. Taylor
Metabolic disruption in male mice due to fetal exposure to low but not high doses of bisphenol A (BPA): Evidence for effects on body weight, food intake, adipocytes, leptin, adiponectin, insulin and glucose regulation
Reprod. Toxicol., 42 (2013), pp. 256-268
ArticleDownload PDFView Record in ScopusGoogle Scholar[240]
B.S. Rubin, M. Paranjpe, T. DaFonte, C. Schaeberle, A.M. Soto, M. Obin, A.S. Greenberg
Perinatal BPA exposure alters body weight and composition in a dose specific and sex specific manner: The addition of peripubertal exposure exacerbates adverse effects in female mice
Reprod. Toxicol., 68 (2017), pp. 130-144
ArticleDownload PDFView Record in ScopusGoogle Scholar[241]
E. Somm, V.M. Schwitzgebel, A. Toulotte, C.R. Cederroth, C. Combescure, S. Nef, M.L. Aubert, P.S. Huppi
Perinatal exposure to bisphenol a alters early adipogenesis in the rat
Environ. Health Perspect., 117 (10) (2009), pp. 1549-1555 View PDF
CrossRefView Record in ScopusGoogle Scholar[242]
B.S. Rubin, A.M. Soto
Bisphenol A: Perinatal exposure and body weight
Mol. Cell. Endocrinol., 304 (1–2) (2009), pp. 55-62
ArticleDownload PDFView Record in ScopusGoogle Scholar[243]
M. Desai, M.G. Ferrini, G. Han, J.K. Jellyman, M.G. Ross
In vivo maternal and in vitro BPA exposure effects on hypothalamic neurogenesis and appetite regulators
Environ. Res., 164 (2018), pp. 45-52
ArticleDownload PDFView Record in ScopusGoogle Scholar[244]
H. MacKay, Z.R. Patterson, A. Abizaid
Perinatal Exposure to Low-Dose Bisphenol-A Disrupts the Structural and Functional Development of the Hypothalamic Feeding Circuitry
Endocrinology, 158 (4) (2017), pp. 768-777 View PDF
CrossRefView Record in ScopusGoogle Scholar[245]
C. Stoker, M.F. Andreoli, L. Kass, V.L. Bosquiazzo, M.F. Rossetti, G. Canesini, E.H. Luque, J.G. Ramos
Perinatal exposure to bisphenol A (BPA) impairs neuroendocrine mechanisms regulating food intake and kisspetin system in adult male rats
Evidences of metabolic disruptor hypothesis, Mol Cell Endocrinol, 499 (2020), Article 110614
ArticleDownload PDFView Record in ScopusGoogle Scholar[246]
M. Yang, M. Chen, J. Wang, M. Xu, J. Sun, L. Ding, X. Lv, Q. Ma, Y. Bi, R. Liu, J. Hong, G. Ning
Bisphenol A promotes adiposity and inflammation in a nonmonotonic dose-response way in five-week old male and female C57BL/6J mice fed a low-calorie diet
Endocrinology (2016), p. en20151926
L. Ivry Del Moral, L. Le Corre, H. Poirier, I. Niot, T. Truntzer, J.F. Merlin, P. Rouimi, P. Besnard, R. Rahmani, M.C. Chagnon
Obesogen effects after perinatal exposure of 4,4′-sulfonyldiphenol (Bisphenol S) in C57BL/6 mice
Toxicology, 357–358 (2016), pp. 11-20
ArticleDownload PDFView Record in ScopusGoogle Scholar[248]
C.M. Ribeiro, B.T.S. Beserra, N.G. Silva, C.L. Lima, P.R.S. Rocha, M.S. Coelho, F.A.R. Neves, A.A. Amato
Exposure to endocrine-disrupting chemicals and anthropometric measures of obesity: a systematic review and meta-analysis
BMJ Open, 10 (6) (2020), Article e033509 View PDF
CrossRefView Record in ScopusGoogle Scholar[249]Y. Song, R. Hauser, F.B. Hu, A.A. Franke, S. Liu, Q. Sun, Urinary concentrations of bisphenol A and phthalate metabolites and weight change: a prospective investigation in US women, International journal of obesity (2005) 38(12) (2014) 1532-7.
M. Hao, L. Ding, L. Xuan, T. Wang, M. Li, Z. Zhao, J. Lu, Y. Xu, Y. Chen, W. Wang, Y. Bi, M. Xu, G. Ning
Urinary bisphenol A concentration and the risk of central obesity in Chinese adults: A prospective study
J. Diabetes, 10 (6) (2018), pp. 442-448 View PDF
CrossRefView Record in ScopusGoogle Scholar[251]
J.M. Braun, N. Li, T.E. Arbuckle, L. Dodds, I. Massarelli, W.D. Fraser, B.P. Lanphear, G. Muckle
Association between gestational urinary bisphenol a concentrations and adiposity in young children: The MIREC study
Environ. Res., 172 (2019), pp. 454-461
ArticleDownload PDFView Record in ScopusGoogle Scholar[252]
L.A. Hoepner, R.M. Whyatt, E.M. Widen, A. Hassoun, S.E. Oberfield, N.T. Mueller, D. Diaz, A.M. Calafat, F.P. Perera, A.G. Rundle
Bisphenol A and Adiposity in an Inner-City Birth Cohort
Environ. Health Perspect., 124 (10) (2016), pp. 1644-1650
View Record in ScopusGoogle Scholar[253]
K. Agay-Shay, D. Martinez, D. Valvi, R. Garcia-Esteban, X. Basagana, O. Robinson, M. Casas, J. Sunyer, M. Vrijheid
Exposure to Endocrine-Disrupting Chemicals during Pregnancy and Weight at 7 Years of Age: A Multi-pollutant Approach
Environ. Health Perspect., 123 (10) (2015), pp. 1030-1037
View Record in ScopusGoogle Scholar[254]
M. Vafeiadi, T. Roumeliotaki, A. Myridakis, G. Chalkiadaki, E. Fthenou, E. Dermitzaki, M. Karachaliou, K. Sarri, M. Vassilaki, E.G. Stephanou, M. Kogevinas, L. Chatzi
Association of early life exposure to bisphenol A with obesity and cardiometabolic traits in childhood
Environ. Res., 146 (2016), pp. 379-387
ArticleDownload PDFView Record in ScopusGoogle Scholar[255]
T.C. Yang, K.E. Peterson, J.D. Meeker, B.N. Sánchez, Z. Zhang, A. Cantoral, M. Solano, M.M. Tellez-Rojo
Bisphenol A and phthalates in utero and in childhood: association with child BMI z-score and adiposity
Environ. Res., 156 (2017), pp. 326-333
ArticleDownload PDFView Record in ScopusGoogle Scholar[256]
J.P. Buckley, A.H. Herring, M.S. Wolff, A.M. Calafat, S.M. Engel
Prenatal exposure to environmental phenols and childhood fat mass in the Mount Sinai Children’s Environmental Health Study
Environ. Int., 91 (2016), pp. 350-356
ArticleDownload PDFView Record in ScopusGoogle Scholar[257]K.G. Harley, R. Aguilar Schall, J. Chevrier, K. Tyler, H. Aguirre, A. Bradman, N.T. Holland, R.H. Lustig, A.M. Calafat, B. Eskenazi, Prenatal and postnatal bisphenol A exposure and body mass index in childhood in the CHAMACOS cohort, Environ Health Perspect 121(4) (2013) 514-20, 520e1-6.
K.K. Ryan, A.M. Haller, J.E. Sorrell, S.C. Woods, R.J. Jandacek, R.J. Seeley
Perinatal exposure to bisphenol-A and the development of metabolic syndrome in CD-1 mice
Endocrinology, 151 (6) (2010), pp. 2603-2612 View PDF
CrossRefView Record in ScopusGoogle Scholar[259]
M. Rolland, S. Lyon-Caen, A.K. Sakhi, I. Pin, A. Sabaredzovic, C. Thomsen, R. Slama, C. Philippat
Exposure to phenols during pregnancy and the first year of life in a new type of couple-child cohort relying on repeated urine biospecimens
Environ. Int., 139 (2020), Article 105678
ArticleDownload PDFView Record in ScopusGoogle Scholar[260]
J.H. Petersen, T. Breindahl
Plasticizers in total diet samples, baby food and infant formulae
Food Addit. Contam., 17 (2) (2000), pp. 133-141
View Record in ScopusGoogle Scholar[261]
M. Genco, L. Anderson-Shaw, R.M. Sargis
Unwitting Accomplices: Endocrine Disruptors Confounding Clinical Care
The Journal of clinical endocrinology and metabolism, 105 (10) (2020)
J.D. Bowman, M. Choudhury
Phthalates in neonatal health: friend or foe?
J Dev Orig Health Dis, 7 (6) (2016), pp. 652-664
View Record in ScopusGoogle Scholar[263]
J. Zhang, C.A. Powell, M.K. Kay, M.H. Park, S. Meruvu, R. Sonkar, M. Choudhury
A moderate physiological dose of benzyl butyl phthalate exacerbates the high fat diet-induced diabesity in male mice
Toxicol. Res. (2020)
G. Rajagopal, R.S. Bhaskaran, B. Karundevi
Developmental exposure to DEHP alters hepatic glucose uptake and transcriptional regulation of GLUT2 in rat male offspring
Toxicology, 413 (2019), pp. 56-64
ArticleDownload PDFView Record in ScopusGoogle Scholar[265]
C. Hao, X. Cheng, J. Guo, H. Xia, X. Ma
Perinatal exposure to diethyl-hexyl-phthalate induces obesity in mice
Front Biosci (Elite Ed), 5 (2013), pp. 725-733
View Record in ScopusGoogle Scholar[266]
K. Schaedlich, S. Gebauer, L. Hunger, L.-S. Beier, H.M. Koch, M. Wabitsch, B. Fischer, J. Ernst
DEHP deregulates adipokine levels and impairs fatty acid storage in human SGBS-adipocytes
Sci. Rep., 8 (1) (2018), p. 3447
View Record in ScopusGoogle Scholar[267]
R. Biemann, A. Navarrete Santos, A. Navarrete Santos, D. Riemann, J. Knelangen, M. Bluher, H. Koch, B. Fischer
Endocrine disrupting chemicals affect the adipogenic differentiation of mesenchymal stem cells in distinct ontogenetic windows
Biochem. Biophys. Res. Commun., 417 (2) (2012), pp. 747-752
ArticleDownload PDFView Record in ScopusGoogle Scholar[268]
N. Klöting, N. Hesselbarth, M. Gericke, A. Kunath, R. Biemann, R. Chakaroun, J. Kosacka, P. Kovacs, M. Kern, M. Stumvoll, B. Fischer, U. Rolle-Kampczyk, R. Feltens, W. Otto, D.K. Wissenbach, M. von Bergen, M. Blüher
Di-(2-Ethylhexyl)-Phthalate (DEHP) Causes Impaired Adipocyte Function and Alters Serum Metabolites
PLoS ONE, 10 (12) (2015), Article e0143190 View PDF
CrossRefView Record in ScopusGoogle Scholar[269]
C.Y. Chiu, S.C. Sun, C.K. Chiang, C.C. Wang, D.C. Chan, H.J. Chen, S.H. Liu, R.S. Yang
Plasticizer di(2-ethylhexyl)phthalate interferes with osteoblastogenesis and adipogenesis in a mouse model
Journal of orthopaedic research : official publication of the Orthopaedic Research Society, 36 (4) (2018), pp. 1124-1134
View Record in ScopusGoogle Scholar[270]
J.N. Feige, L. Gelman, D. Rossi, V. Zoete, R. Metivier, C. Tudor, S.I. Anghel, A. Grosdidier, C. Lathion, Y. Engelborghs, O. Michielin, W. Wahli, B. Desvergne
The endocrine disruptor monoethyl-hexyl-phthalate is a selective peroxisome proliferator-activated receptor gamma modulator that promotes adipogenesis
J. Biol. Chem., 282 (26) (2007), pp. 19152-19166
ArticleDownload PDFCrossRefView Record in ScopusGoogle Scholar[271]
C.H. Hurst, D.J. Waxman
Activation of PPARalpha and PPARgamma by environmental phthalate monoesters
Toxicological sciences : an official journal of the Society of Toxicology, 74 (2) (2003), pp. 297-308
View Record in ScopusGoogle Scholar[272]
E.E. Hatch
Association of urinary phthalate metabolite concentrations with body mass index and waist circumference: a cross-sectional study of NHANES data, 1999–2002
Environ. Health, 7 (2008), p. 27
View Record in ScopusGoogle Scholar[273]
B. Desvergne, J.N. Feige, C. Casals-Casas
PPAR-mediated activity of phthalates: A link to the obesity epidemic?
Mol. Cell. Endocrinol., 304 (1–2) (2009), pp. 43-48
ArticleDownload PDFView Record in ScopusGoogle Scholar[274]
S. Ellero-Simatos, S.P. Claus, C. Benelli, C. Forest, F. Letourneur, N. Cagnard, P.H. Beaune, I. de Waziers
Combined Transcriptomic–1H NMR Metabonomic Study Reveals That Monoethylhexyl Phthalate Stimulates Adipogenesis and Glyceroneogenesis in Human Adipocytes
J. Proteome Res., 10 (12) (2011), pp. 5493-5502 View PDF
CrossRefView Record in ScopusGoogle Scholar[275]
A.N. Buerger, J. Schmidt, A. Chase, C. Paixao, T.N. Patel, B.A. Brumback, A.S. Kane, C.J. Martyniuk, J.H. Bisesi
Examining the responses of the zebrafish (Danio rerio) gastrointestinal system to the suspected obesogen diethylhexyl phthalate, Environmental Pollution (Barking
Essex, 245 (2019) (1987), pp. 1086-1094
Google Scholar[276]A.N. Buerger, D.T. Dillon, J. Schmidt, T. Yang, J. Zubcevic, C.J. Martyniuk, J.H. Bisesi, Gastrointestinal dysbiosis following diethylhexyl phthalate exposure in zebrafish (Danio rerio): Altered microbial diversity, functionality, and network connectivity, Environmental Pollution (Barking, Essex: 1987) 265(Pt B) (2020) 114496.
H.M. Jacobs, K.E. Sant, A. Basnet, L.M. Williams, J.B. Moss, A.R. Timme-Laragy
Embryonic exposure to Mono(2-ethylhexyl) phthalate [MEHP) disrupts pancreatic organogenesis in zebrafish (Danio rerio]
Chemosphere, 195 (2018), pp. 498-507
ArticleDownload PDFView Record in ScopusGoogle Scholar[278]
A. Tête, I. Gallais, M. Imran, L. Legoff, C. Martin-Chouly, L. Sparfel, M. Bescher, O. Sergent, N. Podechard, D. Lagadic-Gossmann
MEHP/ethanol co-exposure favors the death of steatotic hepatocytes, possibly through CYP4A and ADH involvement
Food Chem. Toxicol., 146 (2020), Article 111798
ArticleDownload PDFView Record in ScopusGoogle Scholar[279]
H. Chen, W. Zhang, B.-B. Rui, S.-M. Yang, W.-P. Xu, W. Wei
Di(2-ethylhexyl) phthalate exacerbates non-alcoholic fatty liver in rats and its potential mechanisms
Environ. Toxicol. Pharmacol., 42 (2016), pp. 38-44
ArticleDownload PDFGoogle Scholar[280]
W. Zhang, X.-Y. Shen, W.-W. Zhang, H. Chen, W.-P. Xu, W. Wei
The effects of di 2-ethyl hexyl phthalate (DEHP) on cellular lipid accumulation in HepG2 cells and its potential mechanisms in the molecular level
Toxicol. Mech. Methods, 27 (4) (2017), pp. 245-252 View PDF
CrossRefView Record in ScopusGoogle Scholar[281]
Y. Zhang, S. Wang, T. Zhao, L. Yang, S. Guo, Y. Shi, X. Zhang, L. Zhou, L. Ye
Mono-2-ethylhexyl phthalate (MEHP) promoted lipid accumulation via JAK2/STAT5 and aggravated oxidative stress in BRL-3A cells
Ecotoxicol. Environ. Saf., 184 (2019), Article 109611
ArticleDownload PDFView Record in ScopusGoogle Scholar[282]
W. Guo, J. Han, S. Wu, X. Shi, Q. Wang, B. Zhou
Bis(2-ethylhexyl)-2,3,4,5-tetrabromophthalate Affects Lipid Metabolism in Zebrafish Larvae via DNA Methylation Modification
Environ. Sci. Technol., 54 (1) (2020), pp. 355-363 View PDF
P.N.H. Wassenaar, J. Legler
Systematic review and meta-analysis of early life exposure to di(2-ethylhexyl) phthalate and obesity related outcomes in rodents
Chemosphere, 188 (2017), pp. 174-181
ArticleDownload PDFView Record in ScopusGoogle Scholar[284]
J.-S. Schmidt, K. Schaedlich, N. Fiandanese, P. Pocar, B. Fischer
Effects of di(2-ethylhexyl) phthalate (DEHP) on female fertility and adipogenesis in C3H/N mice
Environ. Health Perspect., 120 (8) (2012), pp. 1123-1129 View PDF
CrossRefView Record in ScopusGoogle Scholar[285]
Z. Lv, J. Cheng, S. Huang, Y. Zhang, S. Wu, Y. Qiu, Y. Geng, Q. Zhang, G. Huang, Q. Ma, X. Xie, S. Zhou, T. Wu, Y. Ke
DEHP induces obesity and hypothyroidism through both central and peripheral pathways in C3H/He mice
Obesity (Silver Spring), 24 (2) (2016), pp. 368-378 View PDF
CrossRefView Record in ScopusGoogle Scholar[286]
C. Hao, X. Cheng, H. Xia, X. Ma
The endocrine disruptor mono-(2-ethylhexyl) phthalate promotes adipocyte differentiation and induces obesity in mice
Biosci. Rep., 32 (6) (2012), pp. 619-629
View Record in ScopusGoogle Scholar[287]
L. Moody, D. Kougias, P.M. Jung, I. Digan, A. Hong, A. Gorski, H. Chen, J. Juraska, Y.-X. Pan
Perinatal phthalate and high-fat diet exposure induce sex-specific changes in adipocyte size and DNA methylation
The Journal of nutritional biochemistry, 65 (2019), pp. 15-25
ArticleDownload PDFView Record in ScopusGoogle Scholar[288]
K.A. Majeed, H. Ur Rehman, M.S. Yousaf, H. Zaneb, I. Rabbani, S.K. Tahir, M.A. Rashid
Sub-chronic exposure to low concentration of dibutyl phthalate affects anthropometric parameters and markers of obesity in rats
Environ. Sci. Pollut. Res. Int., 24 (32) (2017), pp. 25462-25467 View PDF
CrossRefView Record in ScopusGoogle Scholar[289]
K.G. Harley, K. Berger, S. Rauch, K. Kogut, B. Claus Henn, A.M. Calafat, K. Huen, B. Eskenazi, N. Holland
Association of prenatal urinary phthalate metabolite concentrations and childhood BMI and obesity
Pediatr. Res., 82 (3) (2017), pp. 405-415 View PDF
CrossRefView Record in ScopusGoogle Scholar[290]
J.P. Buckley, S.M. Engel, J.M. Braun, R.M. Whyatt, J.L. Daniels, M.A. Mendez, D.B. Richardson, Y. Xu, A.M. Calafat, M.S. Wolff, B.P. Lanphear, A.H. Herring, A.G. Rundle
Prenatal Phthalate Exposures and Body Mass Index Among 4- to 7-Year-old Children: A Pooled Analysis, Epidemiology (Cambridge
Mass.), 27 (3) (2016), pp. 449-458
View Record in ScopusGoogle Scholar[291]
J.H. Kim, H. Park, J. Lee, G. Cho, S. Choi, G. Choi, S.Y. Kim, S.-H. Eun, E. Suh, S.K. Kim, H.-J. Kim, G.-H. Kim, J.J. Lee, Y.D. Kim, S. Eom, S. Kim, H.-B. Moon, J. Park, K. Choi, S. Kim, S. Kim
Association of diethylhexyl phthalate with obesity-related markers and body mass change from birth to 3 months of age
J. Epidemiol. Community Health, 70 (5) (2016), pp. 466-472 View PDF
D. Valvi, M. Casas, D. Romaguera, N. Monfort, R. Ventura, D. Martinez, J. Sunyer, M. Vrijheid
Prenatal Phthalate Exposure and Childhood Growth and Blood Pressure: Evidence from the Spanish INMA-Sabadell Birth Cohort Study
Environ. Health Perspect., 123 (10) (2015), pp. 1022-1029
View Record in ScopusGoogle Scholar[293]
J. Botton, C. Philippat, A.M. Calafat, S. Carles, M.-A. Charles, R. Slama
E.m.-c.c.s.g. the, Phthalate pregnancy exposure and male offspring growth from the intra-uterine period to five years of age
Environ. Res., 151 (2016), pp. 601-609
ArticleDownload PDFView Record in ScopusGoogle Scholar[294]
J.W. Hou, C.L. Lin, Y.A. Tsai, C.H. Chang, K.W. Liao, C.J. Yu, W. Yang, M.J. Lee, P.C. Huang, C.W. Sun, Y.H. Wang, F.R. Lin, W.C. Wu, M.C. Lee, W.H. Pan, B.H. Chen, M.T. Wu, C.C. Chen, S.L. Wang, C.C. Lee, C.A. Hsiung, M.L. Chen
The effects of phthalate and nonylphenol exposure on body size and secondary sexual characteristics during puberty
Int. J. Hyg. Environ. Health, 218 (7) (2015), pp. 603-615
ArticleDownload PDFView Record in ScopusGoogle Scholar[295]
C.M. Sol, S. Santos, L. Duijts, A.G. Asimakopoulos, M.-P. Martinez-Moral, K. Kannan, E.M. Philips, L. Trasande, V.W.V. Jaddoe
Fetal exposure to phthalates and bisphenols and childhood general and organ fat
A population-based prospective cohort study, International Journal of Obesity, 44 (11) (2020), pp. 2225-2235 View PDF
CrossRefView Record in ScopusGoogle Scholar[296]
M.M. Maresca, L.A. Hoepner, A. Hassoun, S.E. Oberfield, S.J. Mooney, A.M. Calafat, J. Ramirez, G. Freyer, F.P. Perera, R.M. Whyatt, A.G. Rundle
Prenatal Exposure to Phthalates and Childhood Body Size in an Urban Cohort
Environ. Health Perspect., 124 (4) (2016), pp. 514-520
View Record in ScopusGoogle Scholar[297]
J.P. Buckley, S.M. Engel, M.A. Mendez, D.B. Richardson, J.L. Daniels, A.M. Calafat, M.S. Wolff, A.H. Herring
Prenatal Phthalate Exposures and Childhood Fat Mass in a New York City Cohort
Environ. Health Perspect., 124 (4) (2016), pp. 507-513 View PDF
CrossRefView Record in ScopusGoogle Scholar[298]
K. Berger, C. Hyland, J.L. Ames, A.M. Mora, K. Huen, B. Eskenazi, N. Holland, K.G. Harley
Prenatal Exposure to Mixtures of Phthalates, Parabens, and Other Phenols and Obesity in Five-Year-Olds in the CHAMACOS Cohort
Int. J. Environ. Res. Public Health, 18 (4) (2021)
J. Shoaff, G.D. Papandonatos, A.M. Calafat, X. Ye, A. Chen, B.P. Lanphear, K. Yolton, J.M. Braun
Early-Life Phthalate Exposure and Adiposity at 8 Years of Age
Environ. Health Perspect., 125 (9) (2017), Article 097008 View PDF
CrossRefView Record in ScopusGoogle Scholar[300]
M. Brauer, G. Freedman, J. Frostad, A. van Donkelaar, R.V. Martin, F. Dentener, R. van Dingenen, K. Estep, H. Amini, J.S. Apte, K. Balakrishnan, L. Barregard, D. Broday, V. Feigin, S. Ghosh, P.K. Hopke, L.D. Knibbs, Y. Kokubo, Y. Liu, S. Ma, L. Morawska, J.L. Sangrador, G. Shaddick, H.R. Anderson, T. Vos, M.H. Forouzanfar, R.T. Burnett, A. Cohen
Ambient Air Pollution Exposure Estimation for the Global Burden of Disease 2013
Environ. Sci. Technol., 50 (1) (2016), pp. 79-88 View PDF
CrossRefView Record in ScopusGoogle Scholar[301]G.B.D.R.F. Collaborators, Global, regional, and national comparative risk assessment of 84 behavioural, environmental and occupational, and metabolic risks or clusters of risks for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017, Lancet 392(10159) (2018) 1923-1994.
A.J. Cohen, M. Brauer, R. Burnett, H.R. Anderson, J. Frostad, K. Estep, K. Balakrishnan, B. Brunekreef, L. Dandona, R. Dandona, V. Feigin, G. Freedman, B. Hubbell, A. Jobling, H. Kan, L. Knibbs, Y. Liu, R. Martin, L. Morawska, C.A. Pope 3rd, H. Shin, K. Straif, G. Shaddick, M. Thomas, R. van Dingenen, A. van Donkelaar, T. Vos, C.J.L. Murray, M.H. Forouzanfar
Estimates and 25-year trends of the global burden of disease attributable to ambient air pollution: an analysis of data from the Global Burden of Diseases Study 2015
Lancet, 389 (10082) (2017), pp. 1907-1918
ArticleDownload PDFGoogle Scholar[303]
M.J. Bailey, N.N. Naik, L.E. Wild, W.B. Patterson, T.L. Alderete
Exposure to air pollutants and the gut microbiota: a potential link between exposure, obesity, and type 2 diabetes
Gut Microbes, 11 (5) (2020), pp. 1188-1202 View PDF
CrossRefView Record in ScopusGoogle Scholar[304]
S. Rajagopalan, R.D. Brook
Air pollution and type 2 diabetes: mechanistic insights
Diabetes, 61 (12) (2012), pp. 3037-3045 View PDF
CrossRefView Record in ScopusGoogle Scholar[305]
R.D. Brook, X. Xu, R.L. Bard, J.T. Dvonch, M. Morishita, N. Kaciroti, Q. Sun, J. Harkema, S. Rajagopalan
Reduced metabolic insulin sensitivity following sub-acute exposures to low levels of ambient fine particulate matter air pollution
The Science of the total environment, 448 (2013), pp. 66-71
ArticleDownload PDFView Record in ScopusGoogle Scholar[306]
Q. Sun, P. Yue, J.A. Deiuliis, C.N. Lumeng, T. Kampfrath, M.B. Mikolaj, Y. Cai, M.C. Ostrowski, B. Lu, S. Parthasarathy
Ambient air pollution exaggerates adipose inflammation and insulin resistance in a mouse model of diet-induced obesity
Circulation, 119 (2009)
Y. Wang, M.N. Eliot, G.A. Kuchel, J. Schwartz, B.A. Coull, M.A. Mittleman, L.A. Lipsitz, G.A. Wellenius
Long-term exposure to ambient air pollution and serum leptin in older adults: results from the MOBILIZE Boston study
J. Occup. Environ. Med., 56 (9) (2014), pp. e73-e77
View Record in ScopusGoogle Scholar[308]
W. Wu, Y. Jin, C. Carlsten
Inflammatory health effects of indoor and outdoor particulate matter
J. Allergy Clin. Immunol., 141 (3) (2018), pp. 833-844
ArticleDownload PDFView Record in ScopusGoogle Scholar[309]
Z. Xu, X. Xu, M. Zhong, I.P. Hotchkiss, R.P. Lewandowski, J.G. Wagner, L.A. Bramble, Y. Yang, A. Wang, J.R. Harkema, M. Lippmann, S. Rajagopalan, L.C. Chen, Q. Sun
Ambient particulate air pollution induces oxidative stress and alterations of mitochondria and gene expression in brown and white adipose tissues
Part. Fibre Toxicol., 8 (2011), p. 20
P. Haberzettl, T.E. O’Toole, A. Bhatnagar, D.J. Conklin
Exposure to Fine Particulate Air Pollution Causes Vascular Insulin Resistance by Inducing Pulmonary Oxidative Stress
Environ. Health Perspect., 124 (12) (2016), pp. 1830-1839
View Record in ScopusGoogle Scholar[311]
L. Calderon-Garciduenas, M. Franco-Lira, A. D’Angiulli, J. Rodriguez-Diaz, E. Blaurock-Busch, Y. Busch, C.K. Chao, C. Thompson, P.S. Mukherjee, R. Torres-Jardon, G. Perry
Mexico City normal weight children exposed to high concentrations of ambient PM2.5 show high blood leptin and endothelin-1, vitamin D deficiency, and food reward hormone dysregulation versus low pollution controls. Relevance for obesity and Alzheimer disease
Environ. Res., 140 (2015), pp. 579-592
ArticleDownload PDFView Record in ScopusGoogle Scholar[312]
P. Irigaray, J.A. Newby, S. Lacomme, D. Belpomme
Overweight/obesity and cancer genesis: more than a biological link
Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 61 (10) (2007), pp. 665-678
ArticleDownload PDFView Record in ScopusGoogle Scholar[313]
P. Irigaray, V. Ogier, S. Jacquenet, V. Notet, P. Sibille, L. Mejean, B.E. Bihain, F.T. Yen
Benzo[a]pyrene impairs beta-adrenergic stimulation of adipose tissue lipolysis and causes weight gain in mice
A novel molecular mechanism of toxicity for a common food pollutant, The FEBS journal, 273 (7) (2006), pp. 1362-1372 View PDF
CrossRefView Record in ScopusGoogle Scholar[314]
L. Ortiz, B. Nakamura, X. Li, B. Blumberg, U. Luderer
In utero exposure to benzo[a]pyrene increases adiposity and causes hepatic steatosis in female mice, and glutathione deficiency is protective
Toxicol. Lett., 223 (2) (2013), pp. 260-267
ArticleDownload PDFView Record in ScopusGoogle Scholar[315]
F. Yin, R. Gupta, L. Vergnes, W.S. Driscoll, J. Ricks, G. Ramanathan, J.A. Stewart, D.M. Shih, K.F. Faull, S.W. Beaven, A.J. Lusis, K. Reue, M.E. Rosenfeld, J.A. Araujo
Diesel Exhaust Induces Mitochondrial Dysfunction, Hyperlipidemia, and Liver Steatosis
Arterioscler. Thromb. Vasc. Biol., 39 (9) (2019), pp. 1776-1786 View PDF
CrossRefView Record in ScopusGoogle Scholar[316]
X. Xu, Z. Yavar, M. Verdin, Z. Ying, G. Mihai, T. Kampfrath, A. Wang, M. Zhong, M. Lippmann, L.C. Chen, S. Rajagopalan, Q. Sun
Effect of early particulate air pollution exposure on obesity in mice: role of p47phox
Arterioscler. Thromb. Vasc. Biol., 30 (12) (2010), pp. 2518-2527
View Record in ScopusGoogle Scholar[317]
G. Wu, J. Brown, M.L. Zamora, A. Miller, M.C. Satterfield, C.J. Meininger, C.B. Steinhauser, G.A. Johnson, R.C. Burghardt, F.W. Bazer, Y. Li, N.M. Johnson, M.J. Molina, R. Zhang
Adverse organogenesis and predisposed long-term metabolic syndrome from prenatal exposure to fine particulate matter
PNAS, 116 (24) (2019), pp. 11590-11595 View PDF
CrossRefView Record in ScopusGoogle Scholar[318]
K. Pan, S. Jiang, X. Du, X. Zeng, J. Zhang, L. Song, J. Zhou, H. Kan, Q. Sun, Y. Xie, J. Zhao
AMPK activation attenuates inflammatory response to reduce ambient PM2.5-induced metabolic disorders in healthy and diabetic mice
Ecotoxicol. Environ. Saf., 179 (2019), pp. 290-300
ArticleDownload PDFView Record in ScopusGoogle Scholar[319]
H. Reyes-Caballero, X. Rao, Q. Sun, M.O. Warmoes, P. Lin, T.E. Sussan, B. Park, T.W. Fan, A. Maiseyeu, S. Rajagopalan, G.D. Girnun, S. Biswal
Air pollution-derived particulate matter dysregulates hepatic Krebs cycle, glucose and lipid metabolism in mice
Sci. Rep., 9 (1) (2019), p. 17423
View Record in ScopusGoogle Scholar[320]
R. Li, Y. Wang, B. Hou, S.M. Lam, W. Zhang, R. Chen, G. Shui, Q. Sun, G. Qiang, C. Liu
Lipidomics insight into chronic exposure to ambient air pollution in mice, Environmental pollution (Barking
Essex, 262 (2020) (1987), Article 114668
M. Jiang, D. Li, J. Piao, J. Li, H. Sun, L. Chen, S. Chen, J. Pi, R. Zhang, R. Chen, S. Leng, W. Chen, Y. Zheng
Real-ambient exposure to air pollution exaggerates excessive growth of adipose tissue modulated by Nrf2 signal
The Science of the total environment, 730 (2020), Article 138652
ArticleDownload PDFView Record in ScopusGoogle Scholar[322]
J.L. Bolton, S.H. Smith, N.C. Huff, M.I. Gilmour, W.M. Foster, R.L. Auten, S.D. Bilbo
Prenatal air pollution exposure induces neuroinflammation and predisposes offspring to weight gain in adulthood in a sex-specific manner
FASEB J. (2012)
Google Scholar[323]P.B. Goettems-Fiorin, B.S. Grochanke, F.G. Baldissera, A.B. Dos Santos, P.I. Homem de Bittencourt, Jr., M.S. Ludwig, C.R. Rhoden, T.G. Heck, Fine particulate matter potentiates type 2 diabetes development in high-fat diet-treated mice: stress response and extracellular to intracellular HSP70 ratio analysis, J Physiol Biochem 72(4) (2016) 643-656.
M. Pardo, Y. Kuperman, L. Levin, A. Rudich, Y. Haim, J.J. Schauer, A. Chen, Y. Rudich
Exposure to air pollution interacts with obesogenic nutrition to induce tissue-specific response patterns, Environmental pollution (Barking
Essex, 239 (2018) (1987), pp. 532-543
C. Liu, Y. Bai, X. Xu, L. Sun, A. Wang, T.Y. Wang, S.K. Maurya, M. Periasamy, M. Morishita, J. Harkema, Z. Ying, Q. Sun, S. Rajagopalan
Exaggerated effects of particulate matter air pollution in genetic type II diabetes mellitus
Part. Fibre Toxicol., 11 (2014), p. 27
H. Tang, Z. Cheng, N. Li, S. Mao, R. Ma, H. He, Z. Niu, X. Chen, H. Xiang
The short- and long-term associations of particulate matter with inflammation and blood coagulation markers: A meta-analysis, Environmental pollution (Barking
Essex, 267 (2020) (1987), Article 115630
E.A. Clementi, A. Talusan, S. Vaidyanathan, A. Veerappan, M. Mikhail, D. Ostrofsky, G. Crowley, J.S. Kim, S. Kwon, A. Nolan
Metabolic Syndrome and Air Pollution: A Narrative Review of Their Cardiopulmonary Effects
Toxics, 7 (1) (2019)
Y. Wei, J.J. Zhang, Z. Li, A. Gow, K.F. Chung, M. Hu, Z. Sun, L. Zeng, T. Zhu, G. Jia, X. Li, M. Duarte, X. Tang
Chronic exposure to air pollution particles increases the risk of obesity and metabolic syndrome: findings from a natural experiment in Beijing
FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 30 (6) (2016), pp. 2115-2122 View PDF
CrossRefView Record in ScopusGoogle Scholar[329]
C. Liu, X. Xu, Y. Bai, T.Y. Wang, X. Rao, A. Wang, L. Sun, Z. Ying, L. Gushchina, A. Maiseyeu, M. Morishita, Q. Sun, J.R. Harkema, S. Rajagopalan
Air pollution-mediated susceptibility to inflammation and insulin resistance: influence of CCR2 pathways in mice
Environ. Health Perspect., 122 (1) (2014), pp. 17-26 View PDF
CrossRefView Record in ScopusGoogle Scholar[330]
M.X. Xu, C.X. Ge, Y.T. Qin, T.T. Gu, D.S. Lou, Q. Li, L.F. Hu, J. Feng, P. Huang, J. Tan
Prolonged PM2.5 exposure elevates risk of oxidative stress-driven nonalcoholic fatty liver disease by triggering increase of dyslipidemia
Free Radic Biol Med, 130 (2019), pp. 542-556
ArticleDownload PDFView Record in ScopusGoogle Scholar[331]
C. Liu, Z. Ying, J. Harkema, Q. Sun, S. Rajagopalan
Epidemiological and experimental links between air pollution and type 2 diabetes
Toxicol. Pathol., 41 (2) (2013), pp. 361-373 View PDF
CrossRefView Record in ScopusGoogle Scholar[332]
T.L. Alderete, R.B. Jones, Z. Chen, J.S. Kim, R. Habre, F. Lurmann, F.D. Gilliland, M.I. Goran
Exposure to traffic-related air pollution and the composition of the gut microbiota in overweight and obese adolescents
Environ. Res., 161 (2018), pp. 472-478
ArticleDownload PDFView Record in ScopusGoogle Scholar[333]
Z. Andrysík, J. Vondráček, S. Marvanová, M. Ciganek, J. Neča, K. Pěnčíková, B. Mahadevan, J. Topinka, W.M. Baird, A. Kozubík, M. Machala
Activation of the aryl hydrocarbon receptor is the major toxic mode of action of an organic extract of a reference urban dust particulate matter mixture: the role of polycyclic aromatic hydrocarbons
Mutat. Res., 714 (1–2) (2011), pp. 53-62
ArticleDownload PDFView Record in ScopusGoogle Scholar[334]A. Metidji, S. Omenetti, S. Crotta, Y. Li, E. Nye, E. Ross, V. Li, M.R. Maradana, C. Schiering, B. Stockinger, The Environmental Sensor AHR Protects from Inflammatory Damage by Maintaining Intestinal Stem Cell Homeostasis and Barrier Integrity, Immunity 49(2) (2018) 353-362 e5.
C.M. Campolim, L. Weissmann, C.K.O. Ferreira, O.P. Zordao, A.P.S. Dornellas, G. de Castro, T.M. Zanotto, V.F. Boico, P.G.F. Quaresma, R.P.A. Lima, J. Donato Jr., M.M. Veras, P.H.N. Saldiva, Y.B. Kim, P.O. Prada
Short-term exposure to air pollution (PM2.5) induces hypothalamic inflammation, and long-term leads to leptin resistance and obesity via Tlr4/Ikbke in mice
Sci. Rep., 10 (1) (2020), p. 10160
View Record in ScopusGoogle Scholar[336]
R. Li, Q. Sun, S.M. Lam, R. Chen, J. Zhu, W. Gu, L. Zhang, H. Tian, K. Zhang, L.C. Chen, Q. Sun, G. Shui, C. Liu
Sex-dependent effects of ambient PM2.5 pollution on insulin sensitivity and hepatic lipid metabolism in mice
Part. Fibre Toxicol., 17 (1) (2020), p. 14
M.Y. Seo, S.H. Kim, M.J. Park
Air pollution and childhood obesity
Clin Exp Pediatr, 63 (10) (2020), pp. 382-388 View PDF
CrossRefView Record in ScopusGoogle Scholar[338]
T.L. Alderete, R. Habre, C.M. Toledo-Corral, K. Berhane, Z. Chen, F.W. Lurmann, M.J. Weigensberg, M.I. Goran, F.D. Gilliland
Longitudinal Associations Between Ambient Air Pollution With Insulin Sensitivity, beta-Cell Function, and Adiposity in Los Angeles Latino Children
Diabetes, 66 (7) (2017), pp. 1789-1796 View PDF
CrossRefView Record in ScopusGoogle Scholar[339]
A. Rundle, L. Hoepner, A. Hassoun, S. Oberfield, G. Freyer, D. Holmes, M. Reyes, J. Quinn, D. Camann, F. Perera, R. Whyatt
Association of childhood obesity with maternal exposure to ambient air polycyclic aromatic hydrocarbons during pregnancy
Am. J. Epidemiol., 175 (2012)
M. Jerrett, R. McConnell, J. Wolch, R. Chang, C. Lam, G. Dunton, F. Gilliland, F. Lurmann, T. Islam, K. Berhane
Traffic-related air pollution and obesity formation in children: a longitudinal, multilevel analysis
Environ Health, 13 (2014)
R. McConnell, F.D. Gilliland, M. Goran, H. Allayee, A. Hricko, S. Mittelman
Does near-roadway air pollution contribute to childhood obesity?
Pediatric obesity (2015)
A.P. Starling, B.F. Moore, D.S.K. Thomas, J.L. Peel, W. Zhang, J.L. Adgate, S. Magzamen, S.E. Martenies, W.B. Allshouse, D. Dabelea
Prenatal exposure to traffic and ambient air pollution and infant weight and adiposity: The Healthy Start study
Environ. Res., 182 (2020), Article 109130
ArticleDownload PDFView Record in ScopusGoogle Scholar[343]
A.G. Rundle, D. Gallagher, J.B. Herbstman, J. Goldsmith, D. Holmes, A. Hassoun, S. Oberfield, R.L. Miller, H. Andrews, E.M. Widen, L.A. Hoepner, F. Perera
Prenatal exposure to airborne polycyclic aromatic hydrocarbons and childhood growth trajectories from age 5–14 years
Environ. Res., 177 (2019), p. 108595
ArticleDownload PDFView Record in ScopusGoogle Scholar[344]
J.S. Kim, T.L. Alderete, Z. Chen, F. Lurmann, E. Rappaport, R. Habre, K. Berhane, F.D. Gilliland
Longitudinal associations of in utero and early life near-roadway air pollution with trajectories of childhood body mass index
Environmental Health, 17 (1) (2018), p. 64
ArticleDownload PDFGoogle Scholar[345]
J. de Bont, M. Casas, J. Barrera-Gomez, M. Cirach, I. Rivas, D. Valvi, M. Alvarez, P. Dadvand, J. Sunyer, M. Vrijheid
Ambient air pollution and overweight and obesity in school-aged children in Barcelona, Spain
Environ. Int., 125 (2019), pp. 58-64
ArticleDownload PDFView Record in ScopusGoogle Scholar[346]
J.S. Kim, Z. Chen, T.L. Alderete, C. Toledo-Corral, F. Lurmann, K. Berhane, F.D. Gilliland
Associations of air pollution, obesity and cardiometabolic health in young adults: The Meta-AIR study
Environ. Int., 133 (Pt A) (2019), Article 105180
ArticleDownload PDFView Record in ScopusGoogle Scholar[347]Z. Chen, C.B. Newgard, J.S. Kim, I.I. O, T.L. Alderete, D.C. Thomas, K. Berhane, C. Breton, L. Chatzi, T.M. Bastain, R. McConnell, E. Avol, F. Lurmann, M.J. Muehlbauer, E.R. Hauser, F.D. Gilliland, Near-roadway air pollution exposure and altered fatty acid oxidation among adolescents and young adults – The interplay with obesity, Environ Int 130 (2019) 104935.
Q. Guo, T. Xue, C. Jia, B. Wang, S. Cao, X. Zhao, Q. Zhang, L. Zhao, J.J. Zhang, X. Duan
Association between exposure to fine particulate matter and obesity in children: A national representative cross-sectional study in China
Environ. Int., 143 (2020), Article 105950
ArticleDownload PDFView Record in ScopusGoogle Scholar[349]
N. Parasin, T. Amnuaylojaroen, S. Saokaew
Effect of Air Pollution on Obesity in Children
A Systematic Review and Meta-Analysis, Children (Basel), 8 (5) (2021)
K. Frondelius, A. Oudin, E. Malmqvist
Traffic-Related Air Pollution and Child BMI-A Study of Prenatal Exposure to Nitrogen Oxides and Body Mass Index in Children at the Age of Four Years in Malmo, Sweden
Int. J. Environ. Res. Public Health, 15 (10) (2018)
Z. Wang, L. Zhao, Q. Huang, A. Hong, C. Yu, Q. Xiao, B. Zou, S. Ji, L. Zhang, K. Zou, Y. Ning, J. Zhang, P. Jia
Traffic-related environmental factors and childhood obesity: A systematic review and meta-analysis
Obes. Rev. (2020)
S. Fioravanti, G. Cesaroni, C. Badaloni, P. Michelozzi, F. Forastiere, D. Porta
Traffic-related air pollution and childhood obesity in an Italian birth cohort
Environ. Res., 160 (2018)
K. Zhang, H. Wang, W. He, G. Chen, P. Lu, R. Xu, P. Yu, T. Ye, S. Guo, S. Li, Y. Xie, Z. Hao, H. Wang, Y. Guo
The association between ambient air pollution and blood lipids: A longitudinal study in Shijiazhuang
China, The Science of the total environment, 752 (2021), Article 141648
ArticleDownload PDFView Record in ScopusGoogle Scholar[354]
N. Zhang, L. Wang, M. Zhang, J. Nazroo
Air quality and obesity at older ages in China: The role of duration, severity and pollutants
PLoS ONE, 14 (12) (2019), Article e0226279 View PDF
CrossRefView Record in ScopusGoogle Scholar[355]
X. Zhang, H. Zhao, W.H. Chow, M. Bixby, C. Durand, C. Markham, K. Zhang
Population-Based Study of Traffic-Related Air Pollution and Obesity in Mexican Americans
Obesity (Silver Spring), 28 (2) (2020), pp. 412-420 View PDF
CrossRefView Record in ScopusGoogle Scholar[356]
S. Lee, H. Park, S. Kim, E.K. Lee, J. Lee, Y.S. Hong, E. Ha
Fine particulate matter and incidence of metabolic syndrome in non-CVD patients: A nationwide population-based cohort study
Int. J. Hyg. Environ. Health, 222 (3) (2019), pp. 533-540
ArticleDownload PDFCrossRefGoogle Scholar[357]S. Huang, X. Zhang, J. Huang, X. Lu, F. Liu, D. Gu, Ambient air pollution and body weight status in adults: A systematic review and meta-analysis, Environmental pollution (Barking, Essex : 1987) 265(Pt A) (2020) 114999.
K. Wolf, A. Popp, A. Schneider, S. Breitner, R. Hampel, W. Rathmann, C. Herder, M. Roden, W. Koenig, C. Meisinger, A. Peters, K.O.-S. Group
Association Between Long-term Exposure to Air Pollution and Biomarkers Related to Insulin Resistance
Subclinical Inflammation, and Adipokines, Diabetes, 65 (11) (2016), pp. 3314-3326
Y. Mattos, W.B. Stotz, M.S. Romero, M. Bravo, G. Fillmann, I.B. Castro
Butyltin contamination in Northern Chilean coast: Is there a potential risk for consumers?
The Science of the total environment, 595 (2017), pp. 209-217
ArticleDownload PDFView Record in ScopusGoogle Scholar[360]
L. Lagadic, I. Katsiadaki, R. Biever, P.D. Guiney, N. Karouna-Renier, T. Schwarz, J.P. Meador
Tributyltin: Advancing the Science on Assessing Endocrine Disruption with an Unconventional Endocrine-Disrupting Compound
Rev. Environ. Contam. Toxicol., 245 (2018), pp. 65-127
View Record in ScopusGoogle Scholar[361]
M. Golub, J. Doherty
Triphenyltin as a potential human endocrine disruptor
J. Toxicol. Environ. Health B. Crit. Rev., 7 (2004), pp. 281-295
View Record in ScopusGoogle Scholar[362]
H. Fromme, A. Mattulat, T. Lahrz, H. Ruden
Occurrence of organotin compounds in house dust in Berlin (Germany)
Chemosphere, 58 (10) (2005), pp. 1377-1383
ArticleDownload PDFView Record in ScopusGoogle Scholar[363]
K. Kannan, S. Takahashi, N. Fujiwara, H. Mizukawa, S. Tanabe
Organotin compounds, including butyltins and octyltins, in house dust from Albany
New York, USA, Arch Environ Contam Toxicol, 58 (4) (2010), pp. 901-907 View PDF
CrossRefView Record in ScopusGoogle Scholar[364]
R. Chamorro-García, B.M. Shoucri, S. Willner, H. Käch, A. Janesick, B. Blumberg
Effects of Perinatal Exposure to Dibutyltin Chloride on Fat and Glucose Metabolism in Mice, and Molecular Mechanisms, in Vitro
Environ. Health Perspect., 126 (5) (2018), Article 057006 View PDF
F.A. Milton, M.G. Lacerda, S.B.P. Sinoti, P.G. Mesquita, D. Prakasan, M.S. Coelho, C.L. de Lima, A.G. Martini, G.T. Pazzine, M.F. Borin, A.A. Amato, F.A.R. Neves
Dibutyltin Compounds Effects on PPARγ/RXRα Activity
Adipogenesis, and Inflammation in Mammalians Cells, Frontiers in pharmacology, 8 (2017), p. 507
View Record in ScopusGoogle Scholar[366]
A. le Maire, M. Grimaldi, D. Roecklin, S. Dagnino, V. Vivat-Hannah, P. Balaguer, W. Bourguet
Activation of RXR-PPAR heterodimers by organotin environmental endocrine disruptors
EMBO Rep., 10 (4) (2009), pp. 367-373 View PDF
CrossRefView Record in ScopusGoogle Scholar[367]
V. Delfosse, T. Huet, D. Harrus, M. Granell, M. Bourguet, C. Gardia-Parège, B. Chiavarina, M. Grimaldi, S. Le Mével, P. Blanc, D. Huang, J. Gruszczyk, B. Demeneix, S. Cianférani, J.B. Fini, P. Balaguer, W. Bourguet
Mechanistic insights into the synergistic activation of the RXR-PXR heterodimer by endocrine disruptor mixtures
PNAS, 118 (1) (2021)
H. Inadera, A. Shimomura
Environmental chemical tributyltin augments adipocyte differentiation
Toxicol. Lett., 159 (3) (2005), pp. 226-234
ArticleDownload PDFView Record in ScopusGoogle Scholar[369]
X. Li, J. Ycaza, B. Blumberg
The environmental obesogen tributyltin chloride acts via peroxisome proliferator activated receptor gamma to induce adipogenesis in murine 3T3-L1 preadipocytes
The Journal of Steroid Biochemistry and Molecular Biology, 127 (1–2) (2011), pp. 9-15
ArticleDownload PDFGoogle Scholar[370]
S. Kirchner, T. Kieu, C. Chow, S. Casey, B. Blumberg
Prenatal exposure to the environmental obesogen tributyltin predisposes multipotent stem cells to become adipocytes, Molecular endocrinology (Baltimore
Md.), 24 (3) (2010), pp. 526-539 View PDF
CrossRefView Record in ScopusGoogle Scholar[371]
S.C. Yanik, A.H. Baker, K.K. Mann, J.J. Schlezinger
Organotins are potent activators of PPARgamma and adipocyte differentiation in bone marrow multipotent mesenchymal stromal cells
Toxicological sciences : an official journal of the Society of Toxicology, 122 (2) (2011), pp. 476-488 View PDF
CrossRefView Record in ScopusGoogle Scholar[372]
F. Stossi, R.D. Dandekar, H. Johnson, P. Lavere, C.E. Foulds, M.G. Mancini, M.A. Mancini
Tributyltin chloride (TBT) induces RXRA down-regulation and lipid accumulation in human liver cells
PLoS ONE, 14 (11) (2019), p. e0224405 View PDF
CrossRefView Record in ScopusGoogle Scholar[373]
E.J. Flynn, C.M. Trent, J.F. Rawls
Ontogeny and nutritional control of adipogenesis in zebrafish (Danio rerio)
J. Lipid Res., 50 (8) (2009), pp. 1641-1652
ArticleDownload PDFView Record in ScopusGoogle Scholar[374]
D. Imrie, K.C. Sadler
White adipose tissue development in zebrafish is regulated by both developmental time and fish size
Dev. Dyn., 239 (11) (2010), pp. 3013-3023 View PDF
CrossRefView Record in ScopusGoogle Scholar[375]
A. Tingaud-Sequeira, N. Ouadah, P.J. Babin
Zebrafish obesogenic test: a tool for screening molecules that target adiposity
J. Lipid Res., 52 (9) (2011), pp. 1765-1772
ArticleDownload PDFCrossRefView Record in ScopusGoogle Scholar[376]
M.J. den Broeder, M.J.B. Moester, J.H. Kamstra, P.H. Cenijn, V. Davidoiu, L.M. Kamminga, F. Ariese, J.F. de Boer, J. Legler
Altered Adipogenesis in Zebrafish Larvae Following High Fat Diet and Chemical Exposure Is Visualised by Stimulated Raman Scattering Microscopy
Int. J. Mol. Sci., 18 (4) (2017), p. 894 View PDF
CrossRefView Record in ScopusGoogle Scholar[377]
J. Zhang, P. Sun, F. Yang, T. Kong, R. Zhang
Tributyltin disrupts feeding and energy metabolism in the goldfish [Carassius auratus]
Chemosphere, 152 (2016), pp. 221-228
ArticleDownload PDFView Record in ScopusGoogle Scholar[378]
J.P. Meador, F.C. Sommers, K.A. Cooper, G. Yanagida
Tributyltin and the obesogen metabolic syndrome in a salmonid
Environ. Res., 111 (1) (2011), pp. 50-56
ArticleDownload PDFView Record in ScopusGoogle Scholar[379]
K. Chen, N. Iwasaki, X. Qiu, H. Xu, Y. Takai, K. Tashiro, Y. Shimasaki, Y. Oshima
Obesogenic and developmental effects of TBT on the gene expression of juvenile Japanese medaka (Oryzias latipes)
Aquatic toxicology (Amsterdam, Netherlands), 237 (2021), Article 105907
ArticleDownload PDFView Record in ScopusGoogle Scholar[380]
A.M.F. Capitão, M.S. Lopes-Marques, Y. Ishii, R. Ruivo, E.S.S. Fonseca, I. Páscoa, R.P. Jorge, M.A.G. Barbosa, Y. Hiromori, T. Miyagi, T. Nakanishi, M.M. Santos, L.F.C. Castro
Evolutionary Exploitation of Vertebrate Peroxisome Proliferator-Activated Receptor γ by Organotins
Environ. Sci. Technol., 52 (23) (2018), pp. 13951-13959 View PDF
N. Ouadah-Boussouf, P.J. Babin
Pharmacological evaluation of the mechanisms involved in increased adiposity in zebrafish triggered by the environmental contaminant tributyltin
Toxicol. Appl. Pharmacol., 294 (2016), pp. 32-42
ArticleDownload PDFView Record in ScopusGoogle Scholar[382]
F. Grun
Endocrine-disrupting organotin compounds are potent inducers of adipogenesis in vertebrates
Mol. Endocrinol., 20 (2006), pp. 2141-2155 View PDF
CrossRefView Record in ScopusGoogle Scholar[383]
E. Bo, C. Viglietti-Panzica, G.C. Panzica
Acute exposure to tributyltin induces c-fos activation in the hypothalamic arcuate nucleus of adult male mice
Neurotoxicology, 32 (2) (2011), pp. 277-280
ArticleDownload PDFView Record in ScopusGoogle Scholar[384]
M. Penza, M. Jeremic, E. Marrazzo, A. Maggi, P. Ciana, G. Rando, P.G. Grigolato, D. Di Lorenzo
The environmental chemical tributyltin chloride (TBT) shows both estrogenic and adipogenic activities in mice which might depend on the exposure dose
Toxicol. Appl. Pharmacol., 255 (1) (2011), pp. 65-75
ArticleDownload PDFView Record in ScopusGoogle Scholar[385]
Z. Zuo, S. Chen, T. Wu, J. Zhang, Y. Su, Y. Chen, C. Wang
Tributyltin causes obesity and hepatic steatosis in male mice
Environ. Toxicol., 26 (1) (2011), pp. 79-85 View PDF
CrossRefView Record in ScopusGoogle Scholar[386]
K. He, J. Zhang, Z. Chen
Effect of tributyltin on the food intake and brain neuropeptide expression in rats
Endokrynol Pol, 65 (6) (2014), pp. 485-490
View Record in ScopusGoogle Scholar[387]
E. Bo, A. Farinetti, M. Marraudino, D. Sterchele, C. Eva, S. Gotti, G. Panzica
Adult exposure to tributyltin affects hypothalamic neuropeptide Y, Y1 receptor distribution, and circulating leptin in mice
Andrology, 4 (4) (2016), pp. 723-734 View PDF
CrossRefView Record in ScopusGoogle Scholar[388]
P. Rantakokko, K.M. Main, C. Wohlfart-Veje, H. Kiviranta, R. Airaksinen, T. Vartiainen, N.E. Skakkebaek, J. Toppari, H.E. Virtanen
Association of placenta organotin concentrations with growth and ponderal index in 110 newborn boys from Finland during the first 18 months of life: a cohort study
Environ Health, 13 (1) (2014), p. 45
View Record in ScopusGoogle Scholar[389]
B. Liu, Y. Sun, H.J. Lehmler, W. Bao
Association between urinary tin concentration and diabetes in nationally representative sample of US adults
J. Diabetes, 10 (12) (2018), pp. 977-983 View PDF
CrossRefView Record in ScopusGoogle Scholar[390]
H.J. Lehmler, M. Gadogbe, B. Liu, W. Bao
Environmental tin exposure in a nationally representative sample of U.S. adults and children: The National Health and Nutrition Examination Survey 2011–2014, Environmental pollution (Barking
Essex, 240 (2018) (1987), pp. 599-606
Google Scholar[391]National Toxicology Program (NTP), NTP research report on organotin and total tin levels in Danish women of reproductive age., NTP Research Report Series, National Toxicology Program. Research Report 2, Research Triangle Park, NC, 2016.
M. Gadogbe, W. Bao, B.R. Wels, S.Y. Dai, D.A. Santillan, M.K. Santillan, H.J. Lehmler
Levels of tin and organotin compounds in human urine samples from Iowa, United States, Journal of environmental science and health
Part A, Toxic/hazardous substances & environmental engineering, 54 (9) (2019), pp. 884-890 View PDF
CrossRefView Record in ScopusGoogle Scholar[393]
J. Xue, V. Zartarian, J. Moya, N. Freeman, P. Beamer, K. Black, N. Tulve, S. Shalat
A meta-analysis of children’s hand-to-mouth frequency data for estimating nondietary ingestion exposure
Risk analysis : an official publication of the Society for Risk Analysis, 27 (2) (2007), pp. 411-420 View PDF
CrossRefView Record in ScopusGoogle Scholar[394]
K. Hoffman, C.M. Butt, A. Chen, A.T. Limkakeng, H.M. Stapleton
High Exposure to Organophosphate Flame Retardants in Infants: Associations with Baby Products
Environ. Sci. Technol., 49 (24) (2015), pp. 14554-14559 View PDF
CrossRefView Record in ScopusGoogle Scholar[395]
K.H. Wong, T.S. Durrani
Exposures to Endocrine Disrupting Chemicals in Consumer Products-A Guide for Pediatricians
Curr Probl Pediatr Adolesc Health Care, 47 (5) (2017), pp. 107-118
ArticleDownload PDFView Record in ScopusGoogle Scholar[396]
Z. Percy, M.J. La Guardia, Y. Xu, R.C. Hale, K.N. Dietrich, B.P. Lanphear, K. Yolton, A.M. Vuong, K.M. Cecil, J.M. Braun, C. Xie, A. Chen
Concentrations and loadings of organophosphate and replacement brominated flame retardants in house dust from the home study during the PBDE phase-out
Chemosphere, 239 (2020), Article 124701
ArticleDownload PDFView Record in ScopusGoogle Scholar[397]
A.R. Zota, L. Linderholm, J.S. Park, M. Petreas, T. Guo, M.L. Privalsky, R.T. Zoeller, T.J. Woodruff
Temporal comparison of PBDEs, OH-PBDEs, PCBs, and OH-PCBs in the serum of second trimester pregnant women recruited from San Francisco General Hospital, California
Environ. Sci. Technol., 47 (20) (2013), pp. 11776-11784 View PDF
CrossRefView Record in ScopusGoogle Scholar[398]
M.A. Adgent, K. Hoffman, B.D. Goldman, A. Sjödin, J.L. Daniels
Brominated flame retardants in breast milk and behavioural and cognitive development at 36 months
Paediatr. Perinat. Epidemiol., 28 (1) (2014), pp. 48-57 View PDF
CrossRefView Record in ScopusGoogle Scholar[399]
C. Leonetti, C.M. Butt, K. Hoffman, S.C. Hammel, M.L. Miranda, H.M. Stapleton
Brominated flame retardants in placental tissues: associations with infant sex and thyroid hormone endpoints
Environ Health, 15 (1) (2016), p. 113
View Record in ScopusGoogle Scholar[400]
I. van der Veen, J. de Boer
Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis
Chemosphere, 88 (10) (2012), pp. 1119-1153
ArticleDownload PDFView Record in ScopusGoogle Scholar[401]
A. Blum, M. Behl, L.S. Birnbaum, M.L. Diamond, A. Phillips, V. Singla, N.S. Sipes, H.M. Stapleton, M. Venier
Organophosphate Ester Flame Retardants: Are They a Regrettable Substitution for Polybrominated Diphenyl Ethers?
Environ. Sci. Technol. Lett., 6 (11) (2019), pp. 638-649 View PDF
CrossRefView Record in ScopusGoogle Scholar[402]
J.D. Meeker, E.M. Cooper, H.M. Stapleton, R. Hauser
Urinary metabolites of organophosphate flame retardants: temporal variability and correlations with house dust concentrations
Environ. Health Perspect., 121 (5) (2013), pp. 580-585 View PDF
CrossRefView Record in ScopusGoogle Scholar[403]
L.V. Dishaw, L.J. Macaulay, S.C. Roberts, H.M. Stapleton
Exposures, mechanisms, and impacts of endocrine-active flame retardants
Curr. Opin. Pharmacol., 19 (2014), pp. 125-133
ArticleDownload PDFView Record in ScopusGoogle Scholar[404]
K. Hoffman, C.M. Butt, T.F. Webster, E.V. Preston, S.C. Hammel, C. Makey, A.M. Lorenzo, E.M. Cooper, C. Carignan, J.D. Meeker, R. Hauser, A. Soubry, S.K. Murphy, T.M. Price, C. Hoyo, E. Mendelsohn, J. Congleton, J.L. Daniels, H.M. Stapleton
Temporal Trends in Exposure to Organophosphate Flame Retardants in the United States
Environ. Sci. Technol. Lett., 4 (3) (2017), pp. 112-118 View PDF
CrossRefView Record in ScopusGoogle Scholar[405]
K. Hoffman, J.L. Daniels, H.M. Stapleton
Urinary metabolites of organophosphate flame retardants and their variability in pregnant women
Environ. Int., 63 (2014), pp. 169-172
ArticleDownload PDFView Record in ScopusGoogle Scholar[406]
C.C. Carignan, M.D. McClean, E.M. Cooper, D.J. Watkins, A.J. Fraser, W. Heiger-Bernays, H.M. Stapleton, T.F. Webster
Predictors of tris(1,3-dichloro-2-propyl) phosphate metabolite in the urine of office workers
Environ. Int., 55 (2013), pp. 56-61
ArticleDownload PDFView Record in ScopusGoogle Scholar[407]
L. Bastos Sales, J.H. Kamstra, P.H. Cenijn, L.S. van Rijt, T. Hamers, J. Legler
Effects of endocrine disrupting chemicals on in vitro global DNA methylation and adipocyte differentiation
Toxicol. In Vitro, 27 (6) (2013), pp. 1634-1643
ArticleDownload PDFView Record in ScopusGoogle Scholar[408]
Q. Wen, X. Xie, C. Zhao, Q. Ren, X. Zhang, D. Wei, B. Emanuelli, Y. Du
The brominated flame retardant PBDE 99 promotes adipogenesis via regulating mitotic clonal expansion and PPARγ expression
Sci. Total Environ., 670 (2019), pp. 67-77
ArticleDownload PDFView Record in ScopusGoogle Scholar[409]
J.H. Kamstra, E. Hruba, B. Blumberg, A. Janesick, S. Mandrup, T. Hamers, J. Legler
Transcriptional and epigenetic mechanisms underlying enhanced in vitro adipocyte differentiation by the brominated flame retardant BDE-47
Environ. Sci. Technol., 48 (7) (2014), pp. 4110-4119 View PDF
CrossRefView Record in ScopusGoogle Scholar[410]
C. Yang, C.M. Wong, J. Wei, A.C.K. Chung, Z. Cai
The brominated flame retardant BDE 47 upregulates purine metabolism and mitochondrial respiration to promote adipocyte differentiation
Sci. Total Environ., 644 (2018), pp. 1312-1322
ArticleDownload PDFView Record in ScopusGoogle Scholar[411]
S. Karandrea, H. Yin, X. Liang, E.A. Heart
BDE-47 and BDE-85 stimulate insulin secretion in INS-1 832/13 pancreatic β-cells through the thyroid receptor and Akt
Environ. Toxicol. Pharmacol., 56 (May) (2017), pp. 29-34
ArticleDownload PDFView Record in ScopusGoogle Scholar[412]
H. Gao, P. Li, L. Liu, K. Yang, B. Xiao, G. Zhou, Z. Tian, C. Luo, T. Xia, L. Dong, Q. Zhao, A. Wang, S. Zhang
Perigestational low-dose BDE-47 exposure alters maternal serum metabolome and results in sex-specific weight gain in adult offspring
Chemosphere, 233 (2019), pp. 174-182
ArticleDownload PDFView Record in ScopusGoogle Scholar[413]
A. Suvorov, M.C. Battista, L. Takser
Perinatal exposure to low-dose 2,2′,4,4′-tetrabromodiphenyl ether affects growth in rat offspring: what is the role of IGF-1?
Toxicology, 260 (1–3) (2009), pp. 126-131
ArticleDownload PDFView Record in ScopusGoogle Scholar[414]
A. Abrha, A. Suvorov
Transcriptomic Analysis of Gonadal Adipose Tissue in Male Mice Exposed Perinatally to 2,2′,4,4′-Tetrabromodiphenyl Ether (BDE-47)
Toxics, 6 (2) (2018), p. 21 View PDF
CrossRefView Record in ScopusGoogle Scholar[415]
D. Wang, W. Zhu, L. Chen, J. Yan, M. Teng, Z. Zhou
Neonatal triphenyl phosphate and its metabolite diphenyl phosphate exposure induce sex- and dose-dependent metabolic disruptions in adult mice
Environ. Pollut., 237 (2018), pp. 10-17
ArticleDownload PDFGoogle Scholar[416]R. Yanagisawa, E. Koike, T.T. Win-Shwe, H. Takano, Decabromodiphenyl ether exacerbates hyperglycemia in diet-induced obese mice, Toxicology 412(November 2018) (2019) 12-18.
Z. Zhang, S. Li, L. Liu, L. Wang, X. Xiao, Z. Sun, X. Wang, C. Wang, M. Wang, L. Li, Q. Xu, W. Gao, S.L. Wang
Environmental exposure to BDE47 is associated with increased diabetes prevalence: Evidence from community-based case-control studies and an animal experiment
Sci. Rep., 6 (May) (2016), pp. 1-9
ArticleDownload PDFGoogle Scholar[418]
D.K. Scoville, C.Y. Li, D. Wang, J.L. Dempsey, D. Raftery, S. Mani, H. Gu, J.Y. Cui
Polybrominated diphenyl ethers and gut microbiome modulate metabolic syndrome-related aqueous metabolites in mice
Drug Metab. Dispos., 47 (8) (2019), pp. 928-940 View PDF
CrossRefView Record in ScopusGoogle Scholar[419]
D.S. Drage, A.L. Heffernan, T.K. Cunningham, L.L. Aylward, J.F. Mueller, T. Sathyapalan, S.L. Atkin
Serum measures of hexabromocyclododecane (HBCDD) and polyborminated diphenyl ethers (PBDEs) in reproductive-aged women in the United Kingdom
Environ. Res., 177 (July) (2019), p. 108631
ArticleDownload PDFView Record in ScopusGoogle Scholar[420]
S. Cordier, E. Anassour-Laouan-Sidi, M. Lemire, N. Costet, M. Lucas, P. Ayotte
Association between exposure to persistent organic pollutants and mercury, and glucose metabolism in two Canadian Indigenous populations
Environ. Res., 184 (February) (2020)
A. Erkin-Cakmak, K.G. Harley, J. Chevrier, A. Bradman, K. Kogut, K. Huen, B. Eskenazi
In utero and childhood polybrominated diphenyl ether exposures and body mass at age 7 years: the CHAMACOS study
Environ. Health Perspect., 123 (6) (2015), pp. 636-642 View PDF
CrossRefView Record in ScopusGoogle Scholar[422]
J. Guo, W. Miao, C. Wu, J. Zhang, X. Qi, H. Yu, X. Chang, Y. Zhang, Z. Zhou
Umbilical cord serum PBDE concentrations and child adiposity measures at 7 years
Ecotoxicol. Environ. Saf., 203 (July) (2020), p. 111009
ArticleDownload PDFView Record in ScopusGoogle Scholar[423]
A.M. Vuong, J.M. Braun, Z. Wang, K. Yolton, C. Xie, A. Sjodin, G.M. Webster, B.P. Lanphear, A. Chen
Exposure to polybrominated diphenyl ethers (PBDEs) during childhood and adiposity measures at age 8years
Environ. Int., 123 (2019), pp. 148-155
ArticleDownload PDFView Record in ScopusGoogle Scholar[424]
G. Cano-Sancho, A. Smith, M.A. La Merrill
Triphenyl phosphate enhances adipogenic differentiation, glucose uptake and lipolysis via endocrine and noradrenergic mechanisms
Toxicol. In Vitro, 40 (2017), pp. 280-288
ArticleDownload PDFView Record in ScopusGoogle Scholar[425]
Z. Hao, Z. Zhang, D. Lu, B. Ding, L. Shu, Q. Zhang, C. Wang
Organophosphorus Flame Retardants Impair Intracellular Lipid Metabolic Function in Human Hepatocellular Cells
Chem. Res. Toxicol., 32 (6) (2019), pp. 1250-1258 View PDF
CrossRefView Record in ScopusGoogle Scholar[426]S.N. Walley, T.A. Roepke, Perinatal exposure to endocrine disrupting compounds and the control of feeding behavior — An overview, Hormones and Behavior 101(November 2017) (2018) 22-28.
G.M. Vail, T.A. Roepke
Organophosphate Flame Retardants Excite Arcuate Melanocortin Circuitry and Increase Neuronal Sensitivity to Ghrelin in Adult Mice
Endocrinology, 161 (11) (2020), pp. 1-19
S. Kim, N. Rabhi, B.C. Blum, R. Hekman, K. Wynne, A. Emili, S. Farmer, J.J. Schlezinger
Triphenyl phosphate is a selective PPARγ modulator that does not induce brite adipogenesis in vitro and in vivo
Arch. Toxicol., 94 (9) (2020), pp. 3087-3103 View PDF
CrossRefView Record in ScopusGoogle Scholar[429]
Z. Du, Y. Zhang, G. Wang, J. Peng, Z. Wang, S. Gao
TPhP exposure disturbs carbohydrate metabolism, lipid metabolism, and the DNA damage repair system in zebrafish liver
Sci. Rep., 6 (February) (2016), pp. 1-10 View PDF
A. Farhat, J.K. Buick, A. Williams, C.L. Yauk, J.M. O’Brien, D. Crump, K.L. Williams, S. Chiu, S.W. Kennedy
Tris(1,3-dichloro-2-propyl) phosphate perturbs the expression of genes involved in immune response and lipid and steroid metabolism in chicken embryos
Toxicol. Appl. Pharmacol., 275 (2) (2014), pp. 104-112
ArticleDownload PDFView Record in ScopusGoogle Scholar[431]
C. Wang, Y. Le, D. Lu, M. Zhao, X. Dou, Q. Zhang
Triphenyl phosphate causes a sexually dimorphic metabolism dysfunction associated with disordered adiponectin receptors in pubertal mice
J. Hazard. Mater., 388 (2020), p. 121732
ArticleDownload PDFView Record in ScopusGoogle Scholar[432]
P.J. Morris, D. Medina-Cleghorn, A. Heslin, S.M. King, J. Orr, M.M. Mulvihill, R.M. Krauss, D.K. Nomura
Organophosphorus flame retardants inhibit specific liver carboxylesterases and cause serum hypertriglyceridemia
ACS Chem. Biol., 9 (5) (2014), pp. 1097-1103 View PDF
CrossRefView Record in ScopusGoogle Scholar[433]
M.G. Wade, A. Kawata, M. Rigden, D. Caldwell, A.C. Holloway
Toxicity of Flame Retardant Isopropylated Triphenyl Phosphate: Liver
Adrenal, and Metabolic Effects, International journal of toxicology, 38 (4) (2019), pp. 279-290 View PDF
CrossRefView Record in ScopusGoogle Scholar[434]
E.A. Krumm, V.J. Patel, T.S. Tillery, A. Yasrebi, J. Shen, G.L. Guo, S.M. Marco, B.T. Buckley, T.A. Roepke
Organophosphate Flame-Retardants Alter Adult Mouse Homeostasis and Gene Expression in a Sex-Dependent Manner Potentially Through Interactions With ERα
Toxicol. Sci., 162 (1) (2018), pp. 212-224 View PDF
CrossRefView Record in ScopusGoogle Scholar[435]
G.M. Vail, S.N. Walley, A. Yasrebi, A. Maeng, K. Conde, T.A. Roepke
The interactions of diet-induced obesity and organophosphate flame retardant exposure on energy homeostasis in adult male and female mice
Journal of Toxicology and Environmental Health, Part A, 83 (11–12) (2020), pp. 438-455 View PDF
CrossRefView Record in ScopusGoogle Scholar[436]S. Yan, D. Wang, M. Teng, Z. Meng, J. Yan, R. Li, M. Jia, S. Tian, Z. Zhou, W. Zhu, Perinatal exposure to 2-Ethylhexyl Diphenyl Phosphate (EHDPHP) affected the metabolic homeostasis of male mouse offspring: Unexpected findings help to explain dose- and diet- specific phenomena, Journal of hazardous materials 388(September 2019) (2020) 122034-122034.
H.B. Patisaul, S.C. Roberts, N. Mabrey, K.A. McCaffrey, R.B. Gear, J. Braun, S.M. Belcher, H.M. Stapleton
Accumulation and endocrine disrupting effects of the flame retardant mixture Firemaster(R) 550 in rats: an exploratory assessment
J. Biochem. Mol. Toxicol., 27 (2) (2013), pp. 124-136 View PDF
CrossRefView Record in ScopusGoogle Scholar[438]S.K. Witchey, L. Al Samara, B.M. Horman, H.M. Stapleton, H.B. Patisaul, Perinatal exposure to FireMaster® 550 (FM550), brominated or organophosphate flame retardants produces sex and compound specific effects on adult Wistar rat socioemotional behavior, Hormones and Behavior 126(September) (2020) 104853-104853.
D. Wang, S. Yan, J. Yan, M. Teng, Z. Meng, R. Li, Z. Zhou, W. Zhu
Effects of triphenyl phosphate exposure during fetal development on obesity and metabolic dysfunctions in adult mice: Impaired lipid metabolism and intestinal dysbiosis
Environ. Pollut., 246 (2019), pp. 630-638
ArticleDownload PDFView Record in ScopusGoogle Scholar[440]
N.A. Philbrook, V.E. Restivo, C.L. Belanger, L.M. Winn
Gestational triphenyl phosphate exposure in C57Bl/6 mice perturbs expression of insulin-like growth factor signaling genes in maternal and fetal liver
Birth defects research, 110 (6) (2018), pp. 483-494 View PDF
CrossRefView Record in ScopusGoogle Scholar[441]
S.N. Walley, E.A. Krumm, A. Yasrebi, J. Kwiecinski, V. Wright, C. Baker, T.A. Roepke
Maternal organophosphate flame-retardant exposure alters offspring energy and glucose homeostasis in a sexually dimorphic manner in mice
J. Appl. Toxicol. (2020), pp. 1-15
View Record in ScopusGoogle Scholar[442]
D. Luo, W. Liu, Y. Tao, L. Wang, M. Yu, L. Hu, A. Zhou, A. Covaci, W. Xia, Y. Li, S. Xu, S. Mei
Prenatal Exposure to Organophosphate Flame Retardants and the Risk of Low Birth Weight: A Nested Case-Control Study in China
Environ. Sci. Technol., 54 (6) (2020), pp. 3375-3385 View PDF
CrossRefView Record in ScopusGoogle Scholar[443]M. Boyle, J.P. Buckley, L. Quirós-Alcalá, Associations between urinary organophosphate ester metabolites and measures of adiposity among U.S. children and adults: NHANES 2013–2014, Environment International 127(March) (2019) 754-763.
J.R. Kuiper, H.M. Stapleton, M. Wills-Karp, X. Wang, I. Burd, J.P. Buckley
Predictors and reproducibility of urinary organophosphate ester metabolite concentrations during pregnancy and associations with birth outcomes in an urban population
Environmental health : a global access science source, 19 (1) (2020), p. 55
View Record in ScopusGoogle Scholar[445]
K.A. Crawford, N. Hawley, A.M. Calafat, N.K. Jayatilaka, R.J. Froehlich, P. Has, L.G. Gallagher, D.A. Savitz, J.M. Braun, E.F. Werner, M.E. Romano
Maternal urinary concentrations of organophosphate ester metabolites: associations with gestational weight gain, early life anthropometry, and infant eating behaviors among mothers-infant pairs in Rhode Island
Environmental health : a global access science source, 19 (1) (2020), p. 97
View Record in ScopusGoogle Scholar[446]
H. Pinos, B. Carrillo, A. Merchán, J. Biosca-Brull, C. Pérez-Fernández, M.T. Colomina, F. Sánchez-Santed, F. Martín-Sánchez, P. Collado, J.L. Arias, N.M. Conejo
Relationship between Prenatal or Postnatal Exposure to Pesticides and Obesity: A Systematic Review
Int. J. Environ. Res. Public Health, 18 (13) (2021)
J.J. Heindel, L.A. Skalla, B.R. Joubert, C.H. Dilworth, K.A. Gray
Review of developmental origins of health and disease publications in environmental epidemiology
Reprod. Toxicol., 68 (2017), pp. 34-48
ArticleDownload PDFView Record in ScopusGoogle Scholar[448]
X.M. Ren, Y. Kuo, B. Blumberg
Agrochemicals and obesity
Mol. Cell. Endocrinol., 515 (2020), Article 110926
ArticleDownload PDFView Record in ScopusGoogle Scholar[449]
H. van den Berg
Global status of DDT and its alternatives for use in vector control to prevent disease
Environ. Health Perspect., 117 (11) (2009), pp. 1656-1663 View PDF
CrossRefView Record in ScopusGoogle Scholar[450]
A. Enayati, J. Hemingway
Malaria management: past, present, and future
Annu. Rev. Entomol., 55 (2010), pp. 569-591 View PDF
CrossRefView Record in ScopusGoogle Scholar[451]A.f.T.S.a.D.R. (ATSDR), Toxicological profile for DDT, DDE, and DDD, in: D.o.H.a.H. Services (Ed.) Atlanta, GA, 2002.
N.A. Chapados, C. Casimiro, M.A. Robidoux, F. Haman, M. Batal, J.M. Blais, P. Imbeault
Increased proliferative effect of organochlorine compounds on human preadipocytes
Mol. Cell. Biochem., 365 (1–2) (2012), pp. 275-278 View PDF
CrossRefView Record in ScopusGoogle Scholar[453]
M.M. Ibrahim, E. Fjaere, E.J. Lock, D. Naville, H. Amlund, E. Meugnier, B. Le Magueresse Battistoni, L. Froyland, L. Madsen, N. Jessen, S. Lund, H. Vidal, J. Ruzzin
Chronic consumption of farmed salmon containing persistent organic pollutants causes insulin resistance and obesity in mice
PLoS ONE, 6 (9) (2011), Article e25170 View PDF
CrossRefView Record in ScopusGoogle Scholar[454]
L.H. Mangum, G.E. Howell 3rd, J.E. Chambers
Exposure to p, p’-DDE enhances differentiation of 3T3-L1 preadipocytes in a model of sub-optimal differentiation
Toxicol. Lett., 238 (2) (2015), pp. 65-71
ArticleDownload PDFView Record in ScopusGoogle Scholar[455]
J. Kim, Q. Sun, Y. Yue, K.S. Yoon, K.Y. Whang, J. Marshall Clark, Y. Park
4,4′-Dichlorodiphenyltrichloroethane (DDT) and 4,4′-dichlorodiphenyldichloroethylene (DDE) promote adipogenesis in 3T3-L1 adipocyte cell culture
Pestic. Biochem. Physiol., 131 (2016), pp. 40-45
ArticleDownload PDFView Record in ScopusGoogle Scholar[456]
M.J. Moreno-Aliaga, F. Matsumura
Effects of 1,1,1-trichloro-2,2-bis(p-chlorophenyl)-ethane (p, p’-DDT) on 3T3-L1 and 3T3-F442A adipocyte differentiation
Biochem. Pharmacol., 63 (5) (2002), pp. 997-1007
ArticleDownload PDFView Record in ScopusGoogle Scholar[457]
A.L. Strong, Z. Shi, M.J. Strong, D.F. Miller, D.B. Rusch, A.M. Buechlein, E.K. Flemington, J.A. McLachlan, K.P. Nephew, M.E. Burow, B.A. Bunnell
Effects of the endocrine-disrupting chemical DDT on self-renewal and differentiation of human mesenchymal stem cells
Environ. Health Perspect., 123 (1) (2015), pp. 42-48
G. Howell 3rd, L. Mangum
Exposure to bioaccumulative organochlorine compounds alters adipogenesis, fatty acid uptake, and adipokine production in NIH3T3-L1 cells
Toxicol. In Vitro, 25 (1) (2011), pp. 394-402
ArticleDownload PDFView Record in ScopusGoogle Scholar[459]
C. Taxvig, K. Dreisig, J. Boberg, C. Nellemann, A.B. Schelde, D. Pedersen, M. Boergesen, S. Mandrup, A.M. Vinggaard
Differential effects of environmental chemicals and food contaminants on adipogenesis, biomarker release and PPARgamma activation
Mol. Cell. Endocrinol., 361 (1–2) (2012), pp. 106-115
ArticleDownload PDFView Record in ScopusGoogle Scholar[460]
M. La Merrill, E. Karey, E. Moshier, C. Lindtner, M.R. La Frano, J.W. Newman, C. Buettner
Perinatal exposure of mice to the pesticide DDT impairs energy expenditure and metabolism in adult female offspring
PLoS ONE, 9 (7) (2014), Article e103337 View PDF
CrossRefView Record in ScopusGoogle Scholar[461]
G. Cano-Sancho, A.G. Salmon, M.A. La Merrill
Association between Exposure to p, p’-DDT and Its Metabolite p, p’-DDE with Obesity: Integrated Systematic Review and Meta-Analysis
Environ. Health Perspect., 125 (9) (2017), Article 096002 View PDF
CrossRefView Record in ScopusGoogle Scholar[462]
V. Mustieles, J.P. Arrebola
How polluted is your fat?
What the study of adipose tissue can contribute to environmental epidemiology, J Epidemiol Community Health, 74 (5) (2020), pp. 401-407 View PDF
CrossRefView Record in ScopusGoogle Scholar[463]
W. Dhooge, E. Den Hond, G. Koppen, L. Bruckers, V. Nelen, E. Van De Mieroop, M. Bilau, K. Croes, W. Baeyens, G. Schoeters, N. Van Larebeke
Internal exposure to pollutants and body size in Flemish adolescents and adults: associations and dose-response relationships
Environ. Int., 36 (4) (2010), pp. 330-337
ArticleDownload PDFView Record in ScopusGoogle Scholar[464]
J.P. Arrebola, R. Ocana-Riola, A.L. Arrebola-Moreno, M. Fernandez-Rodriguez, P. Martin-Olmedo, M.F. Fernandez, N. Olea
Associations of accumulated exposure to persistent organic pollutants with serum lipids and obesity in an adult cohort from Southern Spain, Environmental pollution (Barking
Essex, 195 (2014) (1987), pp. 9-15
J.P. Arrebola, M. Cuellar, E. Claure, M. Quevedo, S.R. Antelo, E. Mutch, E. Ramirez, M.F. Fernandez, N. Olea, L.A. Mercado
Concentrations of organochlorine pesticides and polychlorinated biphenyls in human serum and adipose tissue from Bolivia
Environ. Res., 112 (2012), pp. 40-47
ArticleDownload PDFView Record in ScopusGoogle Scholar[466]
M.A. Elobeid, M.A. Padilla, D.W. Brock, D.M. Ruden, D.B. Allison
Endocrine disruptors and obesity: an examination of selected persistent organic pollutants in the NHANES 1999–2002 data
Int. J. Environ. Res. Public Health, 7 (7) (2010), pp. 2988-3005 View PDF
CrossRefView Record in ScopusGoogle Scholar[467]
V. Roos, M. Ronn, S. Salihovic, L. Lind, B. van Bavel, J. Kullberg, L. Johansson, H. Ahlstrom, P.M. Lind
Circulating levels of persistent organic pollutants in relation to visceral and subcutaneous adipose tissue by abdominal MRI
Obesity (Silver Spring), 21 (2) (2013), pp. 413-418 View PDF
CrossRefView Record in ScopusGoogle Scholar[468]
M. Ronn, L. Lind, B. van Bavel, S. Salihovic, K. Michaelsson, P.M. Lind
Circulating levels of persistent organic pollutants associate in divergent ways to fat mass measured by DXA in humans
Chemosphere, 85 (3) (2011), pp. 335-343
ArticleDownload PDFView Record in ScopusGoogle Scholar[469]
S. Ben Hassine, B. Hammami, W. Ben Ameur, Y. El Megdiche, B. Barhoumi, R. El Abidi, M.R. Driss
Concentrations of organochlorine pesticides and polychlorinated biphenyls in human serum and their relation with age, gender, and BMI for the general population of Bizerte, Tunisia
Environ. Sci. Pollut. Res. Int., 21 (10) (2014), pp. 6303-6313 View PDF
CrossRefView Record in ScopusGoogle Scholar[470]
G. Zong, P. Grandjean, H. Wu, Q. Sun
Circulating persistent organic pollutants and body fat distribution: Evidence from NHANES 1999–2004
Obesity (Silver Spring), 23 (9) (2015), pp. 1903-1910 View PDF
CrossRefView Record in ScopusGoogle Scholar[471]
E. Dirinck, P.G. Jorens, A. Covaci, T. Geens, L. Roosens, H. Neels, I. Mertens, L. Van Gaal
Obesity and persistent organic pollutants: possible obesogenic effect of organochlorine pesticides and polychlorinated biphenyls
Obesity (Silver Spring), 19 (4) (2011), pp. 709-714 View PDF
CrossRefView Record in ScopusGoogle Scholar[472]
M.S. Wolff, H.A. Anderson, J.A. Britton, N. Rothman
Pharmacokinetic variability and modern epidemiology–the example of dichlorodiphenyltrichloroethane, body mass index, and birth cohort
Cancer Epidemiol Biomarkers Prev, 16 (10) (2007), pp. 1925-1930
View Record in ScopusGoogle Scholar[473]
D.H. Lee, L. Lind, D.R. Jacobs Jr., S. Salihovic, B. van Bavel, P.M. Lind
Associations of persistent organic pollutants with abdominal obesity in the elderly: The Prospective Investigation of the Vasculature in Uppsala Seniors (PIVUS) study
Environ. Int., 40 (2012), pp. 170-178
ArticleDownload PDFView Record in ScopusGoogle Scholar[474]
D.H. Lee, M.W. Steffes, A. Sjodin, R.S. Jones, L.L. Needham, D.R. Jacobs Jr.
Low dose organochlorine pesticides and polychlorinated biphenyls predict obesity, dyslipidemia, and insulin resistance among people free of diabetes
PLoS ONE, 6 (1) (2011), Article e15977 View PDF
CrossRefView Record in ScopusGoogle Scholar[475]
L. Plouffe, D. Bosson-Rieutort, L. Madaniyazi, M. Iwai-Shimada, K. Nakai, N. Tatsuta, S.F. Nakayama, M.-A. Verner
Estimated postnatal p, p’-DDT and p, p’-DDE levels and body mass index at 42 months of age in a longitudinal study of Japanese children
Environmental Health, 19 (1) (2020), p. 49
View Record in ScopusGoogle Scholar[476]
D. Valvi, M.A. Mendez, D. Martinez, J.O. Grimalt, M. Torrent, J. Sunyer, M. Vrijheid
Prenatal concentrations of polychlorinated biphenyls, DDE, and DDT and overweight in children: a prospective birth cohort study
Environ. Health Perspect., 120 (3) (2012), pp. 451-457
View Record in ScopusGoogle Scholar[477]
E. Coker, J. Chevrier, S. Rauch, A. Bradman, M. Obida, M. Crause, R. Bornman, B. Eskenazi
Association between prenatal exposure to multiple insecticides and child body weight and body composition in the VHEMBE South African birth cohort
Environ. Int., 113 (2018), pp. 122-132
ArticleDownload PDFView Record in ScopusGoogle Scholar[478]
M. Warner, S. Rauch, E.S. Coker, K. Harley, K. Kogut, A. Sjödin, B. Eskenazi
Obesity in relation to serum persistent organic pollutant concentrations in CHAMACOS women
Environmental Epidemiology, 2 (4) (2018), p. e032 View PDF
CrossRefView Record in ScopusGoogle Scholar[479]
B. Heggeseth, K. Harley, M. Warner, N. Jewell, B. Eskenazi
Detecting Associations between Early-Life DDT Exposures and Childhood Growth Patterns: A Novel Statistical Approach
PLoS ONE, 10 (6) (2015), p. e0131443 View PDF
CrossRefView Record in ScopusGoogle Scholar[480]
I. Delvaux, J. Van Cauwenberghe, E. Den Hond, G. Schoeters, E. Govarts, V. Nelen, W. Baeyens, N. Van Larebeke, I. Sioen
Prenatal exposure to environmental contaminants and body composition at age 7–9 years
Environ. Res., 132 (2014), pp. 24-32
ArticleDownload PDFView Record in ScopusGoogle Scholar[481]
N. Iszatt, H. Stigum, M.-A. Verner, R.A. White, E. Govarts, L.P. Murinova, G. Schoeters, T. Trnovec, J. Legler, F. Pelé, J. Botton, C. Chevrier, J. Wittsiepe, U. Ranft, S. Vandentorren, M. Kasper-Sonnenberg, C. Klümper, N. Weisglas-Kuperus, A. Polder, M. Eggesbø
Obelix, Prenatal and Postnatal Exposure to Persistent Organic Pollutants and Infant Growth: A Pooled Analysis of Seven European Birth Cohorts
Environ. Health Perspect., 123 (7) (2015), pp. 730-736 View PDF
CrossRefView Record in ScopusGoogle Scholar[482]
M. Vafeiadi, V. Georgiou, G. Chalkiadaki, P. Rantakokko, H. Kiviranta, M. Karachaliou, E. Fthenou, M. Venihaki, K. Sarri, M. Vassilaki, S.A. Kyrtopoulos, E. Oken, M. Kogevinas, L. Chatzi
Association of Prenatal Exposure to Persistent Organic Pollutants with Obesity and Cardiometabolic Traits in Early Childhood: The Rhea Mother-Child Cohort (Crete, Greece)
Environ. Health Perspect., 123 (10) (2015), pp. 1015-1021
View Record in ScopusGoogle Scholar[483]M.A. La Merrill, N.Y. Krigbaum, P.M. Cirillo, B.A. Cohn, Association between maternal exposure to the pesticide dichlorodiphenyltrichloroethane (DDT) and risk of obesity in middle age, International journal of obesity (2005) 44(8) (2020) 1723-1732.
P.M. Cirillo, M.A. La Merrill, N.Y. Krigbaum, B.A. Cohn
Grandmaternal Perinatal Serum DDT in Relation to Granddaughter Early Menarche and Adult Obesity: Three Generations in the Child Health and Development Studies Cohort
Cancer Epidemiol. Biomark. Prev., 8 (2021), pp. 1480-1488 View PDF
CrossRefView Record in ScopusGoogle Scholar[485]
L.A. Cupul-Uicab, M.A. Klebanoff, J.W. Brock, M.P. Longnecker
Prenatal Exposure to Persistent Organochlorines and Childhood Obesity in the U.S. Collaborative Perinatal Project
Environ. Health Perspect., 121 (9) (2013), pp. 1103-1109 View PDF
CrossRefView Record in ScopusGoogle Scholar[486]
S. Garced, L. Torres-Sanchez, M.E. Cebrian, L. Claudio, L. Lopez-Carrillo
Prenatal dichlorodiphenyldichloroethylene (DDE) exposure and child growth during the first year of life
Environ. Res., 113 (2012), pp. 58-62
ArticleDownload PDFView Record in ScopusGoogle Scholar[487]
B.B. Hoyer, C.H. Ramlau-Hansen, M. Vrijheid, D. Valvi, H.S. Pedersen, V. Zviezdai, B.A. Jonsson, C.H. Lindh, J.P. Bonde, G. Toft
Anthropometry in 5- to 9-Year-Old Greenlandic and Ukrainian Children in Relation to Prenatal Exposure to Perfluorinated Alkyl Substances
Environ. Health Perspect., 123 (8) (2015), pp. 841-846 View PDF
CrossRefView Record in ScopusGoogle Scholar[488]
H.B. Lauritzen, T.L. Larose, T. Oien, T.M. Sandanger, J.O. Odland, M. van de Bor, G.W. Jacobsen
Prenatal exposure to persistent organic pollutants and child overweight/obesity at 5-year follow-up: a prospective cohort study
Environ Health, 17 (1) (2018), p. 9
View Record in ScopusGoogle Scholar[489]
H.A. Lee, S.H. Park, Y.S. Hong, E.H. Ha, H. Park
The Effect of Exposure to Persistent Organic Pollutants on Metabolic Health among KOREAN Children during a 1-Year Follow-Up
Int. J. Environ. Res. Public Health, 13 (3) (2016)
M. Karlsen, P. Grandjean, P. Weihe, U. Steuerwald, Y. Oulhote, D. Valvi
Early-life exposures to persistent organic pollutants in relation to overweight in preschool children
Reprod. Toxicol., 68 (2017), pp. 145-153
ArticleDownload PDFView Record in ScopusGoogle Scholar[491]
S.L. Verhulst, V. Nelen, E.D. Hond, G. Koppen, C. Beunckens, C. Vael, G. Schoeters, K. Desager
Intrauterine exposure to environmental pollutants and body mass index during the first 3 years of life
Environ. Health Perspect., 117 (1) (2009), pp. 122-126
View Record in ScopusGoogle Scholar[492]
M.A. Mendez, R. Garcia-Esteban, M. Guxens, M. Vrijheid, M. Kogevinas, F. Goni, S. Fochs, J. Sunyer
Prenatal organochlorine compound exposure, rapid weight gain, and overweight in infancy
Environ. Health Perspect., 119 (2) (2011), pp. 272-278 View PDF
CrossRefView Record in ScopusGoogle Scholar[493]
T.A. Jusko, T.D. Koepsell, R.J. Baker, T.A. Greenfield, E.J. Willman, M.J. Charles, S.W. Teplin, H. Checkoway, I. Hertz-Picciotto
Maternal DDT exposures in relation to fetal and 5-year growth, Epidemiology (Cambridge
Mass.), 17 (6) (2006), pp. 692-700 View PDF
CrossRefView Record in ScopusGoogle Scholar[494]
F. Artacho-Cordón, M. Fernández-Rodríguez, C. Garde, E. Salamanca, L.M. Iribarne-Durán, P. Torné, J. Expósito, L. Papay-Ramírez, M.F. Fernández, N. Olea, J.P. Arrebola
Serum and adipose tissue as matrices for assessment of exposure to persistent organic pollutants in breast cancer patients
Environ. Res., 142 (2015), pp. 633-643
ArticleDownload PDFView Record in ScopusGoogle Scholar[495]
W. Karmaus, X. Zhu
Maternal concentration of polychlorinated biphenyls and dichlorodiphenyl dichlorethylene and birth weight in Michigan fish eaters: a cohort study
Environ Health, 3 (1) (2004), p. 1
View Record in ScopusGoogle Scholar[496]
A.E. Brodie, V.A. Azarenko, C.Y. Hu
Inhibition of increases of transcription factor mRNAs during differentiation of primary rat adipocytes by in vivo 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) treatment
Toxicol. Lett., 90 (2–3) (1997), pp. 91-95
ArticleDownload PDFView Record in ScopusGoogle Scholar[497]
M.A. Cimafranca, P.R. Hanlon, C.R. Jefcoate
TCDD administration after the pro-adipogenic differentiation stimulus inhibits PPARgamma through a MEK-dependent process but less effectively suppresses adipogenesis
Toxicol. Appl. Pharmacol., 196 (1) (2004), pp. 156-168
ArticleDownload PDFView Record in ScopusGoogle Scholar[498]
H. Nagashima, F. Matsumura
2,3,7,8-Tetrachlorodibenzo-p-dioxin (TCDD)-induced down-regulation of glucose transporting activities in mouse 3T3-L1 preadipocyte, Journal of environmental science and health
Part. B, Pesticides, food contaminants, and agricultural wastes, 37 (1) (2002), pp. 1-14
View Record in ScopusGoogle Scholar[499]
G. Gadupudi, F.A. Gourronc, G. Ludewig, L.W. Robertson, A.J. Klingelhutz
PCB126 inhibits adipogenesis of human preadipocytes
Toxicol. In Vitro, 29 (1) (2015), pp. 132-141
ArticleDownload PDFView Record in ScopusGoogle Scholar[500]
F.A. Gourronc, G.H. Perdew, L.W. Robertson, A.J. Klingelhutz
PCB126 blocks the thermogenic beiging response of adipocytes
Environ. Sci. Pollut. Res. Int., 27 (9) (2020), pp. 8897-8904 View PDF
CrossRefView Record in ScopusGoogle Scholar[501]
V. Arsenescu, R.I. Arsenescu, V. King, H. Swanson, L.A. Cassis
Polychlorinated Biphenyl-77 Induces Adipocyte Differentiation and Proinflammatory Adipokines and Promotes Obesity and Atherosclerosis
Environ. Health Perspect., 116 (6) (2008), pp. 761-768 View PDF
CrossRefView Record in ScopusGoogle Scholar[502]
L. Zhang, E. Hatzakis, R.G. Nichols, R. Hao, J. Correll, P.B. Smith, C.R. Chiaro, G.H. Perdew, A.D. Patterson
Metabolomics Reveals that Aryl Hydrocarbon Receptor Activation by Environmental Chemicals Induces Systemic Metabolic Dysfunction in Mice
Environ. Sci. Technol., 49 (13) (2015), pp. 8067-8077 View PDF
CrossRefView Record in ScopusGoogle Scholar[503]
A. Korecka, A. Dona, S. Lahiri, A.J. Tett, M. Al-Asmakh, V. Braniste, R. D’Arienzo, A. Abbaspour, N. Reichardt, Y. Fujii-Kuriyama, J. Rafter, A. Narbad, E. Holmes, J. Nicholson, V. Arulampalam, S. Pettersson
Bidirectional communication between the Aryl hydrocarbon Receptor (AhR) and the microbiome tunes host metabolism
npj Biofilms Microbiomes, 2 (2016), p. 16014
View Record in ScopusGoogle Scholar[504]
K.M. Brawner, V.A. Yeramilli, L.W. Duck, W. Van Der Pol, L.E. Smythies, C.D. Morrow, C.O. Elson, C.A. Martin
Depletion of dietary aryl hydrocarbon receptor ligands alters microbiota composition and function
Sci. Rep., 9 (1) (2019), p. 14724
View Record in ScopusGoogle Scholar[505]
N.G. Girer, C.R. Tomlinson, C.J. Elferink
The Aryl Hydrocarbon Receptor in Energy Balance: The Road from Dioxin-Induced Wasting Syndrome to Combating Obesity with Ahr Ligands
Int. J. Mol. Sci., 22 (1) (2020)
C. Duval, F. Teixeira-Clerc, A.F. Leblanc, S. Touch, C. Emond, M. Guerre-Millo, S. Lotersztajn, R. Barouki, M. Aggerbeck, X. Coumoul
Chronic Exposure to Low Doses of Dioxin Promotes Liver Fibrosis Development in the C57BL/6J Diet-Induced Obesity Mouse Model
Environ. Health Perspect., 125 (3) (2017), pp. 428-436
View Record in ScopusGoogle Scholar[507]
L.W. Weber, M. Lebofsky, B.U. Stahl, J.R. Gorski, G. Muzi, K. Rozman
Reduced activities of key enzymes of gluconeogenesis as possible cause of acute toxicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) in rats
Toxicology, 66 (2) (1991), pp. 133-144
ArticleDownload PDFView Record in ScopusGoogle Scholar[508]
I.Y. Rojas, B.J. Moyer, C.S. Ringelberg, O.M. Wilkins, D.B. Pooler, D.B. Ness, S. Coker, T.D. Tosteson, L.D. Lewis, M.D. Chamberlin, C. Tomlinson
Kynurenine-Induced Aryl Hydrocarbon Receptor Signaling in Mice Causes Body Mass Gain, Liver Steatosis, and Hyperglycemia
Obesity (Silver Spring), 29 (2) (2021), pp. 337-349 View PDF
CrossRefView Record in ScopusGoogle Scholar[509]
M.P. Hoyeck, R.C. Merhi, H.L. Blair, C.D. Spencer, M.A. Payant, D.I. Martin Alfonso, M. Zhang, G. Matteo, M.J. Chee, J.E. Bruin
Female mice exposed to low doses of dioxin during pregnancy and lactation have increased susceptibility to diet-induced obesity and diabetes
Molecular metabolism, 42 (2020), Article 101104
ArticleDownload PDFView Record in ScopusGoogle Scholar[510]
A. Brulport, L. Le Corre, M.-C. Chagnon
Chronic exposure of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) induces an obesogenic effect in C57BL/6J mice fed a high fat diet
Toxicology, 390 (2017), pp. 43-52
ArticleDownload PDFView Record in ScopusGoogle Scholar[511]
M.L. Merrill, B.S. Kuruvilla, D. Pomp, L.S. Birnbaum, D.W. Threadgill
Dietary Fat Alters Body Composition, Mammary Development, and Cytochrome P450 Induction after Maternal TCDD Exposure in DBA/2J Mice with Low-Responsive Aryl Hydrocarbon Receptors
Environ. Health Perspect., 117 (9) (2009), pp. 1414-1419
B. Eskenazi, M. Warner, P. Brambilla, S. Signorini, J. Ames, P. Mocarelli
The Seveso accident: A look at 40 years of health research and beyond
Environ. Int., 121 (Pt 1) (2018), pp. 71-84
ArticleDownload PDFView Record in ScopusGoogle Scholar[513]
M. Goodman, K.M. Narayan, D. Flanders, E.T. Chang, H.O. Adami, P. Boffetta, J.S. Mandel
Dose-response relationship between serum 2,3,7,8-tetrachlorodibenzo-p-dioxin and diabetes mellitus: a meta-analysis
Am. J. Epidemiol., 181 (6) (2015), pp. 374-384 View PDF
CrossRefView Record in ScopusGoogle Scholar[514]
K.W. Taylor, R.F. Novak, H.A. Anderson, L.S. Birnbaum, C. Blystone, M. Devito, D. Jacobs, J. Köhrle, D.H. Lee, L. Rylander, A. Rignell-Hydbom, R. Tornero-Velez, M.E. Turyk, A.L. Boyles, K.A. Thayer, L. Lind
Evaluation of the association between persistent organic pollutants (POPs) and diabetes in epidemiological studies: a national toxicology program workshop review
Environ. Health Perspect., 121 (7) (2013), pp. 774-783 View PDF
CrossRefView Record in ScopusGoogle Scholar[515]
M. de Cock, M. van de Bor
Obesogenic effects of endocrine disruptors, what do we know from animal and human studies?
Environ. Int., 70 (2014), pp. 15-24
ArticleDownload PDFView Record in ScopusGoogle Scholar[516]
J.L. Tang-Péronard, H.R. Andersen, T.K. Jensen, B.L. Heitmann
Endocrine-disrupting chemicals and obesity development in humans: A review
Obes. Rev., 12 (8) (2011), pp. 622-636
View Record in ScopusGoogle Scholar[517]
A.O. De Silva, J.M. Armitage, T.A. Bruton, C. Dassuncao, W. Heiger-Bernays, X.C. Hu, A. Kärrman, B. Kelly, C. Ng, A. Robuck, M. Sun, T.F. Webster, E.M. Sunderland
PFAS Exposure Pathways for Humans and Wildlife: A Synthesis of Current Knowledge and Key Gaps in Understanding
Environ. Toxicol. Chem., 40 (3) (2021), pp. 631-657 View PDF
CrossRefView Record in ScopusGoogle Scholar[518]
B.E. Blake, S.E. Fenton
Early life exposure to per- and polyfluoroalkyl substances (PFAS) and latent health outcomes: A review including the placenta as a target tissue and possible driver of peri- and postnatal effects
Toxicology, 443 (2020), p. 152565
ArticleDownload PDFView Record in ScopusGoogle Scholar[519]
H. Fromme, S.A. Tittlemier, W. Völkel, M. Wilhelm, D. Twardella
Perfluorinated compounds–exposure assessment for the general population in Western countries
Int. J. Hyg. Environ. Health, 212 (3) (2009), pp. 239-270
ArticleDownload PDFView Record in ScopusGoogle Scholar[520]
K. Inoue, F. Okada, R. Ito, S. Kato, S. Sasaki, S. Nakajima, A. Uno, Y. Saijo, F. Sata, Y. Yoshimura, R. Kishi, H. Nakazawa
Perfluorooctane sulfonate (PFOS) and related perfluorinated compounds in human maternal and cord blood samples: assessment of PFOS exposure in a susceptible population during pregnancy
Environ. Health Perspect., 112 (11) (2004), pp. 1204-1207
View Record in ScopusGoogle Scholar[521]
K.B. Gützkow, L.S. Haug, C. Thomsen, A. Sabaredzovic, G. Becher, G. Brunborg
Placental transfer of perfluorinated compounds is selective–a Norwegian Mother and Child sub-cohort study
Int. J. Hyg. Environ. Health, 215 (2) (2012), pp. 216-219
ArticleDownload PDFView Record in ScopusGoogle Scholar[522]
M. Fisher, T.E. Arbuckle, C.L. Liang, A. LeBlanc, E. Gaudreau, W.G. Foster, D. Haines, K. Davis, W.D. Fraser
Concentrations of persistent organic pollutants in maternal and cord blood from the maternal-infant research on environmental chemicals (MIREC) cohort study
Environ Health, 15 (1) (2016), p. 59 View PDF
W. Qi, J.M. Clark, A.R. Timme-Laragy, Y. Park
Perfluorobutanesulfonic acid (PFBS) potentiates adipogenesis of 3T3-L1 adipocytes
Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 120 (2018), pp. 340-345
ArticleDownload PDFView Record in ScopusGoogle Scholar[524]
A.M. Watkins, C.R. Wood, M.T. Lin, B.D. Abbott
The effects of perfluorinated chemicals on adipocyte differentiation in vitro
Mol. Cell. Endocrinol., 400 (2015), pp. 90-101
ArticleDownload PDFView Record in ScopusGoogle Scholar[525]
T. Qiu, M. Chen, X. Sun, J. Cao, C. Feng, D. Li, W. Wu, L. Jiang, X. Yao
Perfluorooctane sulfonate-induced insulin resistance is mediated by protein kinase B pathway
Biochem. Biophys. Res. Commun., 477 (4) (2016), pp. 781-785
ArticleDownload PDFView Record in ScopusGoogle Scholar[526]
K.E. Sant, K. Annunziato, S. Conlin, G. Teicher, P. Chen, O. Venezia, G.B. Downes, Y. Park, A.R. Timme-Laragy
Developmental exposures to perfluorooctanesulfonic acid (PFOS) impact embryonic nutrition, pancreatic morphology, and adiposity in the zebrafish, Danio rerio, Environmental pollution (Barking
Essex, 275 (2021) (1987), Article 116644
Y. Du, X. Shi, C. Liu, K. Yu, B. Zhou
Chronic effects of water-borne PFOS exposure on growth, survival and hepatotoxicity in zebrafish: a partial life-cycle test
Chemosphere, 74 (5) (2009), pp. 723-729
ArticleDownload PDFView Record in ScopusGoogle Scholar[528]
M.B. Rosen, B.D. Abbott, D.C. Wolf, J.C. Corton, C.R. Wood, J.E. Schmid, K.P. Das, R.D. Zehr, E.T. Blair, C. Lau
Gene profiling in the livers of wild-type and PPARalpha-null mice exposed to perfluorooctanoic acid
Toxicol. Pathol., 36 (4) (2008), pp. 592-607 View PDF
CrossRefView Record in ScopusGoogle Scholar[529]
M.B. Rosen, J.E. Schmid, K.P. Das, C.R. Wood, R.D. Zehr, C. Lau
Gene expression profiling in the liver and lung of perfluorooctane sulfonate-exposed mouse fetuses: comparison to changes induced by exposure to perfluorooctanoic acid
Reprod. Toxicol., 27 (3–4) (2009), pp. 278-288
ArticleDownload PDFView Record in ScopusGoogle Scholar[530]
N. Kudo, Y. Kawashima
Fish oil-feeding prevents perfluorooctanoic acid-induced fatty liver in mice
Toxicol. Appl. Pharmacol., 145 (2) (1997), pp. 285-293
ArticleDownload PDFView Record in ScopusGoogle Scholar[531]
E. Marques, M. Pfohl, A. Auclair, R. Jamwal, B.J. Barlock, F.M. Sammoura, M. Goedken, F. Akhlaghi, A.L. Slitt
Perfluorooctanesulfonic acid (PFOS) administration shifts the hepatic proteome and augments dietary outcomes related to hepatic steatosis in mice
Toxicol. Appl. Pharmacol., 408 (2020), Article 115250
ArticleDownload PDFView Record in ScopusGoogle Scholar[532]
L. Wang, Y. Wang, Y. Liang, J. Li, Y. Liu, J. Zhang, A. Zhang, J. Fu, G. Jiang
PFOS induced lipid metabolism disturbances in BALB/c mice through inhibition of low density lipoproteins excretion
Sci. Rep., 4 (2014), p. 4582
View Record in ScopusGoogle Scholar[533]
I.G. Shabalina, T.V. Kramarova, C.L. Mattsson, N. Petrovic, M. Rahman Qazi, R.I. Csikasz, S.C. Chang, J. Butenhoff, J.W. DePierre, B. Cannon, J. Nedergaard
The Environmental Pollutants Perfluorooctane Sulfonate and Perfluorooctanoic Acid Upregulate Uncoupling Protein 1 (UCP1) in Brown-Fat Mitochondria Through a UCP1-Dependent Reduction in Food Intake, Toxicological sciences : an official journal of the Society of
Toxicology, 146 (2) (2015), pp. 334-343 View PDF
CrossRefView Record in ScopusGoogle Scholar[534]
E.P. Hines, S.S. White, J.P. Stanko, E.A. Gibbs-Flournoy, C. Lau, S.E. Fenton
Phenotypic dichotomy following developmental exposure to perfluorooctanoic acid (PFOA) in female CD-1 mice: Low doses induce elevated serum leptin and insulin, and overweight in mid-life
Mol. Cell. Endocrinol., 304 (1–2) (2009), pp. 97-105
ArticleDownload PDFView Record in ScopusGoogle Scholar[535]
Y.P. Tian, X.W. Zeng, M.S. Bloom, S. Lin, S.Q. Wang, S.H.L. Yim, M. Yang, C. Chu, N. Gurram, L.W. Hu, K.K. Liu, B.Y. Yang, D. Feng, R.Q. Liu, M. Nian, G.H. Dong
Isomers of perfluoroalkyl substances and overweight status among Chinese by sex status: Isomers of C8 Health Project in China
Environ. Int., 124 (2019), pp. 130-138
ArticleDownload PDFView Record in ScopusGoogle Scholar[536]
A. Chen, R. Jandarov, L. Zhou, A.M. Calafat, G. Zhang, E.M. Urbina, J. Sarac, D.H. Augustin, T. Caric, L. Bockor, M.Z. Petranovic, N. Novokmet, S. Missoni, P. Rudan, R. Deka
Association of perfluoroalkyl substances exposure with cardiometabolic traits in an island population of the eastern Adriatic coast of Croatia
The Science of the total environment, 683 (2019), pp. 29-36
ArticleDownload PDFView Record in ScopusGoogle Scholar[537]
K.Y. Christensen, M. Raymond, J. Meiman
Perfluoroalkyl substances and metabolic syndrome
Int. J. Hyg. Environ. Health, 222 (1) (2019), pp. 147-153
ArticleDownload PDFView Record in ScopusGoogle Scholar[538]
X. He, Y. Liu, B. Xu, L. Gu, W. Tang
PFOA is associated with diabetes and metabolic alteration in US men: National Health and Nutrition Examination Survey 2003–2012
The Science of the total environment, 625 (2018), pp. 566-574
ArticleDownload PDFView Record in ScopusGoogle Scholar[539]
M.H. Harris, S.L. Rifas-Shiman, A.M. Calafat, X. Ye, A.M. Mora, T.F. Webster, E. Oken, S.K. Sagiv
Predictors of Per- and Polyfluoroalkyl Substance (PFAS) Plasma Concentrations in 6–10 Year Old American Children
Environ. Sci. Technol., 51 (9) (2017), pp. 5193-5204 View PDF
CrossRefView Record in ScopusGoogle Scholar[540]
F. Scinicariello, M.C. Buser, H.G. Abadin, R. Attanasio
Perfluoroalkyl substances and anthropomorphic measures in children (ages 3–11 years), NHANES 2013–2014
Environ. Res., 186 (2020), Article 109518
ArticleDownload PDFView Record in ScopusGoogle Scholar[541]
M. Averina, J. Brox, S. Huber, A.S. Furberg
Exposure to perfluoroalkyl substances (PFAS) and dyslipidemia, hypertension and obesity in adolescents
Environ Res, The Fit Futures study (2021), p. 110740
ArticleDownload PDFView Record in ScopusGoogle Scholar[542]
S.L. Kingsley, D.I. Walker, A.M. Calafat, A. Chen, G.D. Papandonatos, Y. Xu, D.P. Jones, B.P. Lanphear, K.D. Pennell, J.M. Braun
Metabolomics of childhood exposure to perfluoroalkyl substances: a cross-sectional study
Metabolomics : Official journal of the Metabolomic Society, 15 (7) (2019), p. 95
View Record in ScopusGoogle Scholar[543]
T.L. Alderete, R. Jin, D.I. Walker, D. Valvi, Z. Chen, D.P. Jones, C. Peng, F.D. Gilliland, K. Berhane, D.V. Conti, M.I. Goran, L. Chatzi
Perfluoroalkyl substances, metabolomic profiling, and alterations in glucose homeostasis among overweight and obese Hispanic children: A proof-of-concept analysis
Environ. Int., 126 (2019), pp. 445-453
ArticleDownload PDFView Record in ScopusGoogle Scholar[544]
G. Liu, K. Dhana, J.D. Furtado, J. Rood, G. Zong, L. Liang, L. Qi, G.A. Bray, L. DeJonge, B. Coull, P. Grandjean, Q. Sun
Perfluoroalkyl substances and changes in body weight and resting metabolic rate in response to weight-loss diets: A prospective study
PLoS Med., 15 (2) (2018), Article e1002502 View PDF
CrossRefView Record in ScopusGoogle Scholar[545]
A. Cardenas, R. Hauser, D.R. Gold, K.P. Kleinman, M.F. Hivert, A.F. Fleisch, P.D. Lin, A.M. Calafat, T.F. Webster, E.S. Horton, E. Oken
Association of Perfluoroalkyl and Polyfluoroalkyl Substances With Adiposity
JAMA network open, 1 (4) (2018), Article e181493 View PDF
CrossRefView Record in ScopusGoogle Scholar[546]
S.L. Domazet, A. Grontved, A.G. Timmermann, F. Nielsen, T.K. Jensen
Longitudinal Associations of Exposure to Perfluoroalkylated Substances in Childhood and Adolescence and Indicators of Adiposity and Glucose Metabolism 6 and 12 Years Later: The European Youth Heart Study
Diabetes Care, 39 (10) (2016), pp. 1745-1751 View PDF
CrossRefView Record in ScopusGoogle Scholar[547]
P.I. Johnson, P. Sutton, D.S. Atchley, E. Koustas, J. Lam, S. Sen, K.A. Robinson, D.A. Axelrad, T.J. Woodruff
The Navigation Guide – evidence-based medicine meets environmental health: systematic review of human evidence for PFOA effects on fetal growth
Environ. Health Perspect., 122 (10) (2014), pp. 1028-1039
View Record in ScopusGoogle Scholar[548]
T. Cao, A. Qu, Z. Li, W. Wang, R. Liu, X. Wang, Y. Nie, S. Sun, X. Zhang, X. Liu
The relationship between maternal perfluoroalkylated substances exposure and low birth weight of offspring: a systematic review and meta-analysis
Environ. Sci. Pollut. Res. Int. (2021)
A.P. Starling, J.L. Adgate, R.F. Hamman, K. Kechris, A.M. Calafat, X. Ye, D. Dabelea
Perfluoroalkyl Substances during Pregnancy and Offspring Weight and Adiposity at Birth: Examining Mediation by Maternal Fasting Glucose in the Healthy Start Study
Environ. Health Perspect., 125 (6) (2017), Article 067016 View PDF
CrossRefView Record in ScopusGoogle Scholar[550]
S. Kobayashi, K. Azumi, H. Goudarzi, A. Araki, C. Miyashita, S. Kobayashi, S. Itoh, S. Sasaki, M. Ishizuka, H. Nakazawa, T. Ikeno, R. Kishi
Effects of prenatal perfluoroalkyl acid exposure on cord blood IGF2/H19 methylation and ponderal index: The Hokkaido Study
J. Eposure Sci. Environ. Epidemiol., 27 (3) (2017), pp. 251-259 View PDF
CrossRefView Record in ScopusGoogle Scholar[551]
S.D. Mitro, S.K. Sagiv, S.L. Rifas-Shiman, A.M. Calafat, A.F. Fleisch, L.M. Jaacks, P.L. Williams, E. Oken, T.M. James-Todd
Per- and Polyfluoroalkyl Substance Exposure, Gestational Weight Gain, and Postpartum Weight Changes in Project Viva
Obesity (Silver Spring), 28 (10) (2020), pp. 1984-1992 View PDF
CrossRefView Record in ScopusGoogle Scholar[552]
M.E. Romano, L.G. Gallagher, M.N. Eliot, A.M. Calafat, A. Chen, K. Yolton, B. Lanphear, J.M. Braun
Per- and polyfluoroalkyl substance mixtures and gestational weight gain among mothers in the Health Outcomes and Measures of the Environment study
Int. J. Hyg. Environ. Health, 231 (2021), Article 113660
ArticleDownload PDFView Record in ScopusGoogle Scholar[553]
K.J. Marks, Z. Jeddy, W.D. Flanders, K. Northstone, A. Fraser, A.M. Calafat, K. Kato, T.J. Hartman
Maternal serum concentrations of perfluoroalkyl substances during pregnancy and gestational weight gain: The Avon Longitudinal Study of Parents and Children
Reprod. Toxicol., 90 (2019), pp. 8-14
ArticleDownload PDFView Record in ScopusGoogle Scholar[554]
L.M. Jaacks, D. Boyd Barr, R. Sundaram, J. Grewal, C. Zhang, G.M. Buck Louis
Pre-Pregnancy Maternal Exposure to Persistent Organic Pollutants and Gestational Weight Gain: A Prospective Cohort Study
Int. J. Environ. Res. Public Health, 13 (9) (2016)
J. Ashley-Martin, L. Dodds, T.E. Arbuckle, A.S. Morisset, M. Fisher, M.F. Bouchard, G.D. Shapiro, A.S. Ettinger, P. Monnier, R. Dallaire, S. Taback, W. Fraser
Maternal and Neonatal Levels of Perfluoroalkyl Substances in Relation to Gestational Weight Gain
Int. J. Environ. Res. Public Health, 13 (1) (2016)
A.P. Starling, J.T. Brinton, D.H. Glueck, A.L. Shapiro, C.S. Harrod, A.M. Lynch, A.M. Siega-Riz, D. Dabelea
Associations of maternal BMI and gestational weight gain with neonatal adiposity in the Healthy Start study
Am. J. Clin. Nutr., 101 (2) (2015), pp. 302-309 View PDF
CrossRefView Record in ScopusGoogle Scholar[557]
Z. Chen, T. Yang, D.I. Walker, D.C. Thomas, C. Qiu, L. Chatzi, T.L. Alderete, J.S. Kim, D.V. Conti, C.V. Breton, D. Liang, E.R. Hauser, D.P. Jones, F.D. Gilliland
Dysregulated lipid and fatty acid metabolism link perfluoroalkyl substances exposure and impaired glucose metabolism in young adults
Environ. Int., 145 (2020), Article 106091
ArticleDownload PDFView Record in ScopusGoogle Scholar[558]
J.M. Braun, A. Chen, M.E. Romano, A.M. Calafat, G.M. Webster, K. Yolton, B.P. Lanphear
Prenatal perfluoroalkyl substance exposure and child adiposity at 8 years of age: The HOME study
Obesity (Silver Spring), 24 (1) (2016), pp. 231-237 View PDF
CrossRefView Record in ScopusGoogle Scholar[559]
P. Liu, F. Yang, Y. Wang, Z. Yuan
Perfluorooctanoic Acid (PFOA) Exposure in Early Life Increases Risk of Childhood Adiposity: A Meta-Analysis of Prospective Cohort Studies
Int. J. Environ. Res. Public Health, 15 (10) (2018)
T.I. Halldorsson, D. Rytter, L.S. Haug, B.H. Bech, I. Danielsen, G. Becher, T.B. Henriksen, S.F. Olsen
Prenatal Exposure to Perfluorooctanoate and Risk of Overweight at 20 Years of Age: A Prospective Cohort Study
Environ. Health Perspect. (2012)
M.S. Bloom, S. Commodore, P.L. Ferguson, B. Neelon, J.L. Pearce, A. Baumer, R.B. Newman, W. Grobman, A. Tita, J. Roberts, D. Skupski, K. Palomares, M. Nageotte, K. Kannan, C. Zhang, R. Wapner, J.E. Vena, K.J. Hunt
Association between gestational PFAS exposure and Children’s adiposity in a diverse population
Environ. Res., 203 (2022), Article 111820
ArticleDownload PDFView Record in ScopusGoogle Scholar[562]
V. Barry, L.A. Darrow, M. Klein, A. Winquist, K. Steenland
Early life perfluorooctanoic acid (PFOA) exposure and overweight and obesity risk in adulthood in a community with elevated exposure
Environ. Res., 132 (2014), pp. 62-69
ArticleDownload PDFView Record in ScopusGoogle Scholar[563]
C.S. Andersen, C. Fei, M. Gamborg, E.A. Nohr, T.I. Sorensen, J. Olsen
Prenatal exposures to perfluorinated chemicals and anthropometry at 7 years of age
Am. J. Epidemiol., 178 (6) (2013), pp. 921-927 View PDF
CrossRefView Record in ScopusGoogle Scholar[564]J.M. Mérillon, Ramawat, K.G. , Sweeteners: Pharmacology, Biotechnology, and Applications, Switzerland: Springer (2018).
Google Scholar[565]N.S. Kumar, A. Sharma, D.K. Kishore, K. , Food Safety and Human Health, London: Academic Press (2019).
C. Gardiner, J. Wylie-Rossett, S.S. Gidding, L.M. Steffen, R.K. Johnson, D. Reader, A.H. Lichtenstein
Non-nutritive sweeteners: current use and health perspectives: a scientific statement from the American Heart association and the American Diabetes Association
Diabetes Care, 35 (2012), pp. 1798-1808
E. Moriconi, A. Feraco, V. Marzolla, M. Infante, M. Lombardo, A. Fabbri, M. Caprio
‘Neuroendocrine and Metabolic Effects of Low-Calorie and Non-Calorie Sweeteners
Front. Endocrinol., 11 (2020), p. 444
View Record in ScopusGoogle Scholar[568]
I. Liauchonak, B. Qirri, F. Dawoud, Y. Riat, M.R. Szewczuk
Non-nuitritive sweeteners and their implication on the development of metabolic syndrome
Nutrients, 11 (2019), p. 644 View PDF
CrossRefView Record in ScopusGoogle Scholar[569]
K.I. Rother, E.M. Conway, A.C. Sylvetsky
How non-nutritive sweeteners influence hormones and health
Trends Endocrinol. Metab., 29 (7) (2018)
M.B. Azad, A. Archibald, M.M. Tomczyk, A. Head, K.G. Cheung, R.J. Souza, A.B. Becker, P.J. Mandhane, S.E. Turvey, T.J. Moraes, M.R. Sears, P. Subbarao, V.W. Dolinsky
Nonnutritive sweetener consumption during pregnancy, adiposity, and adipocyte differentiation in offspring: evidence from humans, mice, and cells
International Journal of Obesity, 44 (2020), pp. 2137-2148 View PDF
CrossRefView Record in ScopusGoogle Scholar[571]
C.A. Rosales-Gomez, B.E. Martinez-Carrillo, A.A. Resendiz-Albor, N. Ramirez-Duran, R. Valdes-Ramos, T. Mondragon-Velasquez, J.A. Escoto-Herrera
Chronic Consumption of Sweeteners and Its Effect on Glycaemia, Cytokines, Hormones, and Lymphocytes of GALT in CD1 Mice
Biomed Res. Int. (2018), pp. 1-15 View PDF
J. Suez, T. Korem, D. Zeevi, G. Zilberman-Schapira, C.A. Thaiss, O. Maza, D. Israeli, N. Zmora, S. Gilad, A. Weinberger, Y. Kuperman, A. Harmelin, I. Kolodkin-Gal, H. Shapiro, Z. Halpern, E. Segal, E. Elinav
Artificial sweeteners induce glucose intolerance by altering the gut microbiota
Nature, 514 (7521) (2014), pp. 181-186 View PDF
CrossRefView Record in ScopusGoogle Scholar[573]
N. Kundu, C.C. Domingues, J. Patel, M. Aljishi, N. Ahmadi, M. Fakhri, A.C. Sylvetsky, S. Sen
Sucralose promotes accumulation of reactive oxygen species (ROS) and adipogenesis in mesenchymal stromal cells
Stem Cell Res. Ther., 11 (1) (2020)
E. Palkowska-Gozdzik
Bigos, A., Rosolowska-Huszcz, D, ‘Type of sweet flavour carrier affects thyroid axis activity in male rats’
Eur. J. Nutr., 57 (2018), pp. 773-782 View PDF
CrossRefView Record in ScopusGoogle Scholar[575]
A. Romo-Romo, C.A. Aguilar-Salinas, M.G. Lopez-Carrasco, L.E. Guillen-Pineda, G.X. Brito-Cordova, R.A. Gomez-Diaz, F.J. Gomez-Perez, P. Almeda-Valdes
‘Sucralose Consumption over 2 Weeks in Healthy Subjects Does Not Modify Fasting Plasma Concentrations of Appetite-Regulating Hormones: A Randomized Clinical Trial’, Journal of the Academy of
Nutrition and Dietetics, 120 (8) (2020), pp. 1295-1304
ArticleDownload PDFView Record in ScopusGoogle Scholar[576]
J.R. Dalenberg, B.P. Patel, R. Denis, P.C. Vinke, S. Luquet, D.M. Small
Short-Term Consumption of Sucralose with, but Not without, Carbohydrate Impairs Neural and Metabolic Sensitivity to Sugar in Humans
Cell Metab., 31 (2020), pp. 493-502
View Record in ScopusGoogle Scholar[577]
O.H. Azeez, S.Y. Alkass, D.S. Persike
Long-Term Saccharin Consumption and Increased Risk of Obesity, Diabetes, Hepatic Dysfunction, and Renal Impairment in Rats
Med. Lith., 55 (10) (2019), pp. 1-15
View Record in ScopusGoogle Scholar[578]Y.J. Zhao X, Chen K, Song L, Sun B, Wei X. , Effects of saccharin supplementation on body weight, sweet receptor mRNA expression and appetite signals regulation in post-weanling rats, Peptides 107 (2018) 32-38.
R. Reiss, E.T. Chang, R.J. Richardson, M. Goodman
A review of epidemiologic studies of low-level exposures to organophosphorus insecticides in non-occupational populations
Crit. Rev. Toxicol., 45 (7) (2015), pp. 531-641 View PDF
CrossRefView Record in ScopusGoogle Scholar[580]
J. Blanco, L. Guardia-Escote, M. Mulero, P. Basaure, J. Biosca-Brull, M. Cabré, M.T. Colomina, J.L. Domingo, D.J. Sánchez
Obesogenic effects of chlorpyrifos and its metabolites during the differentiation of 3T3-L1 preadipocytes
Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 137 (2020), Article 111171
ArticleDownload PDFView Record in ScopusGoogle Scholar[581]
W.J. Meggs, K.L. Brewer
Weight gain associated with chronic exposure to chlorpyrifos in rats
J. Med. Toxicol., 3 (3) (2007), pp. 89-93
View Record in ScopusGoogle Scholar[582]
F. Peris-Sampedro, M. Cabré, P. Basaure, I. Reverte, J.L. Domingo, M. Teresa Colomina
Adulthood dietary exposure to a common pesticide leads to an obese-like phenotype and a diabetic profile in apoE3 mice
Environ. Res., 142 (2015), pp. 169-176
ArticleDownload PDFView Record in ScopusGoogle Scholar[583]
L. Guardia-Escote, J. Blanco, P. Basaure, J. Biosca-Brull, R.N. Verkaik-Schakel, M. Cabré, F. Peris-Sampedro, C. Pérez-Fernández, F. Sánchez-Santed, T. Plösch, J.L. Domingo, M.T. Colomina
Sex and Exposure to Postnatal Chlorpyrifos Influence the Epigenetics of Feeding-Related Genes in a Transgenic APOE Mouse Model: Long-Term Implications on Body Weight after a High-Fat Diet
Int. J. Environ. Res. Public Health, 18 (1) (2020), p. 184 View PDF
P. Basaure, L. Guardia-Escote, J. Biosca-Brull, J. Blanco, M. Cabré, F. Peris-Sampedro, F. Sánchez-Santed, J.L. Domingo, M.T. Colomina
Exposure to chlorpyrifos at different ages triggers APOE genotype-specific responses in social behavior, body weight and hypothalamic gene expression
Environ. Res., 178 (2019), Article 108684
ArticleDownload PDFView Record in ScopusGoogle Scholar[585]
B. Fang, J.W. Li, M. Zhang, F.Z. Ren, G.F. Pang
Chronic chlorpyrifos exposure elicits diet-specific effects on metabolism and the gut microbiome in rats
Food Chem. Toxicol., 111 (2018), pp. 144-152
ArticleDownload PDFView Record in ScopusGoogle Scholar[586]
Y. Liang, J. Zhan, D. Liu, M. Luo, J. Han, X. Liu, C. Liu, Z. Cheng, Z. Zhou, P. Wang
Organophosphorus pesticide chlorpyrifos intake promotes obesity and insulin resistance through impacting gut and gut microbiota
Microbiome, 7 (1) (2019), p. 19
Y. Zhang, Q. Jia, C. Hu, M. Han, Q. Guo, S. Li, C. Bo, Y. Zhang, X. Qi, L. Sai, C. Peng
Effects of chlorpyrifos exposure on liver inflammation and intestinal flora structure in mice
Toxicol Res (Camb), 10 (1) (2021), pp. 141-149
S. Samarghandian, M. Foadoddin, M. Zardast, O. Mehrpour, P. Sadighara, B. Roshanravan, T. Farkhondeh
The impact of age-related sub-chronic exposure to chlorpyrifos on metabolic indexes in male rats
Environ. Sci. Pollut. Res. Int., 27 (18) (2020), pp. 22390-22399 View PDF
CrossRefView Record in ScopusGoogle Scholar[589]
T.L. Lassiter, S. Brimijoin
Rats gain excess weight after developmental exposure to the organophosphorothionate pesticide, chlorpyrifos
Neurotoxicol. Teratol., 30 (2) (2008), pp. 125-130
ArticleDownload PDFView Record in ScopusGoogle Scholar[590]
Y. Park, Y. Kim, J. Kim, K.S. Yoon, J. Clark, J. Lee
Imidacloprid, a neonicotinoid insecticide, potentiates adipogenesis in 3T3-L1 adipocytes
J. Agric. Food Chem., 61 (1) (2013), pp. 255-259
View Record in ScopusGoogle Scholar[591]
Q. Sun, X. Xiao, Y. Kim, D. Kim, K.S. Yoon, J.M. Clark, Y. Park
Imidacloprid Promotes High Fat Diet-Induced Adiposity and Insulin Resistance in Male C57BL/6J Mice
J. Agric. Food. Chem., 64 (49) (2016), pp. 9293-9306 View PDF
CrossRefView Record in ScopusGoogle Scholar[592]
Q. Sun, W. Qi, X. Xiao, S.H. Yang, D. Kim, K.S. Yoon, J.M. Clark, Y. Park
Imidacloprid Promotes High Fat Diet-Induced Adiposity in Female C57BL/6J Mice and Enhances Adipogenesis in 3T3-L1 Adipocytes via the AMPKalpha-Mediated Pathway
J. Agric. Food Chem., 65 (31) (2017), pp. 6572-6581 View PDF
CrossRefView Record in ScopusGoogle Scholar[593]
E.N. Ndonwi, B. Atogho-Tiedeu, E. Lontchi-Yimagou, T.S. Shinkafi, D. Nanfa, E.V. Balti, J.C. Katte, A. Mbanya, T. Matsha, J.C. Mbanya, A. Shakir, E. Sobngwi
Metabolic effects of exposure to pesticides during gestation in female Wistar rats and their offspring: a risk factor for diabetes?
Toxicological research, 36 (3) (2020), pp. 249-256 View PDF
CrossRefView Record in ScopusGoogle Scholar[594]
X. Xiao, Q. Sun, Y. Kim, S.H. Yang, W. Qi, D. Kim, K.S. Yoon, J.M. Clark, Y. Park
Exposure to permethrin promotes high fat diet-induced weight gain and insulin resistance in male C57BL/6J mice
Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 111 (2018), pp. 405-416
ArticleDownload PDFView Record in ScopusGoogle Scholar[595]
X. Xiao, W. Qi, J.M. Clark, Y. Park
Permethrin potentiates adipogenesis via intracellular calcium and endoplasmic reticulum stress-mediated mechanisms in 3T3-L1 adipocytes
Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 109 (Pt 1) (2017), pp. 123-129
ArticleDownload PDFCrossRefView Record in ScopusGoogle Scholar[596]
J. Kim, Y. Park, K.S. Yoon, J.M. Clark, Y. Park
Permethrin alters adipogenesis in 3T3-L1 adipocytes and causes insulin resistance in C2C12 myotubes
J. Biochem. Mol. Toxicol., 28 (9) (2014), pp. 418-424
R.M. Sargis, B.A. Neel, C.O. Brock, Y. Lin, A.T. Hickey, D.A. Carlton, M.J. Brady
The novel endocrine disruptor tolylfluanid impairs insulin signaling in primary rodent and human adipocytes through a reduction in insulin receptor substrate-1 levels
BBA, 2012 (1822), pp. 952-960
View Record in ScopusGoogle Scholar[598]
Y. Chen, K.S. McCommis, D. Ferguson, A.M. Hall, C.A. Harris, B.N. Finck
Inhibition of the Mitochondrial Pyruvate Carrier by Tolylfluanid
Endocrinology, 159 (2) (2018), pp. 609-621 View PDF
CrossRefView Record in ScopusGoogle Scholar[599]
S.M. Regnier, A.G. Kirkley, D. Ruiz, W. Kamau, Q. Wu, K. Kannan, R.M. Sargis
Diet-dependence of metabolic perturbations mediated by the endocrine disruptor tolylfluanid
Endocr Connect, 7 (1) (2018), pp. 159-168 View PDF
CrossRefView Record in ScopusGoogle Scholar[600]
D. Ruiz, S.M. Regnier, A.G. Kirkley, M. Hara, F. Haro, H. Aldirawi, M.P. Dybala, R.M. Sargis
Developmental exposure to the endocrine disruptor tolylfluanid induces sex-specific later-life metabolic dysfunction
Reprod. Toxicol., 89 (2019), pp. 74-82
ArticleDownload PDFView Record in ScopusGoogle Scholar[601]
M.K. Zinöcker, I.A. Lindseth
The Western Diet-Microbiome-Host Interaction and Its Role in Metabolic Disease
Nutrients, 10 (3) (2018), p. 365 View PDF
CrossRefView Record in ScopusGoogle Scholar[602]
R.H. Lustig
Ultraprocessed Food: Addictive, Toxic, and Ready for Regulation
Nutrients, 12 (11) (2020)
S.K. Wong, K.-Y. Chin, F.H. Suhaimi, A. Fairus, S. Ima-Nirwana
Animal models of metabolic syndrome: a review
Nutrition & Metabolism, 13 (1) (2016), p. 65
View Record in ScopusGoogle Scholar[604]
A.L. Simmons, J.J. Schlezinger, B.E. Corkey
What Are We Putting in Our Food That Is Making Us Fat?
Food Additives, Contaminants, and Other Putative Contributors to Obesity, Current obesity reports, 3 (2) (2014), pp. 273-285 View PDF
CrossRefView Record in ScopusGoogle Scholar[605]S. Sharma, M.F. Fernandes, S. Fulton, Adaptations in brain reward circuitry underlie palatable food cravings and anxiety induced by high-fat diet withdrawal, International journal of obesity (2005) 37(9) (2013) 1183-91.
V.K. Ridaura, J.J. Faith, F.E. Rey, J. Cheng, A.E. Duncan, A.L. Kau, N.W. Griffin, V. Lombard, B. Henrissat, J.R. Bain, M.J. Muehlbauer, O. Ilkayeva, C.F. Semenkovich, K. Funai, D.K. Hayashi, B.J. Lyle, M.C. Martini, L.K. Ursell, J.C. Clemente, W. Van Treuren, W.A. Walters, R. Knight, C.B. Newgard, A.C. Heath, J.I. Gordon
Gut Microbiota from Twins Discordant for Obesity Modulate Metabolism in Mice
Science, 341 (6150) (2013)
K.L. Stanhope
Sugar consumption, metabolic disease and obesity: The state of the controversy
Crit. Rev. Clin. Lab. Sci., 53 (1) (2016), pp. 52-67 View PDF
CrossRefView Record in ScopusGoogle Scholar[608]
R.H. Lustig
Fructose: metabolic, hedonic, and societal parallels with ethanol
J. Am. Diet. Assoc., 110 (2010), pp. 1307-1321
ArticleDownload PDFView Record in ScopusGoogle Scholar[609]
P. Muriel, P. López-Sánchez, E. Ramos-Tovar
Fructose and the Liver
Int. J. Mol. Sci., 22 (13) (2021)
Google Scholar[610]J.M. Schwarz, S.M. Noworolski, A. Erkin-Cakmak, K. N.J., M.J. Wen, V.W. Tai, G.M. Jones, S.P. Palii, M. Velasco-Alin, K. Pan, B.W. Patterson, A. Gugliucci, R.H. Lustig, K. Mulligan, Impact of dietary fructose restriction on liver fat, de novo lipogenesis, and insulin kinetics in children with obesity, Gastroenterology 153 (2017) 743-752.
Google Scholar[611]J. Bowen, M. Noakes, P.M. Clifton, Appetite hormones and energy intake in obese men after consumption of fructose, glucose and whey protein beverages, International journal of obesity (2005) 31(11) (2007) 1696-703.
M.I. Goran, K. Dumke, S.G. Bouret, B. Kayser, R.W. Walker, B. Blumberg
The obesogenic effect of high fructose exposure during early development
Nature reviews. Endocrinology, 9 (8) (2013), pp. 494-500 View PDF
CrossRefView Record in ScopusGoogle Scholar[613]A.M. Calafat, X. Ye, L.-Y. Wong, A.M. Bishop, L.L. Needham, Urinary concentrations of four parabens in the U.S. population: NHANES 2005-2006, Environmental health perspectives 118(5) (2010) 679-685.
P. Hu, X. Chen, R.J. Whitener, E.T. Boder, J.O. Jones, A. Porollo, J. Chen, L. Zhao
Effects of parabens on adipocyte differentiation, Toxicological sciences : an official journal of the Society of
Toxicology, 131 (1) (2013), pp. 56-70 View PDF
P. Hu, H. Overby, E. Heal, S. Wang, J. Chen, C.-L. Shen, L. Zhao
Methylparaben and butylparaben alter multipotent mesenchymal stem cell fates towards adipocyte lineage
Toxicol. Appl. Pharmacol., 329 (2017), pp. 48-57
ArticleDownload PDFView Record in ScopusGoogle Scholar[616]
B. Leppert, S. Strunz, B. Seiwert, L. Schlittenbauer, R. Schlichting, C. Pfeiffer, S. Roder, M. Bauer, M. Borte, G.I. Stangl, T. Schoneberg, A. Schulz, I. Karkossa, U.E. Rolle-Kampczyk, L. Thurmann, M. von Bergen, B.I. Escher, K.M. Junge, T. Reemtsma, I. Lehmann, T. Polte
Maternal paraben exposure triggers childhood overweight development
Nat. Commun., 11 (1) (2020), p. 561
View Record in ScopusGoogle Scholar[617]J. Hu, V. Raikhel, K. Gopalakrishnan, H. Fernandez-Hernandez, L. Lambertini, F. Manservisi, L. Falcioni, L. Bua, F. Belpoggi, L.T. S, J. Chen, Effect of postnatal low-dose exposure to environmental chemicals on the gut microbiome in a rodent model, Microbiome 4(1) (2016) 26.
B. Chassaing, O. Koren, J.K. Goodrich, A.C. Poole, S. Srinivasan, R.E. Ley, A.T. Gewirtz
Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome
Nature, 519 (7541) (2015), pp. 92-96 View PDF
Z. Sun, Z. Tang, X. Yang, Q.S. Liu, Y. Liang, H. Fiedler, J. Zhang, Q. Zhou, G. Jiang
Perturbation of 3-tert-butyl-4-hydroxyanisole in adipogenesis of male mice with normal and high fat diets
Sci. Total Environ., 703 (2020), Article 135608
ArticleDownload PDFView Record in ScopusGoogle Scholar[620]
Z. Sun, X. Yang, Q.S. Liu, C. Li, Q. Zhou, H. Fiedler, C. Liao, J. Zhang, G. Jiang
Butylated hydroxyanisole isomers induce distinct adipogenesis in 3T3-L1 cells
J. Hazard. Mater., 379 (2019), Article 120794
ArticleDownload PDFView Record in ScopusGoogle Scholar[621]
M.S. Türküner, F. Özcan
Monosodium glutamate restricts the adipogenic potential of 3T3 – L1 preadipocytes through mitotic clonal expansion
Cell Biology International, 44 (3) (2020), pp. 744-754 View PDF
CrossRefView Record in ScopusGoogle Scholar[622]
J.W. Olney
Brain lesions, obesity, and other disturbances in mice treated with monosodium glutamate
Science, 164 (3880) (1969), pp. 719-721 View PDF
CrossRefView Record in ScopusGoogle Scholar[623]
S.P. Chakraborty
Patho-physiological and toxicological aspects of monosodium glutamate
Toxicol. Mech. Methods, 29 (6) (2019), pp. 389-396 View PDF
CrossRefView Record in ScopusGoogle Scholar[624]
R.J. Hernández Bautista, A.M. Mahmoud, M. Königsberg, N.e.
López Díaz Guerrero, Obesity: Pathophysiology, monosodium glutamate-induced model and anti-obesity medicinal plants
Biomed. Pharmacother., 111 (2019), pp. 503-516
ArticleDownload PDFView Record in ScopusGoogle Scholar[625]
M. Shannon, B. Green, G. Willars, J. Wilson, N. Matthews, J. Lamb, A. Gillespie, L. Connolly
The endocrine disrupting potential of monosodium glutamate (MSG) on secretion of the glucagon-like peptide-1 (GLP-1) gut hormone and GLP-1 receptor interaction
Toxicol. Lett., 265 (2017), pp. 97-105
ArticleDownload PDFView Record in ScopusGoogle Scholar[626]
A.M. Temkin, R.R. Bowers, M.E. Magaletta, S. Holshouser, A. Maggi, P. Ciana, L.J. Guillette, J.A. Bowden, J.R. Kucklick, J.E. Baatz, D.D. Spyropoulos
Effects of Crude Oil/Dispersant Mixture and Dispersant Components on PPARγ Activity in Vitro and in Vivo: Identification of Dioctyl Sodium Sulfosuccinate (DOSS; CAS #577-11-7) as a Probable Obesogen
Environ. Health Perspect., 124 (1) (2016), pp. 112-119 View PDF
CrossRefView Record in ScopusGoogle Scholar[627]
A.M. Temkin, R.R. Bowers, C.Z. Ulmer, K. Penta, J.A. Bowden, J. Nyland, J.E. Baatz, D.D. Spyropoulos
Increased adiposity, inflammation, metabolic disruption and dyslipidemia in adult male offspring of DOSS treated C57BL/6 dams
Sci. Rep., 9 (1) (2019), p. 1530
View Record in ScopusGoogle Scholar[628]
A. Stoica, B.S. Katzenellenbogen, M.B. Martin
Activation of estrogen receptor-alpha by the heavy metal cadmium
Mol. Endocrinol., 14 (4) (2000), pp. 545-553
M.b. v, m.b. z, a. a, c. v, l. a, f. e, m. s,
The endocrine disruptor cadmium: a new player in the pathophysiology of metabolic diseases
J. Endocrinol. Invest., 44 (7) (2021), pp. 1363-1377
V.M. Bimonte, Z.M. Besharat, A. Antonioni, V. Cella, A. Lenzi, E. Ferretti, S. Migliaccio
The endocrine disruptor cadmium: a new player in the pathophysiology of metabolic diseases
J. Endocrinol. Invest., 44 (7) (2021), pp. 1363-1377 View PDF
CrossRefView Record in ScopusGoogle Scholar[631]
M.N. Fransson, L. Barregard, G. Sallsten, M. Akerstrom, G. Johanson
Physiologically-Based Toxicokinetic Model for Cadmium Using Markov-Chain Monte Carlo Analysis of Concentrations in Blood
Urine, and Kidney Cortex from Living Kidney Donors, Toxicological Sciences, 141 (2) (2014), pp. 365-376 View PDF
CrossRefView Record in ScopusGoogle Scholar[632]
T.W. Jackson, G.L. Ryherd, C.M. Scheibly, A.L. Sasser, T.C. Guillette, S.M. Belcher
Gestational Cd Exposure in the CD-1 Mouse Induces Sex-Specific Hepatic Insulin Insensitivity
Obesity, and Metabolic Syndrome in Adult Female Offspring, Toxicological Sciences, 178 (2) (2020), pp. 264-280 View PDF
CrossRefView Record in ScopusGoogle Scholar[633]
A. Buha, D. Đukić-Ćosić, M. Ćurčić, Z. Bulat, B. Antonijević, J.-M. Moulis, M. Goumenou, D. Wallace
Emerging Links between Cadmium Exposure and Insulin Resistance: Human, Animal, and Cell Study Data
Toxics, 8 (3) (2020), p. 63 View PDF
CrossRefView Record in ScopusGoogle Scholar[634]
E.J. Lee, J.Y. Moon, B.S. Yoo
Cadmium inhibits the differentiation of 3T3-L1 preadipocyte through the C/EBPα and PPARγ pathways
Drug Chem. Toxicol., 35 (2) (2012), pp. 225-231 View PDF
CrossRefView Record in ScopusGoogle Scholar[635]
I. Karakis, Y. Baumfeld, D. Landau, R. Gat, N. Shemesh, M. Yitshak-Sade, O. Tirosh, B. Sarov, L. Novack
Exposure to metals and morbidity at eight years follow-up in women of childbearing age
Sci. Rep. (2021), p. 11429
View Record in ScopusGoogle Scholar[636]
R. Echeverría, P. Vrhovnik, I. Salcedo-Bellido, L.M. Iribarne-Durán, Ž. Fiket, M. Dolenec, P. Martin-Olmedo, N. Olea, J.P. Arrebola
Levels and determinants of adipose tissue cadmium concentrations in an adult cohort from Southern Spain
The Science of the total environment, 670 (2019), pp. 1028-1036
ArticleDownload PDFView Record in ScopusGoogle Scholar[637]M. Kuivenhoven, K. Mason, Arsenic Toxicity, StatPearls, StatPearls Publishing.
Google Scholar[638]Copyright © 2021, StatPearls Publishing LLC., Treasure Island (FL), 2021.
Y. Hou, P. Xue, C.G. Woods, X. Wang, J. Fu, K. Yarborough, W. Qu, Q. Zhang, M.E. Andersen, J. Pi
Association between arsenic suppression of adipogenesis and induction of CHOP10 via the endoplasmic reticulum stress response
Environ. Health Perspect., 121 (2) (2013), pp. 237-243
Z.X. Wang, C.S. Jiang, L. Liu, X.H. Wang, H.J. Jin, Q. Wu, Q. Chen
The role of Akt on arsenic trioxide suppression of 3T3-L1 preadipocyte differentiation
Cell Res., 15 (5) (2005), pp. 379-386 View PDF
CrossRefView Record in ScopusGoogle Scholar[641]
K.F. Rodriguez, E.K. Ungewitter, Y. Crespo-Mejias, C. Liu, B. Nicol, G.E. Kissling, H.-H.-C. Yao
Effects of in Utero Exposure to Arsenic during the Second Half of Gestation on Reproductive End Points and Metabolic Parameters in Female CD-1 Mice
Environ. Health Perspect., 124 (3) (2016), pp. 336-343
View Record in ScopusGoogle Scholar[642]
K.F. Rodriguez, N. Mellouk, E.K. Ungewitter, B. Nicol, C. Liu, P.R. Brown, C.J. Willson, H.H.C. Yao
In utero exposure to arsenite contributes to metabolic and reproductive dysfunction in male offspring of CD-1 mice
Reprod. Toxicol., 95 (2020), pp. 95-103
ArticleDownload PDFView Record in ScopusGoogle Scholar[643]
C.M. Carmean, A.G. Kirkley, M. Landeche, H. Ye, B. Chellan, H. Aldirawi, A.A. Roberts, P.J. Parsons, R.M. Sargis
Arsenic Exposure Decreases Adiposity During High-Fat Feeding
Obesity (Silver Spring), 28 (5) (2020), pp. 932-941 View PDF
CrossRefView Record in ScopusGoogle Scholar[644]
D.S. Paul, F.S. Walton, R.J. Saunders, M. Styblo
Characterization of the impaired glucose homeostasis produced in C57BL/6 mice by chronic exposure to arsenic and high-fat diet
Environ. Health Perspect., 119 (8) (2011), pp. 1104-1109 View PDF
CrossRefView Record in ScopusGoogle Scholar[645]
C.T. Su, H.C. Lin, C.S. Choy, Y.K. Huang, S.R. Huang, Y.M. Hsueh
The relationship between obesity, insulin and arsenic methylation capability in Taiwan adolescents
The Science of the total environment, 414 (2012), pp. 152-158
ArticleDownload PDFView Record in ScopusGoogle Scholar[646]
S.M. Eick, C. Steinmaus
Arsenic and Obesity: a Review of Causation and Interaction
Current environmental health reports, 7 (3) (2020), pp. 343-351 View PDF
CrossRefView Record in ScopusGoogle Scholar[647]
C.D. Kassotis, S.C. Nagel, H.M. Stapleton
Unconventional oil and gas chemicals and wastewater-impacted water samples promote adipogenesis via PPARγ-dependent and independent mechanisms in 3T3-L1 cells
The Science of the total environment, 640–641 (2018), pp. 1601-1610
ArticleDownload PDFView Record in ScopusGoogle Scholar[648]
H. Peng, J. Sun, H.A. Alharbi, P.D. Jones, J.P. Giesy, S. Wiseman
Peroxisome Proliferator-Activated Receptor γ is a Sensitive Target for Oil Sands Process-Affected Water: Effects on Adipogenesis and Identification of Ligands
Environ. Sci. Technol., 50 (14) (2016), pp. 7816-7824 View PDF
CrossRefView Record in ScopusGoogle Scholar[649]
C.D. Kassotis, K.C. Klemp, D.C. Vu, C.H. Lin, C.X. Meng, C.L. Besch-Williford, L. Pinatti, R.T. Zoeller, E.Z. Drobnis, V.D. Balise, C.J. Isiguzo, M.A. Williams, D.E. Tillitt, S.C. Nagel
Endocrine-Disrupting Activity of Hydraulic Fracturing Chemicals and Adverse Health Outcomes After Prenatal Exposure in Male Mice
Endocrinology, 156 (12) (2015), pp. 4458-4473 View PDF
CrossRefView Record in ScopusGoogle Scholar[650]
V.D. Balise, J.N. Cornelius-Green, B. Parmenter, S. Baxter, C.D. Kassotis, R.S. Rector, J.P. Thyfault, S. Paterlini, P. Palanza, D. Ruiz, R. Sargis, S.C. Nagel
Developmental Exposure to a Mixture of Unconventional Oil and Gas Chemicals Increased Risk-Taking Behavior, Activity and Energy Expenditure in Aged Female Mice After a Metabolic Challenge
Front Endocrinol (Lausanne), 10 (2019), p. 460
View Record in ScopusGoogle Scholar[651]
C.M. Benbrook
Trends in glyphosate herbicide use in the United States and globally
Environ. Sci. Eur., 28 (1) (2016), p. 3
M. Biserni, R. Mesnage, R. Ferro, E. Wozniak, T. Xenakis, C.A. Mein, M.N. Antoniou
Quizalofop-p-Ethyl Induces Adipogenesis in 3T3-L1 Adipocytes, Toxicological sciences : an official journal of the Society of
Toxicology, 170 (2) (2019), pp. 452-461 View PDF
CrossRefView Record in ScopusGoogle Scholar[653]
C.N. Martini, M. Gabrielli, M.M. Codesido, M.C. del Vila
Glyphosate-based herbicides with different adjuvants are more potent inhibitors of 3T3-L1 fibroblast proliferation and differentiation to adipocytes than glyphosate alone
Comp. Clin. Pathol., 25 (3) (2016), pp. 607-613 View PDF
CrossRefView Record in ScopusGoogle Scholar[654]
D. Kubsad, E.E. Nilsson, S.E. King, I. Sadler-Riggleman, D. Beck, M.K. Skinner
Assessment of Glyphosate Induced Epigenetic Transgenerational Inheritance of Pathologies and Sperm Epimutations: Generational Toxicology
Sci. Rep., 9 (1) (2019), p. 6372
View Record in ScopusGoogle Scholar[655]
V. Aggarwal, X. Deng, A. Tuli, K.S. Goh
Diazinon-chemistry and environmental fate: a California perspective
Rev. Environ. Contam. Toxicol., 223 (2013), pp. 107-140 View PDF
CrossRefView Record in ScopusGoogle Scholar[656]
A. Smith, X. Yu, L. Yin
Diazinon exposure activated transcriptional factors CCAAT-enhancer-binding proteins α (C/EBPα) and peroxisome proliferator-activated receptor γ (PPARγ) and induced adipogenesis in 3T3-L1 preadipocytes
Pestic. Biochem. Physiol., 150 (2018), pp. 48-58
ArticleDownload PDFView Record in ScopusGoogle Scholar[657]
C.D. Kassotis, K. Hoffman, H.M. Stapleton
Characterization of Adipogenic Activity of House Dust Extracts and Semi-Volatile Indoor Contaminants in 3T3-L1 Cells
Environ. Sci. Technol., 51 (15) (2017), pp. 8735-8745 View PDF
CrossRefView Record in ScopusGoogle Scholar[658]
H.M. Stapleton, S. Klosterhaus, S. Eagle, J. Fuh, J.D. Meeker, A. Blum, T.F. Webster
Detection of organophosphate flame retardants in furniture foam and U.S. house dust
Environ. Sci. Technol., 43 (19) (2009), pp. 7490-7495 View PDF
CrossRefView Record in ScopusGoogle Scholar[659]
C.D. Kassotis, K. Hoffman, J. Völker, Y. Pu, A. Veiga-Lopez, S.M. Kim, J.J. Schlezinger, P. Bovolin, E. Cottone, A. Saraceni, R. Scandiffio, E. Atlas, K. Leingartner, S. Krager, S.A. Tischkau, S. Ermler, J. Legler, V.A. Chappell, S.E. Fenton, F. Mesmar, M. Bondesson, M.F. Fernández, H.M. Stapleton
Reproducibility of Adipogenic Responses to Metabolism Disrupting Chemicals in the 3T3-L1 Pre-adipocyte Model System: An Interlaboratory Study
Toxicology, 461 (2021), Article 152900
ArticleDownload PDFView Record in ScopusGoogle Scholar[660]
G.-G. Ying, B. Williams, R. Kookana
Environmental fate of alkylphenols and alkylphenol ethoxylates—a review
Environ. Int., 28 (3) (2002), pp. 215-226
ArticleDownload PDFView Record in ScopusGoogle Scholar[661]
C.D. Kassotis, E.M. Kollitz, P.L. Ferguson, H.M. Stapleton
Nonionic Ethoxylated Surfactants Induce Adipogenesis in 3T3-L1 Cells, Toxicological sciences : an official journal of the Society of
Toxicology, 162 (1) (2018), pp. 124-136 View PDF
CrossRefView Record in ScopusGoogle Scholar[662]
C.D. Kassotis, M.K. LeFauve, Y.T. Chiang, M.M. Knuth, S. Schkoda, S.W. Kullman
Nonylphenol Polyethoxylates Enhance Adipose Deposition in Developmentally Exposed Zebrafish
Toxics, 10 (2) (2022)
Z. Sun, H. Cao, Q.S. Liu, Y. Liang, H. Fiedler, J. Zhang, Q. Zhou, G. Jiang
4-Hexylphenol influences adipogenic differentiation and hepatic lipid accumulation in vitro
Environ. Pollut., 268 (2021), Article 115635
ArticleDownload PDFView Record in ScopusGoogle Scholar[664]
X.L. Cao, G. Dufresne, G. Clement, S. Bélisle, A. Robichaud, F. Beraldin
Levels of bisphenol A diglycidyl ether (BADGE) and bisphenol F diglycidyl ether (BFDGE) in canned liquid infant formula products in Canada and dietary intake estimates
J. AOAC Int., 92 (6) (2009), pp. 1780-1789 View PDF
CrossRefView Record in ScopusGoogle Scholar[665]
R. Chamorro-García, S. Kirchner, X. Li, A. Janesick, S.C. Casey, C. Chow, B. Blumberg
Bisphenol A Diglycidyl Ether Induces Adipogenic Differentiation of Multipotent Stromal Stem Cells through a Peroxisome Proliferator-Activated Receptor Gamma-Independent Mechanism
Environ. Health Perspect., 120 (7) (2012)
J.G. Boucher, A. Boudreau, S. Ahmed, E. Atlas
In Vitro Effects of Bisphenol A β-D-Glucuronide (BPA-G) on Adipogenesis in Human and Murine Preadipocytes
Environ. Health Perspect., 123 (12) (2015), pp. 1287-1293
View Record in ScopusGoogle Scholar[667]
G.L. Ginsberg, S.J. Balk
Consumer products as sources of chemical exposures to children: case study of triclosan
Curr. Opin. Pediatr., 28 (2) (2016), pp. 235-242
View Record in ScopusGoogle Scholar[668]
J. Liu, D. Chen, Y. Huang, F.M. Bigambo, T. Chen, X. Wang
Effect of Maternal Triclosan Exposure on Neonatal Birth Weight and Children Triclosan Exposure on Children’s BMI: A Meta-Analysis
Front. Public Health, 9 (2021), Article 648196
View Record in ScopusGoogle Scholar[669]
J. Lankester, C. Patel, M.R. Cullen, C. Ley, J. Parsonnet
Urinary triclosan is associated with elevated body mass index in NHANES
PLoS ONE, 8 (11) (2013), Article e80057 View PDF
CrossRefView Record in ScopusGoogle Scholar[670]
M. Han, Y. Wang, C. Tang, H. Fang, D. Yang, J. Wu, H. Wang, Y. Chen, Q. Jiang
Association of triclosan and triclocarban in urine with obesity risk in Chinese school children
Environ. Int., 157 (2021), Article 106846
ArticleDownload PDFView Record in ScopusGoogle Scholar[671]
X. Li, H.T. Pham, A.S. Janesick, B. Blumberg
Triflumizole Is an Obesogen in Mice that Acts through Peroxisome Proliferator Activated Receptor Gamma (PPARγ)
Environ. Health Perspect., 120 (12) (2012), pp. 1720-1726 View PDF
CrossRefView Record in ScopusGoogle Scholar[672]
S. Lim, S.Y. Ahn, I.C. Song, M.H. Chung, H.C. Jang, K.S. Park, K.-U. Lee, Y.K. Pak, H.K. Lee
Chronic Exposure to the Herbicide, Atrazine, Causes Mitochondrial Dysfunction and Insulin Resistance
PLoS ONE, 4 (4) (2009), Article e5186 View PDF
CrossRefView Record in ScopusGoogle Scholar[673]
A. Fildes, J. Charlton, C. Rudisill, P. Littlejohns, A.T. Prevost, M.C. Gulliford
Probability of an Obese Person Attaining Normal Body Weight: Cohort Study Using Electronic Health Records
Am. J. Public Health, 105 (9) (2015), pp. e54-e59
View Record in ScopusGoogle Scholar[674]
E. Fothergill, J. Guo, L. Howard, J.C. Kerns, N.D. Knuth, R. Brychta, K.Y. Chen, M.C. Skarulis, M. Walter, P.J. Walter, K.D. Hall
Persistent metabolic adaptation 6 years after “The Biggest Loser” competition
Obesity (Silver Spring) (2016), p. n/a-n/a.
R.E. Brown, A.M. Sharma, C.I. Ardern, P. Mirdamadi, P. Mirdamadi, J.L. Kuk
Secular differences in the association between caloric intake, macronutrient intake, and physical activity with obesity
Obesity research & clinical practice, 10 (3) (2015), pp. 243-255
View Record in ScopusGoogle Scholar[676]
P.J. Teixeira, E.V. Carraça, M.M. Marques, H. Rutter, J.-M. Oppert, I. De Bourdeaudhuij, J. Lakerveld, J. Brug
Successful behavior change in obesity interventions in adults: a systematic review of self-regulation mediators
BMC Medicine, 13 (2015), p. 84
View Record in ScopusGoogle Scholar[677]R.R. Newbold, Perinatal Exposure to Endocrine Disrupting Chemicals with Estrogenic Activity and the Development of Obesity, in: R.H. Lustig (Ed.), Obesity Before Birth, Springer US2011, pp. 367-382.
S.A. Johnson, M.S. Painter, A.B. Javurek, M.R. Ellersieck, C.E. Wiedmeyer, J.P. Thyfault, C.S. Rosenfeld
Sex-dependent effects of developmental exposure to bisphenol A and ethinyl estradiol on metabolic parameters and voluntary physical activity
J Dev Orig Health Dis (2015), pp. 1-14
Google Scholar[679]C.M. Hales, M.D. Carroll, C.D. Fryar, C.L. Ogden, Prevalence of Obesity Among Adults and Youth: United States, 2015-2016, NCHS data brief (288) (2017) 1-8.
X. Jiang, H. Ma, Y. Wang, Y. Liu
Early life factors and type 2 diabetes mellitus
J. Diabetes Research, 2013 (2013), Article 485082
View Record in ScopusGoogle Scholar[681]
M.G. Myers, R.L. Leibel, R.J. Seeley, M.W. Schwartz
Obesity and Leptin Resistance: Distinguishing Cause from Effect
Trends in endocrinology and metabolism: TEM, 21 (11) (2010), pp. 643-651
ArticleDownload PDFView Record in ScopusGoogle Scholar[682]
R.M. Sargis, J.J. Heindel, V. Padmanabhan
Interventions to Address Environmental Metabolism-Disrupting Chemicals: Changing the Narrative to Empower Action to Restore Metabolic Health
Front. Endocrinol., 10 (33) (2019)
S. Shaikh, J.S. Jagai, C. Ashley, S. Zhou, R.M. Sargis
Underutilized and Under Threat: Environmental Policy as a Tool to Address Diabetes Risk
Curr Diab Rep, 18 (5) (2018), p. 25 View PDF
CrossRefView Record in ScopusGoogle Scholar[684]
K.G. Harley, K. Kogut, D.S. Madrigal, M. Cardenas, I.A. Vera, G. Meza-Alfaro, J. She, Q. Gavin, R. Zahedi, A. Bradman, B. Eskenazi, K.L. Parra
Reducing Phthalate, Paraben, and Phenol Exposure from Personal Care Products in Adolescent Girls: Findings from the HERMOSA Intervention Study
Environ. Health Perspect., 124 (10) (2016), pp. 1600-1607
View Record in ScopusGoogle Scholar[685]
R.A. Rudel, J.M. Gray, C.L. Engel, T.W. Rawsthorne, R.E. Dodson, J.M. Ackerman, J. Rizzo, J.L. Nudelman, J.G. Brody
Food packaging and bisphenol A and bis(2-ethyhexyl) phthalate exposure: findings from a dietary intervention
Environ. Health Perspect., 119 (7) (2011), pp. 914-920 View PDF
CrossRefView Record in ScopusGoogle Scholar[686]
S. Sathyanarayana, G. Alcedo, B.E. Saelens, C. Zhou, R.L. Dills, J. Yu, B. Lanphear
Unexpected results in a randomized dietary trial to reduce phthalate and bisphenol A exposures
J. Eposure Sci. Environ. Epidemiol., 23 (4) (2013), pp. 378-384 View PDF
CrossRefView Record in ScopusGoogle Scholar[687]
I.K. Lai, K. Dhakal, G.S. Gadupudi, M. Li, G. Ludewig, L.W. Robertson, A.K. Olivier
N-acetylcysteine (NAC) diminishes the severity of PCB 126-induced fatty liver in male rodents
Toxicology, 302 (1) (2012), pp. 25-33
ArticleDownload PDFView Record in ScopusGoogle Scholar[688]
M. Rezaei, M.J. Khodayar, E. Seydi, A. Soheila, I.K. Parsi
Acute, but not Chronic, Exposure to Arsenic Provokes Glucose Intolerance in Rats: Possible Roles for Oxidative Stress and the Adrenergic Pathway, Can J
Diabetes, 41 (3) (2017), pp. 273-280
ArticleDownload PDFView Record in ScopusGoogle Scholar[689]
B. Hennig, L. Ormsbee, C.J. McClain, B.A. Watkins, B. Blumberg, L.G. Bachas, W. Sanderson, C. Thompson, W.A. Suk
Nutrition Can Modulate the Toxicity of Environmental Pollutants: Implications in Risk Assessment and Human Health
Environ. Health Perspect., 120 (6) (2012), pp. 771-774 View PDF
CrossRefView Record in ScopusGoogle Scholar[690]
P. Gupta, B.L. Thompson, B. Wahlang, C.T. Jordan, H.J. Zach, B. Hennig, T. Dziubla
The environmental pollutant, polychlorinated biphenyls, and cardiovascular disease: a potential target for antioxidant nanotherapeutics, Drug Deliv
Transl. Res (2017)
S. Amjad, M.S. Rahman, M.G. Pang
Role of Antioxidants in Alleviating Bisphenol A Toxicity
Biomolecules, 10 (8) (2020)
W. Zwierello, A. Maruszewska, M. Skorka-Majewicz, M. Goschorska, I. Baranowska-Bosiacka, K. Dec, D. Styburski, A. Nowakowska, I. Gutowska
The influence of polyphenols on metabolic disorders caused by compounds released from plastics – Review
Chemosphere, 240 (2019), Article 124901
W. Guo, K. Huen, J.S. Park, M. Petreas, S.S. Crispo, G. Block, N. Holland
Vitamin C intervention may lower the levels of persistent organic pollutants in blood of healthy women – A pilot study
Food Chem. Toxicol., 92 (2016), pp. 197-204
ArticleDownload PDFView Record in ScopusGoogle Scholar[694]
A. Mengozzi, F. Carli, L. Guiducci, F. Parolini, E. Biancalana, A. Gastaldelli, A. Solini
SGLT2 inhibitors and thiazide enhance excretion of DEHP toxic metabolites in subjects with type 2 diabetes: A randomized clinical trial
Environ. Res., 192 (2021), Article 110316
ArticleDownload PDFView Record in ScopusGoogle Scholar[695]
M. Rameshrad, B.M. Razavi, M. Imenshahidi, H. Hosseinzadeh
Vitis vinifera (grape) seed extract and resveratrol alleviate bisphenol-A-induced metabolic syndrome: Biochemical and molecular evidences
Phytother. Res. (2019)
M. Fadishei, R.M. Ghasemzadeh, M. Imenshahidi, A. Mohajeri, B.M. Razavi, H. Hosseinzadeh
Effects of Nigella sativa oil and thymoquinone against bisphenol A-induced metabolic disorder in rats
Phytother. Res., 35 (4) (2020), pp. 2005-2024
R.A. Elgawish, M.A. El-Beltagy, R.M. El-Sayed, A.A. Gaber, H.M.A. Abdelrazek
Protective role of lycopene against metabolic disorders induced by chronic bisphenol A exposure in rats
Environ. Sci. Pollut. Res, Int (2020)
J. Park, K. Choi, J. Lee, J.M. Jung, Y. Lee
The Effect of Korean Red Ginseng on Bisphenol A-Induced Fatty Acid Composition and Lipid Metabolism-Related Gene Expression Changes
Am. J. Chin. Med., 48 (8) (2020), pp. 1841-1848 View PDF
CrossRefView Record in ScopusGoogle Scholar[699]
S. Sakuma, M. Sumida, Y. Endoh, A. Kurita, A. Yamaguchi, T. Watanabe, T. Kohda, Y. Tsukiyama, Y. Fujimoto
Curcumin inhibits adipogenesis induced by benzyl butyl phthalate in 3T3-L1 cells
Toxicol. Appl. Pharmacol., 329 (2017), pp. 158-164
ArticleDownload PDFView Record in ScopusGoogle Scholar[700]
S.I. Choi, J.S. Lee, S. Lee, W.S. Sim, Y.C. Kim, O.H. Lee
Potentilla rugulosa Nakai Extract Attenuates Bisphenol A-, S- and F-Induced ROS Production and Differentiation of 3T3-L1 Preadipocytes in the Absence of Dexamethasone, Antioxidants
(Basel), 9 (2(2)) (2020), pp. 3041-3050 View PDF
CrossRefView Record in ScopusGoogle Scholar[701]
K. Zhu, Y. Zhao, Y. Yang, Y. Bai, T. Zhao
Icariin Alleviates Bisphenol A Induced Disruption of Intestinal Epithelial Barrier by Maintaining Redox Homeostasis In Vivo and In Vitro
ACS Omega, 5 (32) (2020), pp. 20399-20408 View PDF
CrossRefView Record in ScopusGoogle Scholar[702]
K. Baralić, K. Živančević, D. Jorgovanović, D. Javorac, J. Radovanović, T. Gojković, A.B. Djordjevic, M. Ćurčić, Z. Mandinić, Z. Bulat, B. Antonijević, D. Đukić-Ćosić
Probiotic reduced the impact of phthalates and bisphenol A mixture on type 2 diabetes mellitus development: merging bioinformatics with in vivo analysis
Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 112325 (2021)
H.F. Vahdati, S. Mehri, K. Abnous, R. Birner-Gruenberger, H. Hosseinzadeh
Protective effect of crocin on BPA-induced liver toxicity in rats through inhibition of oxidative stress and downregulation of MAPK and MAPKAP signaling pathway and miRNA-122 expression
Food Chem. Toxicol., 107 (Pt A) (2017), pp. 395-405
N.C. Akcay, S. Omeroglu, S.O.A. Dizakar, M. Kavutcu, I. Turkoglu, M.A. Esmekaya, T.V. Peker
The effects of melatonin on possible damage that will occur on adipocytokines and liver tissue by coadministration of fructose and bisphenol a (BPA)
Environ. Sci. Pollut. Res. Int. (2020)
S.M. Poormoosavi, H. Najafzadehvarzi, M.A. Behmanesh, R. Amirgholami
Protective effects of Asparagus officinalis extract against Bisphenol A- induced toxicity in Wistar rats
Toxicol. Rep., 5 (2018), pp. 427-433
ArticleDownload PDFView Record in ScopusGoogle Scholar[706]
S. Geng, S. Wang, W. Zhu, C. Xie, X. Li, J. Wu, J. Zhu, Y. Jiang, X. Yang, Y. Li, Y. Chen, X. Wang, Y. Meng, M. Zhu, R. Wu, C. Huang, C. Zhong
Curcumin attenuates BPA-induced insulin resistance in HepG2 cells through suppression of JNK/p38 pathways
Toxicol. Lett., 272 (2017), pp. 75-83
ArticleDownload PDFView Record in ScopusGoogle Scholar[707]
W.C. Huang, K.Y. Liao, S.K. Hsieh, P.H. Pan, Y.H. Kuan, S.L. Liao, C.J. Chen, W.Y. Chen
Magnesium lithospermate B supplementation improved prenatal Bisphenol A exposure-induced metabolic abnormalities in male offspring
Environ. Toxicol. (2021)
R.J. Jandacek, J.E. Heubi, D.D. Buckley, J.C. Khoury, W.E. Turner, A. Sjodin, J.R. Olson, C. Shelton, K. Helms, T.D. Bailey, S. Carter, P. Tso, M. Pavuk
Reduction of the body burden of PCBs and DDE by dietary intervention in a randomized trial
J. Nutr. Biochem., 25 (4) (2014), pp. 483-488
ArticleDownload PDFView Record in ScopusGoogle Scholar[709]
T. Iida, R. Nakagawa, H. Hirakawa, T. Matsueda, K. Morita, K. Hamamura, J. Nakayama, Y. Hori, Y.L. Guo, F.M. Chang, et al.
Clinical trial of a combination of rice bran fiber and cholestyramine for promotion of fecal excretion of retained polychlorinated dibenzofuran and polychlorinated biphenyl in Yu-Cheng patients
Fukuoka Igaku Zasshi, 86 (5) (1995), pp. 226-233
View Record in ScopusGoogle Scholar[710]
T. Takasuga, K. Senthilkumar, H. Takemori, E. Ohi, H. Tsuji, J. Nagayama
Impact of FEBRA (fermented brown rice with Aspergillus oryzae) intake and concentrations of PCDDs
PCDFs and PCBs in blood of humans from Japan, Chemosphere, 57 (10) (2004), pp. 1409-1426
ArticleDownload PDFView Record in ScopusGoogle Scholar[711]
A. Geusau, S. Schmaldienst, K. Derfler, O. Papke, K. Abraham
Severe 2,3,7,8-tetrachlorodibenzo- p-dioxin (TCDD) intoxication: kinetics and trials to enhance elimination in two patients
Arch. Toxicol., 76 (5–6) (2002), pp. 316-325
View Record in ScopusGoogle Scholar[712]
J.W. Anderson, P. Baird, R.H. Davis Jr., S. Ferreri, M. Knudtson, A. Koraym, V. Waters, C.L. Williams
Health benefits of dietary fiber
Nutr. Rev., 67 (4) (2009), pp. 188-205 View PDF
CrossRefView Record in ScopusGoogle Scholar[713]
M.K. Shih, Y.L. Tain, Y.W. Chen, W.H. Hsu, Y.T. Yeh, S.K.C. Chang, J.X. Liao, C.Y. Hou
Resveratrol Butyrate Esters Inhibit Obesity Caused by Perinatal Exposure to Bisphenol A in Female Offspring Rats, Molecules (Basel
Switzerland), 26 (13) (2021)
R.W. Stahlhut, J.P. Myers, J.A. Taylor, A. Nadal, J.A. Dyer, F.S. vom Saal
Experimental BPA Exposure and Glucose-Stimulated Insulin Response in Adult Men and Women
J. Endocr. Soc., 2 (10) (2018), pp. 1173-1187 View PDF
CrossRefView Record in ScopusGoogle Scholar[715]
T.A. Hagobian, A. Bird, S. Stanelle, D. Williams, A. Schaffner, S. Phelan
Pilot Study on the Effect of Orally Administered Bisphenol A on Glucose and Insulin Response in Nonobese Adults
J. Endocr. Soc., 3 (3) (2019), pp. 643-654 View PDF
S. Bae, Y.C. Hong
Exposure to bisphenol A from drinking canned beverages increases blood pressure: randomized crossover trial
Hypertension, 65 (2) (2015), pp. 313-319
View Record in ScopusGoogle Scholar[717]
J.H. Kim, Y.H. Cho, Y.C. Hong
MicroRNA expression in response to bisphenol A is associated with high blood pressure
Environ. Int., 141 (2020), Article 105791
ArticleDownload PDFView Record in ScopusGoogle Scholar[718]
D.B. Miller, A.J. Ghio, E.D. Karoly, L.N. Bell, S.J. Snow, M.C. Madden, J. Soukup, W.E. Cascio, M.I. Gilmour, U.P. Kodavanti
Ozone Exposure Increases Circulating Stress Hormones and Lipid Metabolites in Humans
Am. J. Respir. Crit. Care Med. (2016)
H. Li, J. Cai, R. Chen, Z. Zhao, Z. Ying, L. Wang, J. Chen, K. Hao, P.L. Kinney, H. Chen, H. Kan
Particulate Matter Exposure and Stress Hormone Levels: A Randomized
Double-Blind, Crossover Trial of Air Purification, Circulation, 136 (7) (2017), pp. 618-627
View Record in ScopusGoogle Scholar[720]
K.C. Makris, C. Konstantinou, X.D. Andrianou, P. Charisiadis, A. Kyriacou, M.O. Gribble, C.A. Christophi
A cluster-randomized crossover trial of organic diet impact on biomarkers of exposure to pesticides and biomarkers of oxidative stress/inflammation in primary school children
PLoS ONE, 14 (9) (2019), Article e0219420 View PDF
CrossRefView Record in ScopusGoogle Scholar[721]
U. Luderer, B. Eskenazi, R. Hauser, K.S. Korach, C.M. McHale, F. Moran, L. Rieswijk, G. Solomon, O. Udagawa, L. Zhang, M. Zlatnik, L. Zeise, M.T. Smith
Proposed Key Characteristics of Female Reproductive Toxicants as an Approach for Organizing and Evaluating Mechanistic Data in Hazard Assessment
Environ. Health Perspect., 127 (7) (2019), p. 75001
X. Arzuaga, M.T. Smith, C.F. Gibbons, N.E. Skakkebæk, E.E. Yost, B.E.J. Beverly, A.K. Hotchkiss, R. Hauser, R.L. Pagani, S.M. Schrader, L. Zeise, G.S. Prins
Proposed Key Characteristics of Male Reproductive Toxicants as an Approach for Organizing and Evaluating Mechanistic Evidence in Human Health Hazard Assessments
Environ. Health Perspect., 127 (6) (2019), p. 65001
View Record in ScopusGoogle Scholar[723]
J.M. Braun, K. Gray
Challenges to studying the health effects of early life environmental chemical exposures on children’s health
PLoS Biol., 15 (12) (2017), Article e2002800 View PDF
CrossRefView Record in ScopusGoogle Scholar[724]
L. Lind, S. Salihovic, E. Lampa, P.M. Lind
Mixture effects of 30 environmental contaminants on incident metabolic syndrome-A prospective study
Environ. Int., 107 (2017), pp. 8-15
ArticleDownload PDFView Record in ScopusGoogle Scholar[725]
K.W. Taylor, B.R. Joubert, J.M. Braun, C. Dilworth, C. Gennings, R. Hauser, J.J. Heindel, C.V. Rider, T.F. Webster, D.J. Carlin
Statistical Approaches for Assessing Health Effects of Environmental Chemical Mixtures in Epidemiology: Lessons from an Innovative Workshop
Environ. Health Perspect., 124 (12) (2016), pp. A227-A229
J.M. Braun, C. Gennings, R. Hauser, T.F. Webster
What Can Epidemiological Studies Tell Us about the Impact of Chemical Mixtures on Human Health?
Environ. Health Perspect., 124 (1) (2016), pp. A6-A9
View Record in ScopusGoogle Scholar[727]
N. Lazarevic, A.G. Barnett, P.D. Sly, L.D. Knibbs
Statistical Methodology in Studies of Prenatal Exposure to Mixtures of Endocrine-Disrupting Chemicals: A Review of Existing Approaches and New Alternatives
Environ. Health Perspect., 127 (2) (2019), p. 26001
S. Santos, L. Maitre, C. Warembourg, L. Agier, L. Richiardi, X. Basagaña, M. Vrijheid
Applying the exposome concept in birth cohort research: a review of statistical approaches
Eur. J. Epidemiol., 35 (3) (2020), pp. 193-204 View PDF
CrossRefView Record in ScopusGoogle Scholar[729]
M. Esteban López, T. Göen, H. Mol, S. Nübler, K. Haji-Abbas-Zarrabi, H.M. Koch, M. Kasper-Sonnenberg, D. Dvorakova, J. Hajslova, J.P. Antignac, V. Vaccher, I. Elbers, C. Thomsen, K. Vorkamp, S. Pedraza-Díaz, M. Kolossa-Gehring, A. Castaño
The European human biomonitoring platform – Design and implementation of a laboratory quality assurance/quality control (QA/QC) programme for selected priority chemicals
Int. J. Hyg. Environ. Health, 234 (2021), Article 113740
ArticleDownload PDFView Record in ScopusGoogle Scholar[730]
J.P. Bonde, E.M. Flachs, S. Rimborg, C.H. Glazer, A. Giwercman, C.H. Ramlau-Hansen, K.S. Hougaard, B.B. Høyer, K.K. Hærvig, S.B. Petersen, L. Rylander, I.O. Specht, G. Toft, E.V. Bräuner
The epidemiologic evidence linking prenatal and postnatal exposure to endocrine disrupting chemicals with male reproductive disorders: a systematic review and meta-analysis
Human reproduction update, 23 (1) (2016), pp. 104-125 View PDF
CrossRefView Record in ScopusGoogle Scholar[731]
R.J. Williams, T. Tse, W.R. Harlan, D.A. Zarin
Registration of observational studies: is it time?
CMAJ, 182 (15) (2010), pp. 1638-1642 View PDF
CrossRefView Record in ScopusGoogle Scholar[732]
A. Kanj, D. Levine
Overcoming obesity: Weight-loss drugs are underused
Cleve Clin J Med, 87 (10) (2020), pp. 602-604 View PDF
CrossRefView Record in ScopusGoogle Scholar[733]
F. Hill-Briggs, N.E. Adler, S.A. Berkowitz, M.H. Chin, T.L. Gary-Webb, A. Navas-Acien, P.L. Thornton, D. Haire-Joshu
Social Determinants of Health and Diabetes: A Scientific Review
Diabetes Care, 44 (1) (2020), pp. 258-279
A.S. Alberga, I.Y. Edache, M. Forhan, S. Russell-Mayhew
Weight bias and health care utilization: a scoping review
Prim Health Care Res Dev, 20 (2019), Article e116
View Record in ScopusGoogle Scholar[735]
A.M. Calafat, J. Weuve, X. Ye, L.T. Jia, H. Hu, S. Ringer, K. Huttner, R. Hauser
Exposure to bisphenol A and other phenols in neonatal intensive care unit premature infants
Environ. Health Perspect., 117 (4) (2009), pp. 639-644 View PDF
CrossRefView Record in ScopusGoogle Scholar[736]
B.S. Rubin, M. Paranjpe, T. DaFonte, C. Schaeberle, A.M. Soto, M. Obin, A.S. Greenberg
Perinatal BPA exposure alters body weight and composition in a dose specific and sex specific manner: the addition of peripubertal exposure exacerbates adverse effects in female mice
Reprod. Toxicol. (2016)
K.P. Lai, Y.T. Chung, R. Li, H.T. Wan, C.K. Wong
Bisphenol A alters gut microbiome: Comparative metagenomics analysis, Environmental pollution (Barking
Essex, 218 (2016) (1987), pp. 923-930
View Record in ScopusGoogle Scholar[738]
Y. Zhang, T. Dong, W. Hu, X. Wang, B. Xu, Z. Lin, T. Hofer, P. Stefanoff, Y. Chen, X. Wang, Y. Xia
Association between exposure to a mixture of phenols, pesticides, and phthalates and obesity: Comparison of three statistical models
Environ. Int., 123 (2019), pp. 325-336
ArticleDownload PDFCrossRefGoogle Scholar[739]
E.M. Philips, S. Santos, E.A.P. Steegers, A.G. Asimakopoulos, K. Kannan, L. Trasande, V.W.V. Jaddoe
Maternal bisphenol and phthalate urine concentrations and weight gain during pregnancy
Environ. Int., 135 (2020), Article 105342
ArticleDownload PDFView Record in ScopusGoogle Scholar[740]
N. Güil-Oumrait, D. Valvi, R. Garcia-Esteban, M. Guxens, J. Sunyer, M. Torrent, M. Casas, M. Vrijheid
Prenatal exposure to persistent organic pollutants and markers of obesity and cardiometabolic risk in Spanish adolescents
Environ. Int., 151 (2021), Article 106469
ArticleDownload PDFView Record in ScopusGoogle Scholar
Tradução livre, parcial, de Luiz Jacques Saldanha, maio de 2022.


