https://www.ehn.org/wieless-radiation-sperm-damage-2671188907.html
Teodora Scarato e Katherine McMahon
20 de fevereiro de 2025
[NOTA DO WEBSITE: Material extremamente importante já que toca num tema no qual estamos completamente submersos: os instrumentos de comunicação associados à radiações eletromagnéticas. E aqui em destaque os telefones celulares. Esse tema já vinha sendo tratado há muitos anos e já existiam muitas pesquisas e constatações que estavam sendo desqualificadas e colocadas ao lado. Nada mais congruente. No entanto, não mais se concebe, vivermos sem sua presença e seu uso cotidiano tanto para atividades profissionais como nas relações interpessoais e familiares. No entanto, não poderemos mais ficar alheios a esta realidade que possamos ficar perturbados, mas um ponto é fundamental. Jamais esquecer nossos meninos! Dada sua importância, resolvemos publicar também todo o texto da pesquisa, abaixo, para os que quiserem aprofundar seus conhecimento sobre essa realidade].
A radiação do campo eletromagnético (EMF) de celulares e dispositivos sem fio pode danificar a qualidade do esperma e o tecido testicular em estudos com animais, de acordo com uma revisão científica recente publicada na Frontiers in Reproductive Health .
Resumidamente:
- Ratos, camundongos e coelhos expostos à radiação do telefone celular apresentaram menor contagem de espermatozoides, menor motilidade e viabilidade prejudicada.
- Estudos também encontraram diminuição da testosterona e alterações no tecido testicular, como impactos no túbulo seminífero, onde o espermatozoide é produzido.
- Foi descoberto que a exposição aumenta o estresse oxidativo, o que prejudica a função celular e interrompe a produção saudável de espermatozoides.
Citação chave:
“Como precaução, medidas preventivas são recomendadas para minimizar os riscos potenciais da exposição ao telefone celular, e mais pesquisas são necessárias para entender completamente seus efeitos na saúde reprodutiva humana.”
Por que isso é importante:
As taxas de fertilidade estão diminuindo em todo o mundo, com a infertilidade afetando 15% dos casais globalmente. Cientistas atribuem essa tendência a riscos ambientais, como produtos químicos disruptores endócrinos, mudanças climáticas, poluição por microplásticos e radiação EMF. Hábitos diários com dispositivos sem fio – como carregar celulares nos bolsos ou usar laptops no colo – podem resultar em exposição significativa a EMF nos órgãos reprodutivos. Embora especialistas médicos recomendem reduzir a exposição, o público em geral desconhece. Os limites regulatórios dos EUA estão desatualizados e ignoram os impactos reprodutivos dos EMF, apesar de uma ordem judicial federal de 2021 exigir uma revisão de tais riscos.
Cobertura EHN relacionada :
- Radiação 6G afeta as taxas de fertilidade de ratos machos, segundo novo estudo
- Radiação de dispositivos sem fio interrompe função testicular em ratos
Mais recursos:
- ASSISTA: Ciência sobre os riscos à saúde da radiação sem fio pela Dra. Linda Birnbaum, ex-diretora do Instituto Nacional de Ciências da Saúde Ambiental
Assefa, Ebrahim & Abdu, Seid para Frontiers in Reproductive Health vol. 6. 16 de janeiro de 2025
Tradução livre, parcial, de Luiz Jacques Saldanha, março de 2025
Efeitos histopatológicos da exposição à radiação do telefone celular nos parâmetros dos testículos e espermatozoides: uma revisão sistemática da literatura de estudos com animais
https://www.frontiersin.org/journals/reproductive-health/articles/10.3389/ frph. 2024.1515166/full
Ebrahim Msaye Assefa e Seid Mohammed Abdu, Departamento de Ciências Biomédicas (Anatomia Clínica), Faculdade de Medicina, Faculdade de Medicina e Ciências da Saúde, Universidade Wollo, Dessie, Etiópia
16 de janeiro de 2025
Introdução: A infertilidade masculina, frequentemente atribuída à produção insuficiente de espermatozoides saudáveis e ativos, pode ser exacerbada pela radiação eletromagnética emitida por celulares, que interrompe a espermatogênese normal e leva a um declínio notável na qualidade do esperma. Os principais alvos dos danos induzidos por celulares nos testículos são as células de Leydig, os túbulos seminíferos e as células espermáticas. O objetivo desta revisão sistemática da literatura é identificar alterações histopatológicas nos testículos devido à exposição à radiação do celular e examinar seus efeitos nos parâmetros do espermatozoide em animais experimentais.
Métodos: Nesta revisão sistemática, uma extensa busca bibliográfica foi conduzida em bancos de dados como PubMed, ScienceDirect, Hinari e Google Scholar.
Resultados: Um total de 752 estudos foram identificados para triagem, e 18 estudos foram considerados elegíveis para extração de dados. Estudos identificaram alterações histopatológicas no tecido testicular causadas pela radiação do telefone celular, como redução do diâmetro do túbulo seminífero, espessura da túnica albugínea e do epitélio germinativo, hipoplasia das células de Leydig e aumento do espaço intertubular. Foi demonstrado que a exposição consistente à radiação do telefone celular reduz significativamente a contagem, a motilidade e a viabilidade dos espermatozoides, ao mesmo tempo em que aumenta a morfologia anormal dos espermatozoides em ratos, camundongos e coelhos machos.
Conclusão: Estudos em animais indicam que a radiação eletromagnética de telefones celulares pode impactar negativamente o tecido testicular e os parâmetros do esperma, incluindo contagem de espermatozoides, motilidade, viabilidade e morfologia. Como precaução, medidas preventivas são recomendadas para minimizar os riscos potenciais da exposição ao telefone celular, e mais pesquisas são necessárias para entender completamente seus efeitos na saúde reprodutiva humana.
Introdução
Infertilidade é a incapacidade de conceber após um ano de relações sexuais consistentes e desprotegidas (1). Cerca de 35% dos casos de infertilidade estão ligados a fatores masculinos (2). Comumente, a infertilidade masculina decorre da produção insuficiente de espermatozoide saudável e ativo (2, 3). Vários fatores de risco ligados à infertilidade masculina incluem anormalidades genéticas, bloqueio dos ductos genitais, varicocele, disfunção erétil e impotência (4). Fatores ambientais como calor, produtos químicos, radiação, álcool e fumo também desempenham um papel na redução da fertilidade (5, 6).
Nas últimas duas décadas, os telefones celulares se tornaram essenciais para a vida diária, com seu uso aumentando drasticamente (7). Os telefones celulares operam em um espectro de frequências que varia de 450 a 2.700 MHz, emitindo radiação eletromagnética (REM) enquanto funcionam (8). A taxa de absorção específica (SAR) mede a quantidade de energia de radiofrequência absorvida pelos tecidos dos telefones celulares. Dependendo do modelo, os valores de SAR para telefones celulares variam de 0,12 a 1,6 W/kg de peso corporal (9). Quando os telefones celulares são mantidos em bolsos próximos ao escroto, os testículos podem absorver a radiação eletromagnética emitida. Isso levantou preocupações sobre os potenciais efeitos à saúde nos órgãos reprodutores masculinos, particularmente os testículos (10, 11). Vários estudos indicaram que os testículos, especificamente as células de Leydig, são particularmente sensíveis à exposição à radiação eletromagnética (12).
O impacto do telefone celular na reprodução masculina permanece incerto devido a resultados conflitantes de vários estudos. No entanto, acredita-se que o EMR emitido por telefones celulares pode interromper a produção normal de espermatozoides, potencialmente diminuindo a qualidade do esperma. Estudos sugerem que o uso do telefone celular pode afetar a qualidade do sêmen, impactando a contagem de espermatozoides, motilidade, viabilidade e níveis séricos de testosterona, possivelmente desempenhando um papel na infertilidade masculina (7 , 13 – 15). Estudos em animais indicam que a exposição ao telefone celular pode levar a alterações prejudiciais nos testículos e afetar negativamente as células germinativas masculinas (16 – 19). Alguns pesquisadores não encontraram efeitos prejudiciais da exposição ao EMR emitido por telefones celulares, observando nenhuma alteração histológica nos testículos de ratos ou alterações nos níveis séricos de testosterona (20 , 21).
Características histológicas e funções dos testículos
Os testículos, localizados no escroto fora da cavidade abdominal, requerem uma temperatura mais baixa para o funcionamento adequado e produção de espermatozoides. Manter um telefone celular nos bolsos das calças e usá-lo por um longo período pode elevar a temperatura testicular, causando potencialmente hipertermia e estresse oxidativo (22). O estresse oxidativo nas células espermáticas, resultando em capacidade de fertilização prejudicada e danos ao DNA, está associado à diminuição da fertilidade (23).
Os testículos têm dois componentes primários: os túbulos seminíferos, que são responsáveis pela produção de espermatozoides, e as células de Leydig, que têm papel na produção do hormônio sexual masculino. A produção de espermatozoides, regulada pelos genes do cromossomo Y, geralmente leva cerca de 54 dias em ratos a partir do estágio de espermatogônia (24). Além disso, leva aproximadamente 12–21 dias para o espermatozoide viajar do testículo para o epidídimo e depois para o ducto ejaculatório. Durante esse tempo, o espermatozoide amadurece no epidídimo, adquirindo motilidade. As células de Leydig produzem testosterona, que desempenha um papel crucial na regulação da espermatogênese (10 , 25).
Os testículos, essenciais para o desenvolvimento e maturação do espermatozoide, são altamente suscetíveis à radiação, o que pode levar a danos genéticos (21). As membranas celulares do espermatozoide são ricas em ácidos graxos poliinsaturados (PUFAs), tornando-as vulneráveis a danos oxidativos de espécies reativas de oxigênio (ROS), o que pode resultar em peroxidação lipídica. Este processo prejudica a integridade da membrana e reduz a motilidade do espermatozoide (23). A radiação do telefone celular afeta principalmente as células de Leydig, os túbulos seminíferos e os espermatozoides. Esta exposição reduz a produção de testosterona, interfere na produção de espermatozoide e danifica seu DNA (26).
O exame histológico do testículo revela túbulos seminíferos, que são hexagonais ou arredondados em forma, separados por tecido conjuntivo intersticial. Dentro desses túbulos, diferentes estágios de células espermatogênicas são encontrados, mas apenas células de Sertoli e espermatogônias do epitélio seminífero estão situadas adjacentes à membrana basal. As células de Leydig, caracterizadas por citoplasma grande e acidófilo, residem no tecido intersticial entre os túbulos seminíferos. O epitélio germinativo contém camadas de células espermatogênicas, incluindo espermatogônias, espermatócitos primários e secundários, bem como precoces (redondos) e tardios (alongados). Os espermatozoides são livres no lúmen (27 , 28).
A espermatogênese é um processo sincronizado, complexo e longo que ocorre no epitélio germinativo dos testículos (29). Os testículos são sensíveis a estressores, tanto internos quanto externos, e a exposição à EMR pode romper as células germinativas em vários estágios de diferenciação, causando potencialmente infertilidade (30). Esta revisão sistemática da literatura tem como objetivo identificar alterações histopatológicas nos testículos devido à exposição à radiação do telefone celular e examinar seus efeitos nos parâmetros do espermatozoide em animais experimentais.
Métodos
Estratégia de busca bibliográfica
O estudo foi conduzido de acordo com as diretrizes Preferred Reporting Items for Systematic Reviews and Meta Analysis (PRISMA) 2020. Ele revisou relatórios de pesquisa sobre os efeitos histopatológicos da radiação do telefone celular nos parâmetros dos testículos e espermatozoides. Uma busca bibliográfica completa foi realizada usando bancos de dados como PubMed, ScienceDirect, Hinari e Google Scholar, juntamente com buscas manuais de listas de referências de artigos relevantes e sites universitários para identificar estudos adicionais.
As seguintes palavras-chave e termos foram utilizados para identificar estudos relevantes: “histopatologia”, “testículos”, “parâmetros espermáticos”, “exposição a telefones celulares”, “contagem de espermatozoides”, “motilidade espermática”, “viabilidade espermática”, “morfologia espermática”, “radiação eletromagnética”, “animais experimentais”.
Critérios de elegibilidade
Critérios de inclusão
✓ Tipo de estudos: estudos animais com língua inglesa
✓ Foram selecionados apenas estudos que incluíram um grupo controle ou comparador
✓ Ano de estudos: 2000 a 2021 foram incluídos no estudo
✓ Participantes: ratos (linhagens Sprague-Dawley e Wistar), camundongos albinos e coelhos
✓ Foram incluídos artigos completos sobre o tema de interesse
Critérios de exclusão
✓ Artigos incompletos e abstratos, assim como revisões, são omitidos da revisão.
✓ Alguns artigos com ideias redundantes também foram omitidos, pegando o mais recente.
Variáveis de estudo
✓ Características da exposição à radiação (por exemplo, frequência, duração)
✓ Alterações histopatológicas testiculares (por exemplo, diâmetro dos túbulos seminíferos, espessura da túnica albugínea, número de células de Sertoli e Leydig, degeneração do epitélio germinativo, etc.)
✓ Parâmetros do espermatozoides (por exemplo, suas contagem, motilidade, morfologia e viabilidade)
Abstração e análise de dados
Todos os estudos incluídos foram examinados em detalhes e um resultado relatado de cada estudo animal, como alterações histopatológicas e parâmetros de espermatozoide de animais do grupo exposto e controle, foram resumidos. Então, os dados foram analisados usando o método de análise qualitativa e, finalmente, apresentados em texto e tabelas.
Resultados e discussão
Um total de 752 artigos foram identificados por meio de buscas por palavras-chave. Trezentos e sete artigos duplicados e 376 adicionais após a triagem de títulos e resumos, e 51 artigos após a triagem do conteúdo completo dos estudos foram excluídos com base nos critérios de seleção. Finalmente, um total de 18 artigos que preencheram os critérios de inclusão foram revisados (Figura 1).
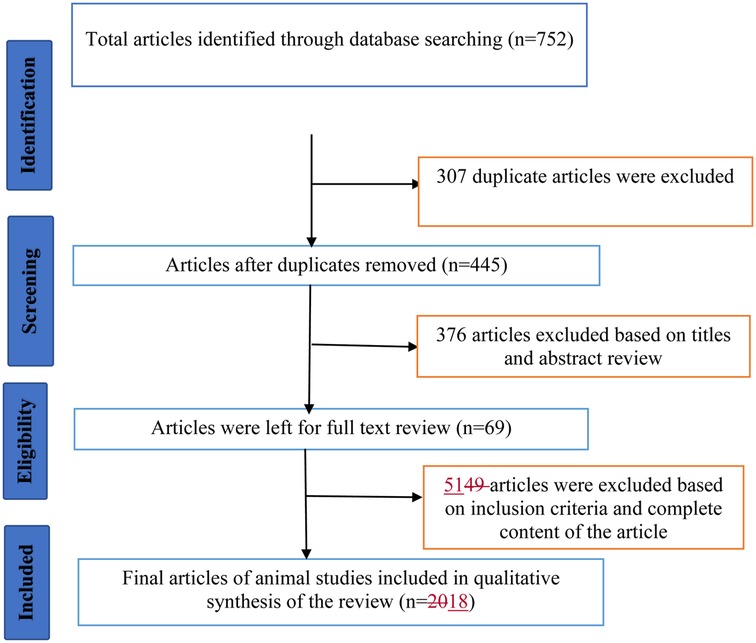
Figura 1. Um diagrama de fluxo ilustrando o processo de revisão.
Alterações histopatológicas dos testículos devido à exposição à radiação do telefone celular
Pesquisas exploraram as mudanças de tecido nos testículos resultantes da exposição ao EMR de telefones celulares. Essas alterações são influenciadas por fatores como a duração da exposição, a taxa de absorção específica (SAR) e os níveis de energia do EMR (Tabela 1).
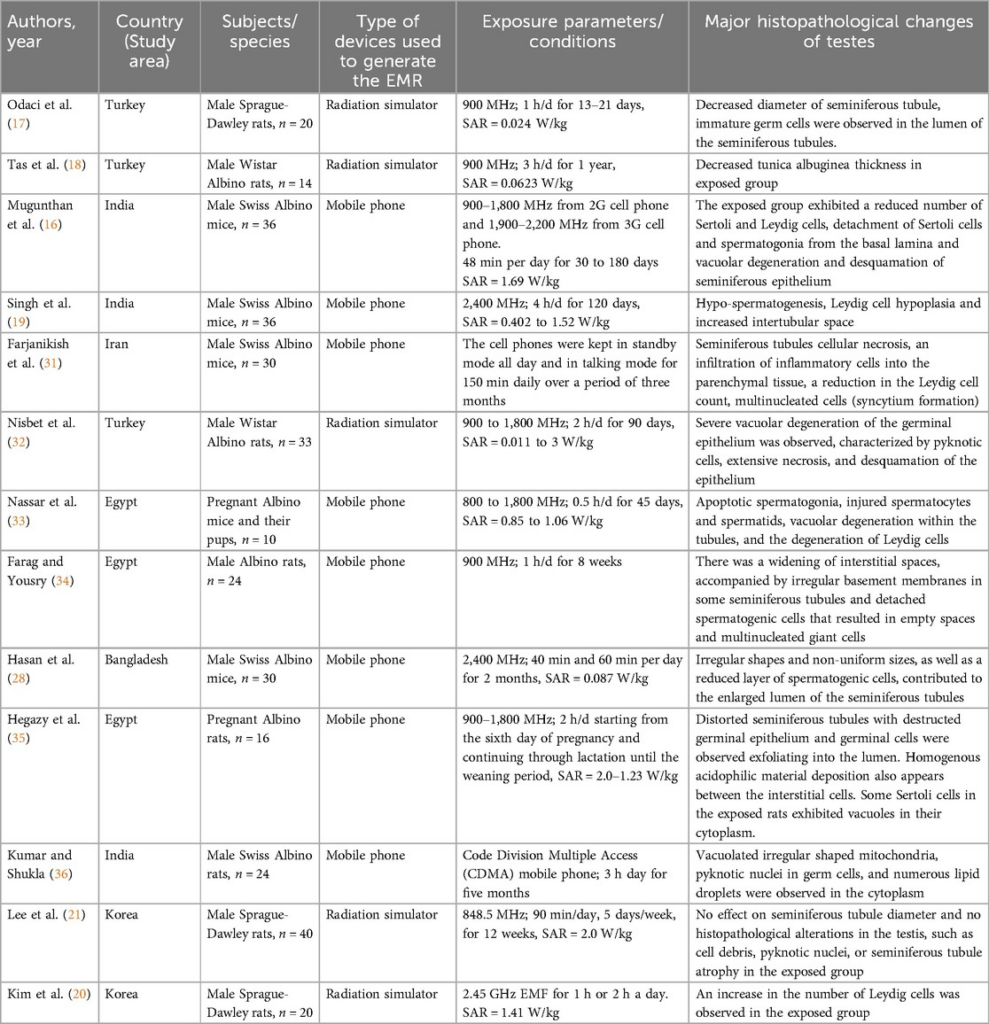
Tabela 1. Características dos estudos incluídos na revisão que mostra alterações histopatológicas da exposição à radiação do telefone celular nos testículos.
A exposição à irradiação de frequência extremamente baixa pode resultar na diminuição da contagem de espermatozoides e comprometimento da função reprodutiva nos testículos (37). A radiação eletromagnética pode aumentar o estresse oxidativo ao interromper o equilíbrio entre a produção de espécies reativas de oxigênio (ROS) e os mecanismos de defesa antioxidante do corpo, podendo levar a danos celulares stículos, o estresse oxidativo apresenta uma ameaça considerável, especialmente nos túbulos seminíferos. A exposição à EMR e ao calor pode enfraquecer a barreira hemato-testicular, resultando na degeneração das espermatogônias (39).
A exposição prolongada à EMR de 2,4 GHz induz mudanças na morfologia geral dos testículos de ratos, resultando em uma diminuição no diâmetro dos túbulos seminíferos foi observada nos ratos expostos (40). A exposição à EMR diminuiu tanto o diâmetro dos túbulos seminíferos quanto a espessura do epitélio germinativo (17 , 41). Saygin et al. indicaram que a exposição de curto prazo à EMR de 2,45 GHz não resultou em nenhuma alteração no diâmetro dos túbulos seminíferos (42). A diferença na duração da exposição entre os estudos pode ser responsável por essa variação. Além disso, Lee et al. também descobriram que a exposição à RF de 848,5 MHz por 12 semanas não teve efeito no diâmetro dos túbulos seminíferos (21).
Tas et al. descobriram que uma redução na espessura da túnica albugínea em ratos submetidos à exposição prolongada à radiação de radiofrequência de 900 MHz de telefones celulares (18). Dasdag et al. descobriram de forma semelhante que uma redução na espessura da túnica albugínea foi observada nos ratos expostos (40). As propriedades contráteis da túnica albugínea ajudam a impulsionar os espermatozoides dos testículos para o epidídimo (43). A diminuição da produção de colágenos Tipo I, Tipo III e Tipo V, bem como a diminuição da capacidade de proliferação de fibroblastos, podem levar ao afinamento da túnica albugínea (44).
A exposição prolongada à radiação de telefones celulares 2G em camundongos causou uma diminuição acentuada no peso dos testículos e nos diâmetros dos túbulos seminíferos. Além disso, a exposição à radiação 2G em camundongos levou a uma redução significativa no número de células de Sertoli e Leydig, resultando em uma queda significativa nos níveis séricos de testosterona (45). Estudos adicionais indicaram que a EMR de telefones celulares pode causar hipoplasia das células de Leydig e um aumento no espaço intertubular (19 , 31 ,36 ,46 – 48). As células de Leydig são particularmente vulneráveis à EMR, o que pode afetar adversamente sua estrutura e função, levando à redução dos níveis séricos de testosterona (49). Em contraste, a pesquisa de Kim et al. indicou que a exposição prolongada de ratos à radiação de 2,45 GHz resultou em um aumento no número de células de Leydig e níveis séricos mais elevados de testosterona (20). Outro estudo também indicou que o número médio de células de Sertoli no túbulo seminífero não mostrou diferença significativa entre os grupos exposto e controle (21).
A exposição à EMR impacta negativamente a estrutura do epitélio germinativo dentro dos túbulos seminíferos. Observou-se que as células espermatogênicas no epitélio estavam amplamente separadas por espaços vazios, com condensação de núcleos evidente nas células em divisão. O grupo exposto apresentou numerosos túbulos atípicos em vários estágios do desenvolvimento do espermatozoide, caracterizados por epitélio germinativo desorganizado ou ausente. A exposição dos testículos à EMR de 1800 MHz resultou em morfologia celular anormal em ratos, caracterizada por degeneração vacuolar grave do epitélio germinativo, juntamente com a presença de células picnóticas e necrose e descamação significativas do epitélio (32). Um estudo relacionado detectou de forma semelhante vacuolização e células gigantes no epitélio germinativo, juntamente com a presença de células anormais no lúmen dos túbulos seminíferos dentro do grupo exposto (50).
Nassar et al. examinaram os impactos da exposição à radiação não ionizante de telefones celulares em filhotes de camundongos durante o período intrauterino e após o nascimento. Eles observaram várias anormalidades histopatológicas nos testículos, incluindo desorganização e danos às células germinativas localizadas nos túbulos seminíferos. O estudo mostrou ainda a ocorrência de espermatogônias apoptóticas, espermatócitos e espermátides comprometidos, degeneração vacuolar intratubular e degeneração de células de Leydig (33). Naggar et al. descobriram que ratos machos expostos a EMR de 950 MHz por três horas por dia durante um período de dois meses levaram à degeneração, desorganização e atrofia em certos túbulos seminíferos, juntamente com espaços intersticiais expandidos. Eles também observaram membranas basais rompidas com células destacadas, celularidade reduzida e contagem de espermatozoides significativamente diminuída dentro dos lúmens dos túbulos seminíferos (48). Em contraste, outro estudo conduzido por Lee et al. ratos machos expostos a RF de 848,5 MHz CDMA baseado em telefone celular por 12 semanas e não encontraram alterações histopatológicas, incluindo detritos celulares, núcleos picnóticos ou atrofia dos túbulos seminíferos, no grupo exposto (21).
A exposição de camundongos a telefones celulares em modo de espera o dia todo e em modo de conversação por 150 minutos por dia durante 90 dias levou a alterações histopatológicas em seus testículos. O estudo revelou necrose celular em túbulos seminíferos e infiltração de células inflamatórias no tecido parenquimatoso. Além disso, alguns túbulos necrosados exibiram a presença de células multinucleadas, indicando a formação de sincício (31). Outro estudo conduzido em ratos machos exibiu túbulos seminíferos irregulares, um número reduzido de espermatogônias e a presença de células multinucleadas gigantes e espermatócitos primários esparsos com núcleos densamente condensados. Além disso, espermatócitos degenerados foram observados dentro dos lúmens dos túbulos seminíferos em ratos expostos à EMR (10).
O estudo de Farag e Yusry ilustrou uma arquitetura histológica distorcida em certos túbulos seminíferos, caracterizada por espaços intersticiais alargados. Além disso, membranas basais irregulares foram observadas, juntamente com células espermatogênicas separadas, deixando para trás espaços vazios. Além disso, células gigantes com múltiplos núcleos foram observadas (34). O alargamento dos espaços intersticiais pode resultar de espermatogênese prejudicada, levando a uma redução na altura do epitélio germinativo ao longo do diâmetro dos túbulos seminíferos. Células gigantes multinucleadas podem surgir da abertura de pontes citoplasmáticas que se desenvolvem entre células progenitoras, resultando na fusão de seus conteúdos celulares (51).
A análise histopatológica de testículos de camundongos expostos a 60 min de EMR de um telefone celular 4G revelou túbulos seminíferos de formato irregular e tamanho não uniforme. Esses túbulos exibiram menos camadas de células espermatogênicas, resultando em lúmens maiores desprovidos de espermatozoides (28). Esa et al. também descobriram que a EMR induziu alterações notáveis dentro dos túbulos seminíferos dos camundongos que foram expostos, levando a formas e dimensões irregulares (52). Chauhan et al. encontraram alterações no revestimento epitelial dos túbulos seminíferos, juntamente com uma redução no tamanho dos lúmens dos túbulos, juntamente com a redução da população de células, em camundongos expostos à radiação (53).
Hegazy et al. exploraram os impactos da exposição à radiação do telefone celular ocorrendo antes e depois do nascimento no desenvolvimento testicular do rato, descobrindo alterações degenerativas. Essas mudanças incluíram túbulos seminíferos distorcidos com epitélio germinativo rompido e a eliminação de células germinativas no lúmen. Além disso, a deposição de material acidofílico homogêneo foi observada entre as células intersticiais (35). Células germinativas esfoliadas podem resultar de conexões rompidas entre células de Sertoli e células germinativas em desenvolvimento (51). O aparecimento de material acidofílico homogêneo em alguns túbulos pode resultar da atividade fagocítica reduzida das células de Sertoli (34).
A exposição a um telefone celular por cinco meses induz alterações ultraestruturais no tecido testicular de ratos. Os achados incluem mitocôndrias vacuoladas de formato irregular, núcleos picnóticos em células germinativas e uma abundância de gotículas lipídicas no citoplasma (36). Os núcleos picnóticos observados em células germinativas podem ser atribuídos à degeneração de células germinativas em vários estágios de desenvolvimento após a exposição à radiação. Além disso, outro estudo observou a presença de vacúolos no citoplasma de certas células de Sertoli em ratos expostos (35). Os vacúolos observados em células de Sertoli podem ser devidos ao acúmulo de gotículas lipídicas que nutrem as células germinativas (54).
Efeito da exposição à radiação do telefone celular nos parâmetros do esperma
Pesquisas em animais experimentais, como ratos e camundongos, demonstraram que a exposição à radiação de telefones celulares afeta negativamente os parâmetros dos espermatozoides, incluindo uma redução significativa na contagem de espermatozoides epididimais, motilidade, viabilidade e um aumento na morfologia anormal dos espermatozoides (Tabela 2).
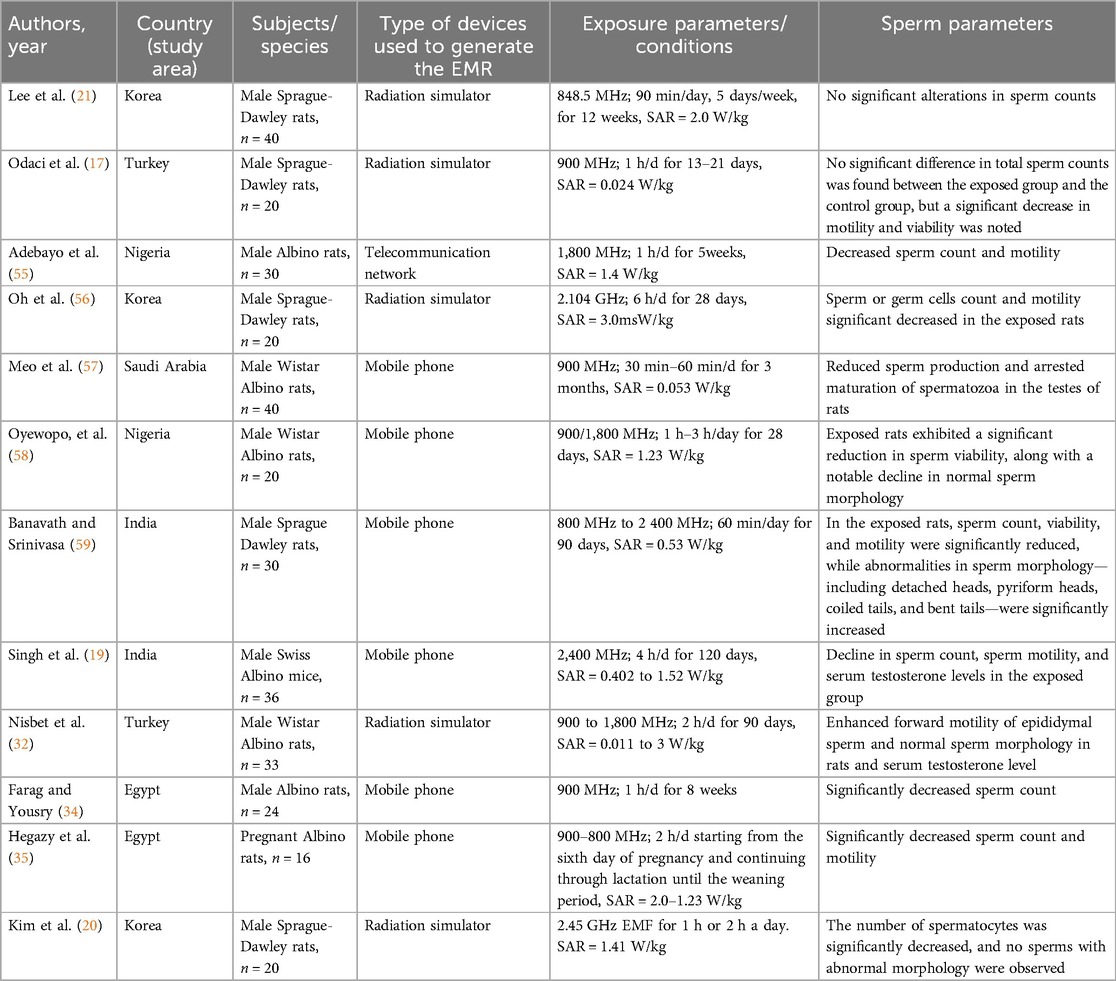
Tabela 2. Visão geral dos estudos incluídos na revisão que demonstram os efeitos da exposição à radiação do telefone celular nos parâmetros do espermatozoide.
Em ratos, o espermatozoide é coletado principalmente por meio da recuperação do epidídimo. Devido ao seu pequeno tamanho corporal, os testículos podem se mover fácil e regularmente entre o abdômen e o escroto através do canal inguinal (60). A exposição à radiação móvel em ratos machos causou uma redução significativa na contagem e na motilidade dos espermatozoides do epidídimo (61). Outro estudo revelou que a exposição a telefones celulares por 6 horas diárias durante 5 dias levou a uma redução na motilidade progressiva rápida das células espermáticas (14). Odaci et al. examinaram os efeitos da exposição pré-natal à EMR de 900 MHz na saúde testicular do rato e na qualidade do espermatozoide do epidídimo, encontrando sua motilidade reduzida e células germinativas imaturas no lúmen do túbulo seminífero de ratos expostos (17).
Vários estudos também relataram diminuição da contagem e motilidade dos espermatozoides em ratos e camundongos expostos à radiação não ionizante (27 , 55 , 62 – 65). A exposição à EMR afeta negativamente os parâmetros dos espermatozoides, causando alterações significativas no ciclo celular dos espermatozoides devido ao comprometimento das células de Leydig e Sertoli, que são cruciais para a proliferação celular (66). A exposição à EMR altera a atividade enzimática celular, levando à redução da produção de trifosfato de adenosina (ATP), essencial para a motilidade dos espermatozoides. Pesquisas experimentais indicam que a radiação do telefone celular eleva os níveis de radicais livres de oxigênio, levando ao estresse oxidativo (67 , 68). O estresse oxidativo no tecido testicular prejudica a função das células de Leydig (69) e interrompe a capacidade do epitélio germinativo de produzir espermatozoides normais ou passar pela espermatogênese (70). Os efeitos térmicos localizados da EMR podem contribuir para uma diminuição na contagem de espermatozoides (71).
A exposição prolongada à radiação do telefone celular pode prejudicar a espermatogênese. O estudo encontrou uma diminuição acentuada na contagem de espermatozoides, juntamente com a motilidade reduzida em ratos expostos à radiação (56). Isso pode ser devido a uma redução na contagem de células de Leydig, responsáveis pela secreção de testosterona, que por sua vez promove a espermatogênese. A exposição prolongada à radiação do telefone celular causou hipoespermatogênese e interrompeu a maturação dos espermatozoides nos testículos de ratos albinos Wistar (57). Isso pode ser atribuído à interrupção hormonal induzida pela EMR. Meo et al. examinaram os efeitos da radiação do telefone celular nos níveis séricos de testosterona em ratos albinos Wistar, revelando uma redução significativa nos níveis de testosterona entre aqueles expostos à radiação (72). A radiação do telefone celular afeta a morfologia reprodutiva e altera os níveis hormonais, como a testosterona sérica e o FSH, que são vitais para a espermatogênese e a maturação dos espermatozoides (73 , 74). Por outro lado, outro estudo não relatou alterações significativas na contagem de espermatozoides, incluindo o número de espermatócitos e espermátides redondas, durante a espermatogênese em ratos expostos à EMR de telefone celular (21).
Vários estudos também observaram uma redução acentuada na viabilidade do espermatozoide entre ratos expostos (58 , 59 , 75 – 78). A EMR pode impactar a função celular alterando a estrutura do canal iônico e a integridade da membrana plasmática. A diminuição da viabilidade do espermatozoide pode ser atribuída a interrupções induzidas por EMF nos mecanismos da membrana celular do esperma que regulam o fluxo de íons, particularmente sódio e potássio, afetando, em última análise, o conteúdo de água e a viabilidade do espermatozoide (79).
Hamdi et al. exploraram o impacto da exposição à EMR durante os estágios de desenvolvimento de camundongos nos tecidos testiculares na idade adulta. A pesquisa identificou várias anormalidades no esperma, incluindo espermatozoides de cauda dupla, espermatozoides sem cauda, espermatozoides exibindo formatos anormais de cabeça e aqueles com gotículas citoplasmáticas (27). Outro estudo indicou um aumento notável nas aberrações na morfologia do espermatozoide, incluindo cabeças destacadas, cabeças piriformes, caudas enroladas e caudas dobradas, entre ratos expostos à EMR (59). Estudos relataram danos ao DNA em células espermáticas após a exposição à EMR nos testículos. Esse dano pode estar correlacionado com as anormalidades observadas na cabeça do espermatozoide e na bainha mitocondrial da cauda do esperma (46 , 80). No entanto, um estudo de Kim et al. sobre a exposição de longo prazo de ratos a um campo eletromagnético de 2,45 GHz não encontrou efeitos significativos na morfologia do espermatozoide (20). A função espermática defeituosa é uma das principais causas de infertilidade masculina. A exposição excessiva do espermatozoide à radiação do telefone celular interrompe sua função ao afetar as mitocôndrias localizadas na parte central da cauda do espermatozoide, que são cruciais para a produção de ATP. Essa interrupção leva à geração de altos níveis de espécies reativas de oxigênio (ROS), contribuindo para a diminuição de sua motilidade. Estudos mostraram alterações no arranjo dos microtúbulos após a exposição à radiação do telefone celular. Em experimentos com ratos expostos a EMR, foram observadas mudanças significativas nos microtúbulos, resultando em anormalidades em sua cauda e afetando adversamente em sua motilidade. Além disso, a radiação pode interromper o acrossomo, potencialmente prejudicando a capacidade dos espermatozoides de penetrar nos ovócitos, contribuindo assim para a infertilidade (23 , 81).
Limitações
Os estudos incluídos variaram significativamente em termos de desenho experimental, protocolos de exposição à radiação, modelos animais e métodos de avaliação histopatológica. Essa heterogeneidade limitou a capacidade de tirar conclusões consistentes e impediu uma meta-análise. Os estudos usaram testes paramétricos sem verificar as suposições como normalidade e homogeneidade de variâncias, o que pode introduzir vieses e afetar a confiabilidade dos achados. Os estudos também tiveram tamanhos de amostra pequenos, o que pode afetar o poder estatístico e a generalização dos resultados.
Conclusão
Estudos em animais indicam que a radiação eletromagnética de telefones celulares pode impactar negativamente a histologia do tecido testicular e vários parâmetros do espermatozoide, afetando potencialmente a contagem, motilidade, viabilidade e morfologia do esperma. Portanto, é aconselhável ter cautela e implementar medidas preventivas para reduzir os riscos potenciais associados ao uso do telefone celular. Além disso, mais pesquisas são essenciais para obter uma compreensão abrangente dos efeitos da radiação do telefone celular na saúde reprodutiva humana.
Declaração de disponibilidade de dados
As contribuições originais apresentadas no estudo estão incluídas no artigo/Material Suplementar. Dúvidas adicionais podem ser direcionadas ao autor correspondente.
Contribuições do autor
EA: Conceitualização, Curadoria de dados, Metodologia, Supervisão, Visualização, Redação – rascunho original, Redação – revisão e edição. SA: Curadoria de dados, Supervisão, Redação – rascunho original, Redação – revisão e edição.
Financiamento
O(s) autor(es) declara(m) que nenhum apoio financeiro foi recebido para a pesquisa, autoria e/ou publicação deste artigo.
Agradecimentos
Os autores gostariam de expressar sua sincera gratidão a todos os colegas do departamento de Ciências Biomédicas da Faculdade de Medicina e Ciências da Saúde da Universidade Wollo por suas sugestões e apoio inestimáveis durante a preparação do manuscrito.
Conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Declaração de IA generativa
Os autores declaram que nenhuma IA generativa foi utilizada na criação deste manuscrito.
Nota do editor
Todas as alegações expressas neste artigo são exclusivamente dos autores e não representam necessariamente aquelas de suas organizações afiliadas, ou aquelas do editor, dos editores e dos revisores. Qualquer produto que possa ser avaliado neste artigo, ou alegação que possa ser feita por seu fabricante, não é garantido ou endossado pelo editor.
Referências
1. WHO. 2016. Multiple definitions of infertility. Available online at: https://www.who.int/reproductivehealth/topics/infertility/multiple-definitions/en/ (accessed 21 November). Google Scholar
2. Khaki A, Fathi AF, Nouri M, Khaki AA, Ozanci CC, Ghafari NM, et al. The effects of ginger on spermatogenesis and sperm parameters of rat. Iran J Reprod Med. (2009) 7(1):7–12. Google Scholar
3. Olea N, Fernandez MF. Chemicals in the environment and human male fertility. Occup Environ Med. (2007) 64:430–1. doi: 10.1136/oem.2007.033621. PubMed Abstract | Crossref Full Text | Google Scholar
4. Mohammadi F, Nikzad H, Taherian A, Mahabadi JA, Saleh M. Effects of herbal medicine on male infertility. Anat Sci. (2013) 10(4):3–16. Google Scholar
5. Pacey A. Environmental and lifestyle factors associated with sperm DNA damage. Hum Fertil. (2010) 13(4):189–93. doi: 10.3109/14647273.2010.531883. PubMed Abstract | Crossref Full Text | Google Scholar
6. Tremellen K. Oxidative stress and male infertility—a clinical perspective. Hum Reprod Update. (2008) 14(3):243–58. doi: 10.1093/humupd/dmn004. PubMed Abstract | Crossref Full Text | Google Scholar
7. Gorpinchenko I, Nikitin O, Banyra O, Shulyak A. The influence of direct mobile phone radiation on sperm quality. Cent European J Urol. (2014) 67(1):65–71. doi: 10.5173/ceju. 2014.01.art14. PubMed Abstract | Crossref Full Text | Google Scholar
8. Agarwal A, Desai NR, Makker K, Varghese A, Mouradi R, Sabanegh E, et al. Effects of radiofrequency electromagnetic waves (RF-EMW) from cellular phones on human ejaculated semen: an in vitro pilot study. Fertil Steril. (2009) 92(4):1318–25. doi: 10.1016/j.fertnstert.2008.08.022. PubMed Abstract | Crossref Full Text | Google Scholar
9. Kesari KK, Kumar S, Behari J. Mobile phone usage and male infertility in Wistar rats. Indian J Exp Biol. (2010) 48:987–92.21299041. PubMed Abstract | Google Scholar
10. Bin-Meferij MM, El-kott AF. The radioprotective effects of Moringa oleifera against mobile phone electromagnetic radiation-induced infertility in rats. J Clin Exp Med. (2015) 8(8):12487–97. Google Scholar
11. Karaman MI, Gokce AM, Koca O, Karaman B, Ozturk MI, Yurdakul N, et al. The effects of electromagnetic waves emitted by the cell phones on the testicular tissue. Arch Ital Urolrol. (2014) 30:274–7. doi: 10.4081/aiua.2014.4.274. Crossref Full Text | Google Scholar
12. Xu G, Intano GW, McCarrey JR, Walter RB, McMahan CA, Walter CA. Recovery of a low mutant frequency after ionizing radiation-induced mutagenesis during spermatogenesis. Mutat Res. (2008) 654(2):150–7. doi: 10.1016/j.mrgentox.2008.05.012. PubMed Abstract | Crossref Full Text | Google Scholar
13. Kilgallon SJ, Simmons LW. Image content influences men’s semen quality. Biol Lett. (2005) 1:253–5. doi: 10.1098/rsbl.2005.0324. PubMed Abstract | Crossref Full Text | Google Scholar
14. Davoudi M, Brossner C, Kuber W. The influence of electromagnetic waves on sperm motility. Urol Urogynaecol. (2002) 19:18–22. Google Scholar
15. Fejes I, Závaczki Z, Szöllősi J, Koloszár S, Daru J, Kovacs L, et al. Is there a relationship between cell phone use and semen quality? Arch Androl. (2005) 51(5):385–93. doi: 10.1080/014850190924520. PubMed Abstract | Crossref Full Text | Google Scholar
16. Mugunthan N, Anbalagan J, Samy AS, Rajanarayanan S, Meenachi S. Effects of chronic exposure to 2G and 3G cell phone radiation on mice testis-A randomized controlled trial. Int J Curr Res Rev. (2015) 7:36–47. Google Scholar
17. Odacı E, Hancı H, Yuluğ E, Türedi S, Aliyazıcıoğlu Y, Kaya H, et al. Effects of prenatal exposure to a 900 MHz electromagnetic field on 60-day-old rat testis and epididymal sperm quality. Biotech Histochem. (2016) 91(1):9–19. doi: 10.3109/10520295.2015.1060356. PubMed Abstract | Crossref Full Text | Google Scholar
18. Tas M, Dasdag S, Akdag MZ, Cirit U, Yegin K, Seker U, et al. Long-term effects of 900 MHz radiofrequency radiation emitted from mobile phone on testicular tissue and epididymal semen quality. Electromagn Biol Med. (2014) 8378(3):216–22. doi: 10.3109/15368378.2013.801850. Crossref Full Text | Google Scholar
19. Singh H, Sharma M, Yadav KC, Dhatwalia SK. Effect of 3G/4G mobile phone radiations on mice testis. Poll Res. (2021) 40:6–8. Google Scholar
20. Kim JY, Kim HT, Moon KH, Shin HJ. Long – term exposure of rats to a 2.45 GHz electromagnetic field: effects on reproductive function. J Urol. (2007) 48(12):1308–14. Google Scholar
21. Lee HJ, Pack JK, Kim TH, Kim N, Choi SY, Lee JS, et al. The lack of histological changes of CDMA cellular phone-based radio frequency on rat testis. Bioelectromagnetics. (2010) 31(7):528–34. doi: 10.1002/bem.20589. PubMed Abstract | Crossref Full Text | Google Scholar
22. Eroschenko VP. diFior’s Atlas of Histology with Functional Correlations. 11 ed. Baltimore, MD: Lippincott Williams & Wilkins (2007). Google Scholar
23. De Iuliis GN, Newey RJ, King BV, Aitken RJ. Mobile phone radiation induces reactive oxygen species production and DNA damage in human spermatozoa in vitro. PLoS One. (2009) 4:e6446. doi: 10.1371/journal.pone.0006446. PubMed Abstract | Crossref Full Text | Google Scholar
24. Perrard MH, Sereni N, Schluth-Bolard C, Blondet A, Giscard d’Estaing S, Plotton I, et al. Complete human and rat ex vivo spermatogenesis from fresh or frozen testicular tissue. Biol Reprod. (2016) 95(4):1–10. doi: 10.1095/biolreprod.116.142802. PubMed Abstract | Crossref Full Text | Google Scholar
25. Agarwal A, Singh AH, Kesari K. Cell phones and male infertility: a review of recent innovations in technology and consequences. Int Braz J Urol. (2011) 37(4):432–54. doi: 10.1590/S1677-55382011000400002. PubMed Abstract | Crossref Full Text | Google Scholar
26. Depinder F, Makkler K, Agarwal A. Cell phones and male infertility: dissecting the relationship. Reprod Biomed Online. (2007) 3:266–70. doi: 10.1016/S1472-6483(10)60338-0. Crossref Full Text | Google Scholar
27. Hamdi BA, Roshangar L, Khaki AA, Soleimani-rad J. Histological study of testes and sperm parameters in adult mice exposed to 50 Hz electromagnetic field during developmental period. Ann Biol Res. (2011) 2(5):455–62. Google Scholar
28. Hasan I, Amin T, Alam R, Rafiqul M. Hematobiochemical and histopathological alterations of kidney and testis due to exposure of 4G cell phone radiation in mice. Saudi J Biol Sci. (2021) 28(5):2933–42. doi: 10.1016/j.sjbs.2021.02.028. PubMed Abstract | Crossref Full Text | Google Scholar
29. Holstein AF, Schulze W, Davidoff M. Understanding spermatogenesis is a prerequisite for treatment. Reprod Biol Endocrinol. (2003) 107. doi: 10.1186/1477-7827-1-107. Crossref Full Text | Google Scholar
30. Rostamzadeh A, Mohammadi M, Ahmadi R, Nazari A, Ghaderi O, Anjomshoa M. Evaluation of mouse embryos produced in vitro after electromagnetic waves exposure; morphometric study. Electron Physician. (2016) 8:1701. doi: 10.19082/1701. PubMed Abstract | Crossref Full Text | Google Scholar
31. Farjanikish G, Esmaeeli-Sani S, Mohammadi P. Effects of the long term exposure to mobile phone on testicular histology and serum level of testosterone in mice. Sci J Kurdistan Univ Med Sci. (2018) 23(4):110–8. Google Scholar
32. Nisbet HO, Nisbet C, Akar A, Cevik M, Karayigit MO. Effects of exposure to electromagnetic field (1.8/0.9 GHz) on testicular function and structure in growing rats. Res Vet Sci. (2012) 93(2):1001–5. doi: 10.1016/j.rvsc.2011.10.023. PubMed Abstract | Crossref Full Text | Google Scholar
33. Nassar SA, Algazeery A, Ahmed GAS, El-maaty WAA. Histological, immunohistochemical and molecular alterations in immature mice testes due to chronic exposure to Mobile phone radiofrequency radiation. Egypt J Hosp Med. (2020) 78:128–35. doi: 10.21608/ejhm.2020.68482. Crossref Full Text | Google Scholar
34. Farag EA, Yousry MM. Effect of mobile phone electromagnetic waves on rat testis and the possible ameliorating role of naringenin : a histological study. Egypt J Histol. (2018) 41(1):108–21. doi: 10.21608/EJH.2018.7526. Crossref Full Text | Google Scholar
35. Hegazy AA, Ahmad MM, Almotaleb NAA, Aziz JA. Prenatal and postnatal exposure to cell phone radiation and its possible impact on the development of albino rat testicular tissue light and electron microscopic study. Egypt J Histol. (2022) 45(3):908–26. doi: 10.21608/EJH.2021.72870.1464. Crossref Full Text | Google Scholar
36. Kumar P, Shukla V. Ultrastructural changes in rat testicular tissue after whole body exposure to electromagnetic radiation emitted from mobile phones. J Int Acad Res Multidiscip. (2014) 2(1):518–26. Google Scholar
37. Luo Q, Li J, Cui X, Yan J, Zhao Q, Xiang C. The effect of Lycium barbarum polysaccharides on the male rats’ reproductive system and spermatogenic cell apoptosis exposed to low-dose ionizing irradiation. J Ethnopharmacol. (2014) 154(1):249–58. doi: 10.1016/j.jep.2014.04.013. PubMed Abstract | Crossref Full Text | Google Scholar
38. Baharara J, Zafar-Balanejad S, Kamareh E, Asadi-Samani M. The effects of green tea extract on teratogenicity induced by low frequency electromagnetic field on bone marrow Balb/C mice embryo. J Herbmed Pharmacol. (2014) 3(1):47–51. Google Scholar
39. Sowa P, Sieron-Stoltny K, Cieslar G, Sieron A. Impact of electromagnetic field generated by mobile phone on prooxidant-antioxidant balance in selected internal organs of rats. PIERS Proc. (2013):1903–37. Google Scholar
40. Dasdag S, Taş M, Akdag MZ, Yegin K. Effect of long-term exposure of 2.4 GHz radiofrequency radiation emitted from Wi-Fi equipment on testes functions. Electromagn Biol Med. (2015) 34(1):37–42. doi: 10.3109/15368378.2013.869752. PubMed Abstract | Crossref Full Text | Google Scholar
41. Ozguner M, Koyu A, Cesur G, Ural M, Ozguner F, Gokcimen A, et al. Biological and morphological effects on the reproductive organ of rats after exposure to electromagnetic field. Saudi Med J. (2005) 26:405–10.15806208. PubMed Abstract | Google Scholar
42. Saygin M, Caliskan S, Karahan N, Koyu A, Gumral N, Uguz AC, et al. Testicular apoptosis and histopathological changes induced by a 2.45 GHz electromagnetic field. Toxicol Ind Health. (2011) 27(5):455–63. doi: 10.1177/0748233710389851. PubMed Abstract | Crossref Full Text | Google Scholar
43. Middendorff R, Müller D, Mewe M, Mukhopadhyay AK, Holstein AF, Davidoff MS, et al. The tunica albuginea of the human testis is characterized by complex contraction and relaxation activities regulated by cyclic GMP. J Clin Endocrinol Metab. (2002) 87(7):3486–99. doi: 10.1210/jcem.87.7.8696. PubMed Abstract | Crossref Full Text | Google Scholar
44. Varani J, Dame MK, Rittie L, Fligiel SE, Kang S, Fisher GJ, et al. Decreased collagen production in chronologically aged skin: roles of age-dependent alteration in fibroblast function and defective mechanical stimulation. Am J Pathol. (2006) 168(6):1861–8. doi: 10.2353/ajpath.2006.051302. PubMed Abstract | Crossref Full Text | Google Scholar
45. Mugunthan N, Anbalagan J, Meenachi S. Effects of long term exposure to a 2G cell phone radiation (900–1900 MHz) on mouse testis. Int J Sci Res. (2014) 3:523–9. Google Scholar
46. Kumar S, Nirala JP, Behari J, Paulraj R. Effect of electromagnetic irradiation produced by 3G mobile phone on male rat reproductive system in a simulated scenario. Indian J Exp Biol. (2014) 52(9):890–7.25241589. PubMed Abstract | Google Scholar
47. Khayyat LI. The histopathological effects of an electromagnetic field on the kidney and testis of mice. Eur Asian J Bio Sci. (2011) 5:103–9. doi: 10.5053/ejobios.2011.5.0.12. Crossref Full Text | Google Scholar
48. El-Naggar MI, El-Sagheer AS, Ebaid AE. The possible protective effect of vitamin E on adult albino rat’s testes exposed to electromagnetic field emitted from a conventional cellular phone. Egypt J Hosp Med. (2019) 74(4):873–84. doi: 10.21608/ejhm.2019.25267. Crossref Full Text | Google Scholar
49. Wang SM, Wang DW, Peng RY, Gao YB, Yang Y, Hu WH, et al. Effect of electromagnetic pulse irradiation on structure and function of Leydig cell in mice. Natl J Androl. (2003) 9(5):327–30. Google Scholar
50. Zareen N. Testicular morphology: effects of mobile phone induced electromagnetic fields on mice testes. Professional Med J. (2009) 16(2):289–92. doi: 10.29309/TPMJ/2009.16.02.2945. Crossref Full Text | Google Scholar
51. Weyden VD, Arends MJ, Chausiaux OE. Loss of TSLC1 causes male infertility due to a defect at the spermatid stage of spermatogenesis. Mol Cell Biol. (2006) 26:3595–609. doi: 10.1128/MCB.26.9.3595-3609.2006. PubMed Abstract | Crossref Full Text | Google Scholar
52. Esa PD, Suryandari DA, Sari P. Effect of extremely low frequency electromagnetic fields on the diameter of seminiferous tubules in mice, in. J Phys Conf Ser. (2018) 062043. doi: 10.1088/1742-6596/1073/6/062043. Crossref Full Text | Google Scholar
53. Chauhan P, Verma HN, Sisodia R, Kesari KK. Microwave radiation (2.45 GHz)-induced oxidative stress: whole-body exposure effect on histopathology of Wistar rats. Electromagn Biol Med. (2017) 36:20–30. doi: 10.3109/15368378.2016.1144063. PubMed Abstract | Crossref Full Text | Google Scholar
54. Wong CH, Cheng CY. The blood testis barrier: its biology, regulation, and physiological role in spermatogene-sis. Curr Top Dev Biol. (2005) 71:263–96. doi: 10.1016/S0070-2153(05)71008-5. PubMed Abstract | Crossref Full Text | Google Scholar
55. Adebayo EA, Adeeyo AO, Ogundiran MA, Olabisi O. Bio-physical effects of radiofrequency electromagnetic radiation (RF-EMR) on blood parameters, spermatozoa, liver, kidney and heart of albino rats. J King Saud Univ Sci. (2019) 31(4):813–21. doi: 10.1016/j.jksus.2018.11.007. Crossref Full Text | Google Scholar
56. Oh JJ, Byun SS, Lee SE, Choe G, Hong SK. Effect of electromagnetic waves from mobile phones on spermatogenesis in the era of 4G-LTE. Biomed Res Int. (2018) 2018(1):1801798. doi: 10.1155/2018/1801798. PubMed Abstract | Crossref Full Text | Google Scholar
57. Meo SA, Arif M, Rashied S, Khan MM, Vohra MS, Usmani AM, et al. Hypospermatogenesis and spermatozoa maturation arrest in rats induced by mobile phone radiation. J Coll Physicians Surg Pakistan. (2011) 21(5):262–5. Google Scholar
58. Oyewopo AO, Olaniyi SK, Oyewopo CI, Jimoh AT. Radiofrequency electromagnetic radiation from cell phone causes defective testicular function in male Wistar rats. Andrologia. (2017) 49(10):e12772. doi: 10.1111/and.12772. Crossref Full Text | Google Scholar
59. Banavath AN, Srinivasa SN. Ameliorative effect of Punica granatum on sperm parameters in rats exposed to mobile radioelectromagnetic radiation. Asian Pacific J Reprod. (2021) 10(5):225–31. doi: 10.4103/2305-0500.326720. Crossref Full Text | Google Scholar
60. Dasdag S, Zulkuf Akdag M, Aksen F, Yılmaz F, Bashan M, Mutlu Dasdag M, et al. Whole body exposure of rats to microwaves emitted from a cell phone does not affect the testes. Bioelectromagnetics. (2003) 24:182–8. doi: 10.1002/bem.10083. PubMed Abstract | Crossref Full Text | Google Scholar
61. Guan M, Tang W, Hang J, Wang H, Jiang X, Zhu H. Effects of mobile phone radiation on semen quality of rat. Chin J Androl. (2012) 4:23–5. Google Scholar
62. Bahaodini A, Owjfard M, Tamadon A, Jafari SM. Low frequency electromagnetic fields long-term exposure effects on testicular histology, sperm quality and testosterone levels of male rats. Asian Pac J Reprod. (2015) 4(3):195–200. doi: 10.1016/j.apjr.2015.06.001. Crossref Full Text | Google Scholar
63. Mailankot M, Kunnath AP, Jayalekshmi H, Koduru B, Valsalan R. Radio frequency electromagnetic radiation (RF-EMR) from GSM (0.9/1.8 GHz) mobile phones induces oxidative stress and reduces sperm motility in rats. Clinics. (2019) 64(6):561–5. doi: 10.1590/S1807-59322009000600011. Crossref Full Text | Google Scholar
64. Ghanbari M, Mortazavi SB, Khavanin A, Khazaei M. The effects of cell phone waves (900 MHz-GSM band) on sperm parameters and total antioxidant capacity in rats. J Fertility Steril. (2013) 7:21–8. Google Scholar
65. Mortazavi SMJ, Tavassoli AR, Ranjbari F, Moammaiee P. Effects of laptop computers’ electromagnetic field on sperm quality. J Reprod Infertil. (2010) 11(4):251–8. Google Scholar
66. Kesari KK, Kumar S, Behari J. Effects of radiofrequency electromagnetic wave exposure from cellular phones on the reproductive pattern in male Wistar rats. Appl Biochem Biotechnol. (2011) 164:546–59. doi: 10.1007/s12010-010-9156-0. PubMed Abstract | Crossref Full Text | Google Scholar
67. Meral I, Mert H, Mert N, Deger Y, Yoruk I, Yetkin A, et al. Effects of 900-MHz electromagnetic field emitted from cellular phone on brain oxidative stress and some vitamin levels of guinea pigs. Brain Res. (2007) 1169:120–4. doi: 10.1016/j.brainres.2007.07.015. PubMed Abstract | Crossref Full Text | Google Scholar
68. Oktem F, Ozguner F, Mollaoglu H, Koyu A, Efkan U. Oxidative damage in the kidney induced by 900-MHz-emitted mobile phone: protection by melatonin. J Arch Med Res. (2005) 36:350–5. doi: 10.1016/j.arcmed.2005.03.021. PubMed Abstract | Crossref Full Text | Google Scholar
69. Hales DB, Allen JA, Shankara T, Janus P, Buck S, Diemer T, et al. Mitochondrial function in leydig cell steroidogenesis. Ann N Y Acad Sci. (2005) 1061(1):120–34. doi: 10.1196/annals.1336.014. PubMed Abstract | Crossref Full Text | Google Scholar
70. Naughton CK, Nangia AK, Agarwal A. Pathophysiology of varicoceles in male infertility. J Human Reprod Update. (2001) 7:473–81. doi: 10.1093/humupd/7.5.473. PubMed Abstract | Crossref Full Text | Google Scholar
71. Makker K, Varghese A, Desai NR, Mouradi R, Agarwal A. Cell phones: modern man’s nemesis? Reprod BioMed Online. (2009) 18:148–57. doi: 10.1016/S1472-6483(10)60437-3. PubMed Abstract | Crossref Full Text | Google Scholar
72. Meo SA, Al-Drees AM, Husain S, Khan MM, Imran MB. Effects of mobile phone radiation on serum testosterone in Wistar albino rats. Saudi Med J. (2010) 30(8):869–73. Google Scholar
73. Walker WH. Non-classical actions of testosterone and spermatogenesis. Philos Trans R Soc Lond B Biol Sci. (2010) 365:1557–69. doi: 10.1098/rstb.2009.0258. PubMed Abstract | Crossref Full Text | Google Scholar
74. Kliesch S. Testosterone and infertility. Urologe Artz. (2010) 49:32–6. doi: 10.1007/s00120-009-2195-x. Crossref Full Text | Google Scholar
75. La Vignera S, Condorelli RA, Vicari E, D’Agata R, Calogero AE. Effects of the exposure to mobile phones on male reproduction: a review of the literature. J Androl. (2012) 33(3):350–6. doi: 10.2164/jandrol.111.014373. PubMed Abstract | Crossref Full Text | Google Scholar
76. Yu G, Bai Z, Song C, Cheng Q, Wang G, Tang Z, et al. Current progress on the effect of mobile phone radiation on sperm quality: an updated systematic review and meta-analysis of human and animal studies. Environ Pollut. (2021) 282:116952. doi: 10.1016/j.envpol.2021.116952. PubMed Abstract | Crossref Full Text | Google Scholar
77. Adams JA, Galloway TS, Mondal D, Esteves SC, Mathews F. Effect of mobile telephones on sperm quality: a systematic review and meta-analysis. Environ Int. (2014) 70:106–12. doi: 10.1016/j.envint.2014.04.015. PubMed Abstract | Crossref Full Text | Google Scholar
78. Liu K, Li Y, Zhang G, Liu J, Cao J, Ao L, et al. Association between mobile phone use and semen quality: a systemic review and meta-analysis. Andrology. (2014) 2:491–501. doi: 10.1111/j.2047-2927.2014.00205.x. PubMed Abstract | Crossref Full Text | Google Scholar
79. Ayrapetyan SN. Cell aqua medium as a primary target for the effect of electromagnetic fields. In: Ayrapetyan SN, Markov MS, editors. BIOELECTROMAGNETICS Current Concepts: The Mechanisms of the Biological Effect of Extremely High Power Pulses. Dordrecht: Springer Netherlands (2006). p. 31–63. Google Scholar
80. Kumar S, Behari J, Sisodia R. Influence of electromagnetic fields on reproductive system of male rats. Int J Rad Biol. (2013) 89(3):147. doi: 10.3109/09553002.2013.741282. PubMed Abstract | Crossref Full Text | Google Scholar
81. Kesari KK, Behari J. Evidence for mobile phone radiation exposure effects on reproductive pattern of male rats: role of ROS. Electromagn Biol Med. (2012) 31:213–22. doi: 10.3109/15368378.2012.700292. PubMed Abstract | Crossref Full Text | Google Scholar
Tradução livre, parcial, de Luiz Jacques Saldanha, março de 2025


