Esse artigo tem identidade com uma das ideias centrais do blog, aquilo que chamo de “lipidofobia”, que descrevi no primeiro post publicado aqui. É fácil observar as pessoas que vão aos supermercados, nos restaurantes, pedindo alimentos com menos gordura. Há um número imenso de alimentos industrializados, transformados, que tem no rótulo, a estampa: 0% GORDURA, desnatado, sem colesterol etc. E infelizmente, isso parece à maioria do público consumidor uma vantagem em termos de qualidade ou promoção de saúde! (Nota do site: este texto está no website do Dr. José Carlos Brasil Peixoto, médico que atua em Porto Alegre e que vem, há anos, relacionando alimentação e saúde, dentre outros aspectos da vida moderna).
http://lipidofobia.blogspot.com.br/2014/12/comer-gordura-e-o-aumento-do-cerebro.html
A IMPORTÂNCIA DO CONSUMO DE GORDURA PARA O AUMENTO DO CÉREBRO HUMANO
[O texto a seguir é de um livro publicado pela NCBI ( Centro Nacional de Informação em Biotecnologia), da coleção Fronteiras das Neurociências:]
Fat Detection: Taste, Texture, and Post Ingestive Effects (Frontiers in Neuroscience)
Quando vemos, cientificamente o quão importante foi o consumo de gorduras pelos nossos antepassados, e o que isso significou em nosso caminho evolutivo, espero que as pessoas – que consigam se libertar de seus preconceitos – possam enxergar de forma totalmente diferente a maneira correta de nos alimentarmos!
É provável, que a avassaladora mudança de uma alimentação rica em gordura para uma dieta baseada em carboidratos, especialmente incrementada a partir dos anos 80, tenha sido decisiva para a marcante escalada de doenças degenerativas desse início de século.
Entender qual foi a forma de alimentação que foi fundamental para aumentar o tamanho de nossos cérebros – processo chamado de encefalização – pode ser o ponto de partida para voltarmos a uma alimentação mais natural para nossa espécie e devolver nosso paraíso perdido: uma existência com mais saúde!
Essa é a tradução do capítulo um desse livro. É um texto extenso, mas rico de informações qualificadas e inspirador no que diz respeito a busca de compreensão fisiológica da alimentação com base evolutiva.
Perspectivas evolutivas sobre a ingestão e metabolismo das gorduras para os seres humanos (Evolutionary Perspectives on Fat Ingestion and Metabolism in Humans)
(William R. Leonard, J. Josh Snodgrass, e Marcia L. Robertson)
- INTRODUÇÃO
Cada vez mais, pesquisadores biomédicos estão começando a reconhecer a importância de uma perspectiva evolucionária para a compreensão da origem e natureza dos problemas modernos da saúde humana. Isto é particularmente verdadeiro quando se examina os distúrbios “nutricional/metabólicos”, tais como obesidade e doenças cardiovasculares. A pesquisa em biologia evolutiva humana ao longo dos últimos 20 anos mostrou que muitas das características-chave que distinguem seres humanos de outros primatas (por exemplo, a nossa forma bípede de locomoção e o grande porte cerebral) têm implicações importantes para as nossas particulares necessidades nutricionais (Aiello e Wheeler, 1995; Robertson e Leonard, 1997; Leonard, 2002). O mais importante desses recursos é o nosso elevado nível de encefalização (proporção cérebro/massa corporal). As exigências de energia (kcal/g/min) do cérebro e outros tecidos neurais são extremamente elevadas, algo aproximadamente 16 vezes maior que as do músculo esquelético (Kety, 1957; Holliday, 1986). Por conseguinte, a evolução para o grande tamanho do cérebro na linhagem humana se deu a um elevado custo metabólico.
Em comparação com outros primatas e mamíferos de nosso tamanho, os seres humanos alocam uma parcela muito maior do seu orçamento energético diário para “alimentar seus cérebros.” Essa alocação desproporcionalmente grande do nosso orçamento energético para o metabolismo cerebral tem implicações importantes nas nossas necessidades dietéticas. Para acomodar as altas demandas energéticas de nossos grandes cérebros, os seres humanos consomem dietas de qualidade muito superior (ou seja, mais denso em energia e gordura) do que nos nossos parentes primatas (Leonard e Robertson, 1992, 1994). Em média, consomem os níveis mais elevados de gordura alimentar do que outros primatas (Popovich et al., 1997), e níveis mais elevados de ácidos chave-graxos poliinsaturados de cadeia longa (LC-PUFA) que são críticos para o desenvolvimento do cérebro (Crawford et al. , 1999;. Cordain et al, 2001). Além disso, os seres humanos também parecem ser distintos em suas mudanças de desenvolvimento na composição corporal. Temos níveis mais elevados de gordura corporal do que outras espécies de primatas, e essas diferenças são particularmente evidentes no início da vida.
A necessidade de uma dieta rica em energia também parece moldar a nossa capacidade de detectar e metabolizar alimentos ricos em gordura. Os seres humanos mostram fortes preferências por alimentos ricos em lipídios. Trabalhos recentes em neurociência tem mostrado que estas preferências são baseados no cheiro, textura e sabor de alimentos gordurosos (Sclafani, 2001; Gaillard et al, 2008;. Le coutre e Schmitt, 2008), e que o nosso cérebro tem a capacidade de avaliar o conteúdo energético dos alimentos com notável rapidez e precisão (Toepel et al., 2009). Além disso, em comparação com macacos de grande porte, os seres humanos têm uma maior capacidade de digerir e metabolizar dietas mais elevadas em gorduras. O nosso trato gastrointestinal (GI), com um intestino delgado expandido e cólon reduzido, é bastante diferente das dos chimpanzés e gorilas e isso é consistente com o consumo de uma dieta de alta qualidade com grandes quantidades de alimentos de origem animal (Milton, 1987,). Finch e Stanford (2004) demonstraram recentemente que a evolução dos principais genes “adaptados (ao consumo de) carne” na evolução dos hominídeos foram fundamentais para a promoção do reforçado metabolismo necessário para subsistência com dietas com maiores níveis de materiais lipídicos de origem animal.
Este capítulo baseia-se em ambas as análises, de espécies primatas vivas e do registro fóssil humano para explorar a importância evolutiva da gordura (alimentar) na biologia nutricional da nossa espécie. Vamos começar examinando os dados dietéticos comparativos para grupos humanos modernos e de outras espécies de primatas para avaliar a influência que a variação no tamanho relativo do cérebro tem nos padrões alimentares entre os primatas modernos. A seguir nos voltaremos para um exame do registro fóssil humano a considerar quando e sob quais condições em nossos passados evolutivos mudanças chaves no tamanho do cérebro e na dieta provavelmente ocorreram. Finalmente, vamos explorar como a evolução de grandes cérebros humanos provavelmente foi acomodada por particulares aspectos do crescimento e desenvolvimento humano que promoveram o aumento dos níveis de gordura corporal desde o início da vida.
- PERSPECTIVAS COMPARATIVAS SOBRE A QUALIDADE ALIMENTAR DOS PRIMATAS
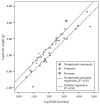
Os altos custos de energia de grandes cérebros humanos são evidentes na Figura 1.1, que mostra a relação de escala entre peso do cérebro (gramas) e taxa metabólica de repouso (TMR) (kcal / dia) para os seres humanos, outras 35 espécies de primatas, e 22 espécies de mamíferos não-primatas. A linha sólida denota a regressão de melhor ajuste para as espécies de primatas não-humanos, e a linha tracejada indica a regressão de melhor ajuste para os mamíferos não-primatas. Os dados apontam para o ser humano é denotada com uma estrela.
Esse gráfico mostra linhas que relacionam peso cerebral (brain weight (BW, g)) versus RMR (kcal / dia) para o ser humano, outras 35 espécies de primatas, e 22 espécies de mamíferos não-primatas. A linha de regressão dos primatas é sistemática e significativamente mais elevada que a linha de regressão dos mamíferos não-primatas.
Como um grupo, os primatas têm cérebros que são aproximadamente três vezes o tamanho de outros mamíferos (em relação ao tamanho do corpo). O tamanho do cérebro humano, por sua vez, fica entre 2,5 a 3 vezes dos outros primatas (Martin, 1989). Em termos calóricos, isto significa que a cota do metabolismo cerebral é aproximadamente 20% -25% da TMR no corpo de um ser humano adulto, em comparação com cerca de 8% -10% em outras espécies de primatas, e cerca de 3% -5% para os mamíferos não primatas (Leonard et al., 2003).
Para acomodar as demandas metabólicas dos nossos grandes cérebros, os seres humanos consomem dietas que são mais densos em energia e nutrientes do que outros primatas de tamanho similar. Figura 1.2 mostra a associação entre qualidade da dieta e peso corporal em primatas, incluindo humanos modernos dos bosques. O (DQ) índice de qualidade da dieta é derivado do trabalho de Sailer et al. (1985), e reflete as proporções relativas (percentagem em volume) de (a) das plantas estrutural partes (s; por exemplo, folhas, caules, casca das árvores), (b) as partes das plantas reprodutivas (r, por exemplo, frutos, flores), e (c) alimentos de origem animal (a; incluindo invertebrados):
Linha de DQ (qualidade dietética) versus massa corporal para 33 espécies de primatas. DQ é inversamente proporcional à massa corporal (r = -0,59 [amostra total]; -0,68 [primatas não humanos apenas]; P <0,001), indicando que os pequenos primatas consomem relativamente dietas com maior qualidade. Os humanos tem sistematicamente uma dieta com mais qualidade do que predita seu tamanho corporal.
Índice DQ = s + 2 (r) + 3,5 (um)
O índice varia entre um mínimo de 100 (uma dieta de todo vegetal folhas e / ou partes de estruturas de plantas) para 350 (a dieta onde todo o material é de origem animal).
Existe uma forte relação inversa entre DQ e de massa corporal entre primatas; no entanto, note que as dietas dos modernos humanos forrageiros (forrageiro = caçador-coletor) ficam substancialmente acima da linha de regressão na Figura 1.2. Na verdade, os alimentos básicos para todas as sociedades humanas são muito mais nutricionalmente densos do que os de outros primatas de grande porte. Embora exista uma variação considerável nas dietas de grupos humanos forrageiros modernos, estudos recentes têm mostrado que esses grupos tipicamente derivam mais da metade de seu consumo de energia na dieta a partir de alimentos de origem animal (Cordain et al., 2000). Em comparação, os grandes símios modernos obtém grande parte de sua dieta de alimentos vegetais de baixa qualidade. Gorilas derivam mais de 80% de sua dieta de alimentos fibrosos, como folhas e cascas (Richard, 1985). Mesmo entre os chimpanzés comuns (Pan troglodytes), apenas cerca de 5% a 10% de suas calorias são provenientes de alimentos de origem animal (Teleki, 1981; Stanford, 1996). Esta dieta de “maior qualidade” significa que precisamos de comer menos volume de alimentos para obter a energia e os nutrientes que precisamos.
A Tabela 1.1 apresenta dados comparativos sobre a ingestão de macronutrientes dos grupos humanos selecionados, em comparação com os dos chimpanzés e gorilas que vivem em estado selvagem. A informação alimentar para as populações humanas foi obtida a partir dos dados dos EUA NHANES (Briefel e Johnson, 2004) e a partir de uma revisão recente das dietas de caçadores-coletores contemporâneos (Forrageiros) pela Cordain et al. (2000). Os dados para chimpanzés e gorilas foram obtidos a partir de estudos de forrageamento em estado selvagem e análise da composição dos alimentos comumente consumidos (Dufour, 1987 (Richards, 1985;; Tutin e Fernandez, 1992, 1993 Popovich et al., 1997); Popovich et al. , 1997). Sociedades de forrageamento contemporâneas derivam entre 28% e 58% do seu consumo diário de energia a partir de gordura na dieta. Aqueles grupos que vivem em climas mais ao norte (por exemplo, o Inuit) derivam uma parcela maior de sua dieta de alimentos de origem animal e, portanto, têm ingestão diária de gordura superior. Por outro lado, as populações de forrageamento tropicais geralmente apresentam ingestão de gordura mais reduzida porque obtém uma parcela maior de sua dieta a partir de alimentos de origem vegetal. Em comparação, os americanos, e outras populações da sociedade industrializada caem dentro da faixa onde estão os caçadores-coletores, derivando cerca de um terço de seu consumo diário de energia a partir de gordura (Millstone e Lang, 2003; Briefel e Johnson, 2004).
Percent (%) of Dietary Energy Intake Derived from Fat, Protein, and Carbohydrates (CHO) in Selected Human Populations, Chimpanzees (Pan troglodytes), and Gorillas (Gorilla gorilla)
| Species/Group | Fat | Protein | CHO | References |
|---|---|---|---|---|
| Humans (Homo sapiens) | ||||
| United States (2000) | 33 | 14 | 53 | Briefel and Johnson (2004) |
| Modern foragers | 28–58 | 19–35 | 22–40 | Cordain et al. (2000) |
| Chimpanzees (P. troglodytes) | 6 | 21 | 73a | ) Tutin and Fernandez (1992) Tutin and Fernandez (1993) Popovich et al. (1997) |
| Gorilla (G. gorilla) | 3 | 24 | 73a | Popovich et al. (1997) |
- a. Includes estimated energy derived from fermentation of dietary fiber.
Percentual (%) da ingestão dietética de energia derivado de gordura, proteína e carboidratos (CHO) em populações humanas selecionadas, chimpanzés (Pan troglodytes) e gorilas (Gorilla gorilla).
Em contraste com os níveis observados em populações humanas, os grandes macacos obtém apenas uma pequena parte de calorias provenientes de gordura na dieta. Popovich et ai. (1997) estimaram que gorilas das planícies ocidentais derivam aproximadamente 3% de sua energia a partir de gorduras alimentares. Os chimpanzés parecem ter a ingestão de gordura mais elevada do que os gorilas (cerca de 6% da energia da dieta), mas eles ainda estão bem abaixo do limite inferior do intervalo (estatístico) forrageiro moderno. Assim, o maior o consumo de carne e outros alimentos de origem animal entre os caçadores-coletores humanos está associado a dietas que são mais elevados em gordura e mais denso em energia.
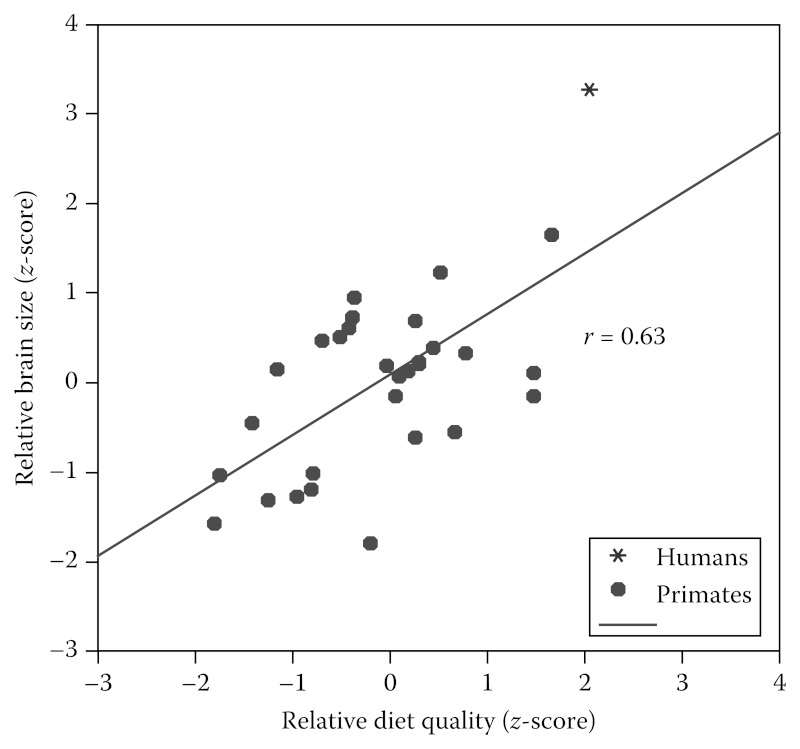
A ligação entre o tamanho do cérebro e qualidade alimentar é evidente na Figura 1.3, que mostra o tamanho relativo do cérebro versus qualidade dietética relativa para as 33 espécies de primatas diferentes para os quais temos dados sobre o metabolismo, o tamanho do cérebro, e de dieta. O tamanho do cérebro relativa de cada espécie é medido como o padronizado residual (z-score) a partir do cérebro dos primatas contra regressão de massa corporal, e DQ relativa é medido como o residual do DQ contra a regressão de massa corporal. Há uma relação positiva forte (r = 0,63; P <0,001) entre a quantidade de energia alocada ao cérebro e a densidade calórica da dieta. Em todos os primatas, cérebros maiores necessitam de dietas de maior qualidade. Os seres humanos caem nos extremos positivos para ambos os parâmetros, com o maior tamanho relativo do cérebro e a dieta com mais alta qualidade.
Comparação do tamanho relativo do cérebro contra DQ relativa para 31 espécies de primatas (incluindo os seres humanos). Primatas com dietas de maior qualidade para o seu tamanho têm relativamente maior tamanho do cérebro (r = 0,63; P <0,001). Os seres humanos representam os extremos positivos para ambos.
Dessa forma, os altos custos do grande cérebro humano, metabolicamente dispendioso é parcialmente compensado pelo consumo de uma dieta mais densa em energia e gordura do que os de outros primatas de tamanho similar. Esta relação implica que a evolução de cérebros maiores dos hominídeos teria exigido a adoção de uma dieta de alta qualidade (incluindo carne e frutas ricas em energia) para apoiar o aumento das exigências metabólicas da maior encefalização.
Em relação a outros macacos de grande porte, os humanos mostram importantes diferenças no tamanho e morfologia de seu trato gastrointestinal (TGI) que estão ligadas ao consumo de uma dieta mais rica em energia. Em comparação com os chimpanzés e gorilas, os seres humanos têm volume intestinal total menor, cólons menores, intestino delgado expandido (Milton, 1987, 2003). Em muitos aspectos, o intestino humano é mais semelhante ao de um carnívoros e reflete uma adaptação a uma dieta facilmente digerível que é superior em energia e gordura.
Além disso, o trabalho recente em genética evolutiva humanos sugere que a seleção para os principais genes “carne-adaptativos” foram fundamentais para permitir que nossos ancestrais hominídeos explorassem de forma mais eficaz dietas com maiores níveis de gordura animal. Finch e Stanford (2004) argumentam que a evolução do alelo único E3 nos Homo no loco da apolipoproteína E (apoE) foi importante ao permitir que os nossos antepassados explorassem dietas com mais material de fontes animais. A ApoE desempenha um papel crítico na regulação da absorção de colesterol e lípides ao longo do organismo (Davignon et ai., 1988). O alelo E3 é evidente nos seres humanos, mas não em chimpanzés e gorilas, e está associado com a redução dos riscos cardiovasculares e metabólicos com o consumo de dietas ricas em gordura superiores (Finch e Stanford, 2004).
À luz dessas adaptações morfológicas e genéticas importantes para o aumento da DQ, não é de estranhar que os seres humanos também mostram preferência por alimentos que são ricos em gordura e energia. Até recentemente, pensava-se que a preferência humana para “alimentos gordurosos” fosse amplamente baseada em cheiro e textura (Sclafani, 2001). No entanto, agora sabemos que gosto desempenha um papel crítico (Gaillard et al., 2008). Estudos com neuro-imagem sugerem também que o cérebro humano tem uma notável capacidade de avaliar o conteúdo energético de potenciais itens alimentares com velocidade e precisão (Toepel et al., 2009).
Através das populações humanas, a variação no grau de preferência para comidas doces e ácidos graxos tem sido bem documentada (por exemplo, Messer, 1986; Johns, 1996; Salbe et al., 2004). Um trabalho recente de Lussana et al. (2008) mostrou que o estado nutricional durante o desenvolvimento pode desempenhar um papel importante na formação de preferências de gosto. Com base em análises do Dutch Famine Birth Cohort, esses autores mostram que a exposição pré-natal a condições de fome está associada a uma maior preferência por alimentos gordurosos e aumento do risco de perfis lipídicos séricos pobres na idade adulta.
- Tendências evolutivas na dieta, tamanho do cérebro, e o tamanho do corpo
Quando olhamos para o registro fóssil humano, vemos que a primeira grande explosão de mudança evolutiva no tamanho do cérebro dos hominídeos ocorreu em cerca de 2,0-1,7 milhões de anos atrás, associado ao surgimento e evolução dos primeiros membros do gênero Homo (ver Tabela 1.2). Antes disso, os nossos ancestrais hominídeos anteriores, os australopithecus, mostraram apenas modesta evolução tamanho do cérebro de uma média de 400-510 cm3 sobre uma extensão de 2 milhões de anos (entre 4-2 milhões de anos atrás). Com a evolução do gênero Homo há mudanças rápidas, com tamanhos cerebrais de, em média, ~ 600 cm3 no Homo habilis (há 2,4-1,6 milhões de anos atrás) e ~ 800-900 cm3 nos primeiros membros do Homo erectus (há 1,8-1,5 milhões de anos atrás). Além disso, enquanto que o tamanho relativo do cérebro de H. erectus ainda não atingia o tamanho de humanos modernos, ele já estaria fora do intervalo (média) observado entre outras espécies vivas de primatas.
Geological Ages (mya), Brain Size (cm3), Estimated Male and Female Body Weights (kg), and Postcanine Tooth Surface Areas (mm2) for Selected Fossil Hominid Species
| Species | Geological Age (mya) | Brain Size (cm3) | Body Weight | Postcanine Tooth Surface Area (mm2) | |
|---|---|---|---|---|---|
| Male (kg) | Female (kg) | ||||
| A. afarensis | 3.9–3.0 | 438 | 45 | 29 | 460 |
| A. africanus | 3.0–2.4 | 452 | 41 | 30 | 516 |
| A. boisei | 2.3–1.4 | 521 | 49 | 34 | 756 |
| A. robustus | 1.9–1.4 | 530 | 40 | 32 | 588 |
| H. habilis (sensu strictu) | 1.9–1.6 | 612 | 37 | 32 | 478 |
| H. erectus (early) | 1.8–1.5 | 863 | 66 | 54 | 377 |
| H. erectus (late) | 0.5–0.3 | 980 | 60 | 55 | 390 |
| H. sapiens | 0.4–0.0 | 1,350 | 58 | 49 | 334 |
-
All data from McHenry and Coffing (2000), except for H. erectus. Early H. erectus brain size is the average of African specimens as presented in McHenry (1994b), Indonesian specimens from Antón and Swisher (2001) and Georgian specimens from Gabunia et al. (2000, 2001). Data for late H. erectus are from McHenry (1994a).
Idades Geológicas (mya), Tamanho do Cérebro (cm3), pesos corporais estimados Masculinos e Femininos(kg), e áreas de superfície dental pós caninos (mm2) para fósseis selecionados de espécies de hominídeos.
A evolução do H. erectus na África é amplamente vista como uma “grande mudança adaptativa” na evolução humana (Wolpoff, 1999; Antón et al, 2002;. Antón, 2003). Na verdade, o que é notável sobre a emergência de H. erectus no leste da África há 1,8 milhões de anos atrás é que encontramos (a) marcantes aumentos no tamanho tanto do cérebro como do e do corpo, (b) a evolução das proporções do corpo (mais similares ao humano), e (c) grandes reduções de tamanho dos dentes posteriores e robustez craniofacial (McHenry, 1992, 1994a, b;. Ruff et al, 1997; McHenry e Coffing, 2000). Estas tendências claramente sugerem grandes mudanças energéticas e alimentares: (a) as grandes dimensões do corpo que necessitam de maiores necessidades diárias de energia; (b) cérebros maiores que sugerem a necessidade de uma dieta de maior qualidade; e (c) as alterações craniofaciais sugerindo que eles estavam consumindo uma mistura diferente de alimentos do que os seus antepassados, os Australopithecus.
Os fatores de condução final responsáveis pela rápida evolução do tamanho do cérebro, tamanho do corpo, e anatomia crânio-dental nesta fase da evolução humana parecem ter sido grandes mudanças ambientais que promoveram mudanças na dieta e comportamento de forrageamento. O ambiente na África Oriental, na fronteira Plio-Pleistoceno (2,0-1,8 milhões de anos atrás) foi se tornando muito mais seco, resultando em quedas nas áreas das florestas e uma expansão de matas e campos abertos (Vrba, 1995; Reed, 1997; Bobe e Behrensmeyer de 2002 ; de Menocal, 2004; Wynn, 2004). Tais mudanças na paisagem africana provavelmente tornaram os alimentos de origem animal um recurso cada vez mais atraente para os nossos ancestrais hominídeos (Harris e Capaldo, 1993;. Behrensmeyer et al, 1997; Plummer, 2004).
Isto pode ser visto olhando para as diferenças de produtividade ecológica entre ecossistemas atuais da mata e da savana dos trópicos. Apesar do fato de que os ambientes de savanas tropicais produzirem apenas cerca de metade da energia a partir de plantas por ano, em relação às florestas tropicais (4050 contra 7200 kcal / m2 / ano), a abundância de herbívoros (produtividade secundária) é quase três vezes maior no cerrado (10,1 contra 3,6 kcal / m2 / ano) (Leonard e Robertson, 1997). Consequentemente, a expansão da savana na Plio-Pleistoceno africano teria limitado a quantidade e variedade de alimentos vegetais comestíveis (para elementos como os tubérculos, etc.) para os hominídeos, mas por outro lado também resultaria em um aumento na abundância relativa de mamíferos de pasto, como antílopes e gazelas. Essas mudanças na abundância relativa de diferentes recursos alimentares ofereceu uma oportunidade para os hominídeos com capacidade suficiente para isso, explorar tais recursos de origem animal.
O registro arqueológico fornece evidências de que isso ocorreu com o H. erectus, já que esta espécie está associada a ferramentas de pedra e o desenvolvimento da primeira economia rudimentar baseada em caça-coleta. A carne parece ter sido mais comum na dieta de H. erectus do que foi nos australopitecos, com as carcaças de mamíferos provavelmente sendo adquiridas tanto através da caça e como disputa por carniça (Plummer, 2004; Bunn, 2006). Além disso, as evidências arqueológicas indicam que os animais abatidos eram transportados de volta para uma localização central (home base) onde os recursos seriam compartilhados dentro dos grupos de forrageiros (Potts, 1988a, b; Harris e Capaldo, 1993; Bunn, 2006). Ferramentas de pedra cada vez mais sofisticadas (ou seja, a indústria de Acheulean, como é denominada a primeira manufatura dos hominídeos) surgiram em torno de 1,6-1,4 milhões de anos atrás, melhorando a capacidade desses hominídeos para processar materia prima a partir de animais e plantas (Asfaw et al., 1992). Essas mudanças na dieta e no comportamento de forrageamento não teria tornado nossos ancestrais hominídeos em carnívoros; no entanto, a adição de até mesmo pequenas quantidades de carne para a dieta (10% a 20% da energia alimentar), combinada com a partilha de recursos que é típica de grupos de caçadores-coletores teria aumentado significativamente a qualidade e estabilidade da dieta de H . erectus.

Acheulean tools
Além dos benefícios energéticos associados com um maior consumo de carne, é bastante provável que tal mudança na dieta teria igualmente promovido um aumento dos níveis de ácidos graxos essenciais necessários para suportar a evolução rápida cerebral do hominídeo (Cordain et al., 2001). O crescimento do cérebro dos mamíferos é dependente de quantidades suficientes de dois ácidos graxos de cadeia longa (LC-PUFAs): ácido docosahexaenóico (DHA), e ácido araquidônico (AA) (Crawford et al, 1999; Cordain et al., 2001.). Uma vez que a composição de todo o tecido cerebral de mamífero é semelhante em relação a estes dois ácidos gordos, as espécies com níveis mais elevados de encefalização têm maiores necessidades de DHA e AA (Crawford et al., 1999). Também parece que os mamíferos têm uma capacidade limitada para sintetizar esses ácidos graxos a partir de precursores dietéticos. Por conseguinte, as fontes dietéticas de DHA e AA (disponíveis) parecem ser os limitantes nutricionais para a evolução de um maior tamanho do cérebro em muitas linhagens de mamíferos (Crawford, 1992;. Crawford et ai, 1999).
Cordain et al. (2001) demonstraram que os alimentos vegetais selvagens disponíveis na savana africana (por exemplo, tubérculos, nozes) contêm apenas pequenas quantidades de AA e DHA, enquanto que o tecido muscular e a carne de órgãos de ruminantes selvagens africanos fornecem moderados a altos níveis desses ácidos graxos essenciais. Como mostrado na Tabela 1.3, o tecido cerebral é uma rica fonte de AA e DHA, ao passo que os tecidos do fígado e dos músculos são boas fontes de AA e moderadas fontes de DHA. Outras boas fontes de AA e DHA são peixes de água doce, moluscos e crustáceos (Broadhurst et al, 1998;.. Crawford et al, 1999). Cunnane e Crawford (2003) sugeriram que os maiores aumentos na encefalização do hominídeo foram associados com o uso sistemático da recursos aquáticos (marinhos, fluviais ou lacustres). No entanto, há pouca evidência arqueológica para o uso sistemático dos recursos aquáticos até período muito mais tarde na evolução humana (ver Klein, 1999).
Energy, Fat, Protein, AA, and DHA Contents of African Ruminant, Fish, and Wild Plant Foods per 100 g
| Food Item | Energy (kcal) | Fat (g) | Protein (g) | AA (mg) | DHA (mg) |
|---|---|---|---|---|---|
| African ruminant (brain) | 126 | 9.3 | 9.8 | 533 | 861 |
| African ruminant (liver) | 159 | 7.1 | 22.6 | 192 | 41 |
| African ruminant (muscle) | 113 | 2.1 | 22.7 | 152 | 10 |
| African ruminant (fat) | 745 | 82.3 | 1.0 | 20–180 | Trace |
| African fish | 119 | 4.5 | 18.8 | 270 | 549 |
| Wild tuber/roots | 96 | 0.5 | 2.0 | 0 | 0 |
| Mixed wild plants | 129 | 2.8 | 4.1 | 0 | 0 |
-
Source: Data derived from Cordain, L. et al., World Rev. Nutr. Diet. 90, 144, 2001.
Conteúdo de energia, gordura, proteína, AA, e DHA encontrados em ruminantes africanos, peixe, e de plantas selvagens alimentares por 100 g
No geral, a evidência disponível parece melhor apoiar uma estratégia alimentar mista nos primeiros Homo que envolveu o consumo de maiores quantidades de alimentos de origem animal do que com os australopitecos. Um maior consumo de alimentos de origem animal teria aumentado o consumo total de gordura da dieta nos Homo primordiais, e aumentou acentuadamente os níveis de ácidos graxos essenciais (AA e DHA) necessários para o desenvolvimento do cérebro. Junto a estabilidade nutricional foi fornecido um fundamento essencial para abastecer as demandas de energia do cérebro de tamanhos cada vez maiores.
- O metabolismo cerebral e a composição do corpo humano: a importância da gordura
Além de melhorias na qualidade da dieta e maior ingestão de gordura, o aumento do custo metabólico de maior tamanho do cérebro na evolução humana também parece ter sido apoiado por mudanças de desenvolvimento na composição corporal. Durante o curso da vida humana, as demandas metabólicas dos nossos grandes cérebros são mais dramáticas na infância e primeiros anos de vida, quando as relações cérebro/peso do corpo são maiores e quando o crescimento do cérebro é mais rápido. Considerando que o custo ao metabolismo do cérebro fica entre 20%-25% das necessidades de repouso de adultos, mas em uma criança com menos de 10 kg, ele consome mais de 60% (Holliday, 1986)! A Tabela 1.4 mostra as alterações na percentagem de RMR atribuídos ao cérebro ao longo do crescimento e desenvolvimento humano.
Body Weight (kg), Brain Weight (g), Percent Body Fat (%), Resting Metabolic Rate (RMR; kcal/day), and Percent of RMR Allocated to Brain Metabolism (BrMet, %) for Humans from Birth to Adulthood
| Age | Body Weight (kg) | Brain Weight (g) | Body Fat (%) | RMR (kcal/day) | BrMet (%) |
|---|---|---|---|---|---|
| New born | 3.5 | 475 | 16 | 161 | 87 |
| 3 months | 5.5 | 650 | 22 | 300 | 64 |
| 18 months | 11.0 | 1045 | 25 | 590 | 53 |
| 5 years | 19.0 | 1235 | 15 | 830 | 44 |
| 10 years | 31.0 | 1350 | 15 | 1160 | 34 |
| Adult male | 70.0 | 1400 | 11 | 1800 | 23 |
| Adult female | 50.0 | 1360 | 20 | 1480 | 27 |
-
All data are from Holliday (1986), except for percent body fat data for children 18 months and younger, which are from Dewey et al. (1993).
Peso Corporal (kg), Peso Cerebral (g), Percentual de Gordura Corporal (%), Taxa Metabólica de Repouso (RMR; kcal / dia), e percentual do RMR atribuído ao metabolismo do cérebro (BrMet,%) para os seres humanos do nascimento à idade adulta
Para acomodar as demandas de energia extraordinários do cérebro infantil em desenvolvimento, os bebês humanos nascem com uma ampla oferta de gordura corporal (Kuzawa, 1998; Leonard et al., 2003). Com aproximadamente ~ 15% -16% de gordura corporal, os lactentes humanos têm os mais elevados níveis de gordura no corpo do qualquer espécie de mamíferos (cf., Dewey et al, 1993; Kuzawa.,1998). Além disso, os bebês humanos continuam a ganhar gordura corporal durante a seus primeiros anos de vida pós-natal. Durante o primeiro ano, crianças saudáveis, normalmente aumentam a taxa de gordura de quase 16% para cerca de 25% (ver Tabela 1.4). Assim, os níveis muito elevados de adiposidade visto no início do crescimento e desenvolvimento humano coincide com os períodos de maior demanda metabólica do cérebro.
Os bebês humanos e crianças também parecem mostrar adaptações metabólicas para preservar a gordura corporal em face à estressores nutricionais e às doenças. A investigação de crianças do mundo em desenvolvimento sugere que uma leve a moderada desnutrição crônica tem um impacto relativamente pequeno sobre a gordura de uma criança. Em vez de tirar as reservas de gordura, as necessidades nutricionais parecem ser reprimidas, reduzindo substancialmente as taxas de crescimento de altura/ peso, produzindo o problema mais comum da infância: retardo de crescimento ou parada de crescimento que é onipresente entre as populações pobres do mundo em desenvolvimento(Martorell e Habicht, 1986).
A figura 1.4 mostra um exemplo deste processo com base em dados de crescimento coletados de agricultores Tsimane e forrageiros da várzea da Bolívia (de Foster et al., 2005). Note-se que a estatura no início da vida se aproxima da média dos EUA, mas pela idade de 3-4 anos cai abaixo do percentil 5, o que vai acompanhá-los pelo resto da vida. Em contraste, a gordura corporal (medida pela soma do tríceps e subescapular) se compara mais favoravelmente com os padrões norte-americanos, se mantendo entre os percentis 15 e 50 dos EUA. O problema de falha de crescimento na primeira infância é o produto de ambos a pressão aumentada por doenças infecciosas e a redução da qualidade da dieta.
Body Weight (kg), Brain Weight (g), Percent Body Fat (%), Resting Metabolic Rate (RMR; kcal/day), and Percent of RMR Allocated to Brain Metabolism (BrMet, %) for Humans from Birth to Adulthood
| Age | Body Weight (kg) | Brain Weight (g) | Body Fat (%) | RMR (kcal/day) | BrMet (%) |
|---|---|---|---|---|---|
| New born | 3.5 | 475 | 16 | 161 | 87 |
| 3 months | 5.5 | 650 | 22 | 300 | 64 |
| 18 months | 11.0 | 1045 | 25 | 590 | 53 |
| 5 years | 19.0 | 1235 | 15 | 830 | 44 |
| 10 years | 31.0 | 1350 | 15 | 1160 | 34 |
| Adult male | 70.0 | 1400 | 11 | 1800 | 23 |
| Adult female | 50.0 | 1360 | 20 | 1480 | 27 |
-
All data are from Holliday (1986), except for percent body fat data for children 18 months and younger, which are from Dewey et al. (1993).
Os padrões de crescimento físico em estatura (cm) e gordura corporal (como soma de tríceps e subescapular, mm) em meninas tsimane ‘das terras baixas da Bolívia. Crescimento das meninas tsimane ‘é caracterizada por acentuada retardo de crescimento linear, enquanto corpo (mais …)
Trabalhos recentes entre as crianças pobres no Brasil fornece insights sobre os mecanismos fisiológicos associados com a preservação da gordura corporal em condições de déficit de crescimento. Em um estudo com crianças (8-11 anos) que vivem nas favelas de São Paulo, Hoffman et al. (2000) constataram que as crianças que tiveram prejuízo de crescimento tiveram taxas significativamente menores de oxidação de gordura do que os do grupo saudável (“nonstunted”). A diferença observada entre os níveis de oxidação de gordura sob condições de jejum sugeriu que as crianças com baixa estatura derivam cerca de 25% das necessidades de energia em repouso provenientes de gordura, em comparação com 34% no grupo “nonstunted”. Parece que as reduções do IGF-1 (fator de crescimento semelhante a insulina I) comumente observadas no sub-crescimento infantil pode promover uma oxidação de gorduras prejudicada e aumento do armazenamento de gordura (Sawaya et al, 1998, 2004;.. Hoffman et ai, 2000) . De fato, porque a IGF-I tem sido demonstrada aumentar a lipólise (ou seja diminuiu as reservas de gordura) (Hussain et al., 1994), uma redução significativa dos níveis de IGF-I durante o crescimento para resultar na diminuição da oxidação das gorduras.
Em aspectos gerais, a chave de crescimento e desenvolvimento humano da composição corporal são moldadas pelas altas demandas metabólicas do metabolismo do cérebro no início da vida. Os bebês humanos nascem com fragilidade (relativamente pouco desenvolvido para a idade), e ao contrário de outros primatas, continuam com crescimento cerebral acelerado na vida pós-natal precoce (Martin, 1989; Rosenberg, 1992). Para fornecer reservas de energia para as elevadas exigências metabólicas de um cérebro grande, com rápido crescimento, os bebês humanos nascem com elevados níveis de gordura do corpo, e continuam a ganhar gordura durante o primeiro ano de vida pós-natal. Além disso, sob condições de stress nutricional crónico, as crianças humanas mostram a capacidade de preservar o metabolismo do cérebro através de: (a) “regulação negativa” do crescimento ponderal, (b) redução da oxidação da gordura, e (c) aumento do armazenamento de gordura. Essas respostas adaptativas são evidenciadas na preservação de gordura corporal nas crianças subnutridas (stunted children), e na tendência das crianças com baixa estatura em ganhar peso e gordura corporal mais tarde na vida (ver Frisancho, 2003; Grillo et al, 2005;. Hoffman et al ., 2007).
- CONCLUSÕES

A evolução do grande tamanho do cérebro humano teve implicações importantes para a biologia nutricional da nossa espécie. Os seres humanos gastam uma parcela muito maior do seu orçamento energético de repouso em comparação com o metabolismo do cérebro de outros primatas e mamíferos não-primatas. Análises comparativas de padrões alimentares dos primatas indicam que os altos custos de grandes cérebros humanos são suportados, pelo menos em parte, por dietas que são ricos em energia e gordura. Em relação a outros macacos de grande porte, os humanos modernos derivam uma parcela muito maior de sua energia a partir da gordura alimentar. Entre os primatas vivos, a proporção relativa de energia metabólica alocada para o cérebro é positivamente correlacionada com a qualidade da alimentação. Os seres humanos caem no final positivo desta relação, tendo ambos uma dieta muito de alta qualidade e um grande cérebro.
A maior encefalização também parece ter consequências para composição do corpo humano, especialmente no início da vida. Os bebês humanos têm níveis mais elevados de adiposidade do que as crianças de outros mamíferos. Estes maiores níveis de gordura corporal permitem aos bebês humanos acomodar o crescimento de seus grandes cérebros por ter um pronto fornecimento de energia armazenada. Sob condições de estresse nutricional, os bebês humanos e as crianças preservam as reservas de gordura corporal para o metabolismo cerebral, reduzindo as taxas de crescimento linear. Este processo de “retardo de crescimento linear” também está associada a taxas reduzidas de oxidação de gordura e aumento das taxas de armazenamento de gordura. Assim, os seres humanos parecem mostram adaptações importantes no metabolismo da gordura para acomodar as altas demandas de energia do cérebro no início da vida.
O registro fóssil humano indica que grandes mudanças, tanto o tamanho do cérebro e da dieta ocorreu em associação com o aparecimento dos primeiros membros do gênero Homo entre 2,0 e 1,7 milhões de anos atrás na África. Com a evolução do início H. erectus em 1,8 milhões de anos atrás, encontramos evidências de uma importante guinada adaptativa – a evolução do primeira economia caçadora – coletora, caracterizada por um maior consumo de alimentos de origem animal, o transporte de recursos alimentares para “bases domésticas”, e partilha de alimentos entre os grupos sociais. O H. erectus era semelhante aos humanos no tamanho do corpo e proporções, e tinha um tamanho do cérebro do que é observado em primatas não humanos, aproximando-se a gama dos seres humanos modernos. Além disso, o tamanho reduzido da face e da dentição do H. erectus, juntamente com a sua tecnologia mais sofisticada em ferramentas sugerem que estes hominídeos estavam consumindo uma dieta em maior qualidade e mais estável, que teria ajudado a alimentar os aumentos no tamanho do cérebro. Consequentemente, enquanto a mudança na dieta não era a principal força responsável pela evolução de grande tamanho do cérebro humano, as melhorias na qualidade da dieta e aumento do consumo de gordura na dieta parece ter sido uma condição necessária para a promoção de encefalização na linhagem humana.
Associado com a evolução da nossa dieta de alta densidade energética, os humanos desenvolveram vias moleculares distintas para detectar e metabolizar alimentos ricos em gordura. Mostramos preferências por alimentos que são ricos em gordura e energia. Mutações genéticas fundamentais durante a evolução dos hominídeos mais tarde foram fundamentais para promover a robustez do metabolismo lipídico necessário para subsistir em dietas com maiores níveis de material de origem animal. Além disso, o acúmulo de evidências destaca a notável capacidade do cérebro humano e do sistema sensorial para avaliar com precisão o conteúdo energético potencial dos alimentos. Em suma, a capacidade de detectar de forma eficaz, metabolizar e armazenar gorduras provável forneceu tremendas vantagens seletivas para os nossos ancestrais hominídeos, o que lhes permitiu expandir nos mais diversos ecossistemas em todo o mundo (flexibilidade adaptativa, NT). Mais pesquisas são necessárias para entender melhor a natureza das mudanças na dieta que ocorreram com o surgimento dos ancestrais humanos e como eles estão associados a aspectos distintos da nossa própria biologia nutricional.
Texto original em: LINK
REFERêNCIAS
- Aiello LC, Wheeler P. The expensive-tissue hypothesis: The brain and the digestive system in human and primate evolution. Curr Anthropol. 1995;36:199–221.
- Antón SC. A natural history of Homo erectus. Yrbk. Phys. Anthropol. 2003;46:126–170. [PubMed]
- Antón SC, Swisher CC III. Evolution of cranial capacity in Asian Homo erectus. In: Yogyakarta E Indriati., editor. A Scientific Life: Papers in Honor of Dr. T. Jacob. Indonesia: Bigraf; 2001. pp. 25–39.
- Antón SC, Leonard WR, Robertson ML. An ecomorphological model of the initial hominid dispersal from Africa. J Hum Evol. 2002;43:773–785. [PubMed]
- Asfaw B, Beyene Y, Suwa G, Walter RC, White TD, WoldeGabriel G, Yemane T. The earliest Acheulean from Konso-Gardula. Nature. 1992;360:732–735. [PubMed]
- Behrensmeyer K, Todd NE, Potts R, McBrinn GE. Late Pliocene faunal turnover in the Turkana basin, Kenya and Ethiopia. Science. 1997;278:1589–1594. [PubMed]
- Bobe R, Behrensmeyer AK. Faunal change, environmental variability and late Pliocene hominin evolution. J Hum Evol. 2002;42:475–497. [PubMed]
- Briefel RR, Johnson CL. Secular trends in dietary intake in the United States. Ann Rev Nutr. 2004;24:401–431. [PubMed]
- Broadhurst CL, Cunnane SC, Crawford MA. Homo. Br. J. Nutr. Vol. 79. 1998. Rift Valley lake fish and shellfish provided brain-specific nutrition for early; pp. 3–21. [PubMed]
- Bunn HT. Unger PS, editor. Meat made us human. New York: Oxford University Press; Evolution of the Human Diet: The Known, the Unknown, and the Unknowable. 2006:191–211.
- Cordain L, Brand-Miller J, Eaton SB, Mann N, Holt SHA, Speth JD. Plant to animal subsistence ratios and macronutrient energy estimations in world-wide hunter-gatherer diets. Am J Clin Nutr. 2000;71:682–692. [PubMed]
- Cordain L, Watkins BA, Mann NJ. Fatty acid composition and energy density of foods available to African hominids. World Rev Nutr Diet. 2001;90:144–161. [PubMed]
- Crawford MA. The role of dietary fatty acids in biology: Their place in the evolution of the human brain. Nutr Rev. 1992;50:3–11. [PubMed]
- Crawford MA, Bloom M, Broadhurst CL, Schmidt WF, Cunnane SC, Galli C, Gehbremeskel K, Linseisen F, Lloyd-Smith J, Parkington J. Evidence for unique function of docosahexaenoic acid during the evolution of the modern human brain. Lipids. 1999;34:S39–S47. [PubMed]
- Cunnane SC, Crawford MA. Survival of the fattest: Fat babies were the key to evolution of the large human brain. Comp. Biochem. Physiol. A. 2003;136:17–26. [PubMed]
- Davignon J, Gregg RE, Sing CF. Apolipoprotein E polymorphism and atherosclerosis. Arteriosclerosis. 1988;8:1–21. [PubMed]
- deMenocal PB. African climate change and faunal evolution during the Pliocene–Pleistocene. Earth Planet Sci Lett. 2004;220:3–24.
- Dewey KG, Heinig MJ, Nommsen LA, Peerson JM, Lonnerdal B. Breast-fed infants are leaner than formula-fed infants at 1 y of age: The Darling Study. Am J Clin Nutr. 1993;52:140–145. [PubMed]
- Dufour DL. Insects as food: A case study from the Northwest Amazon. Am Anthropol. 1987;89:383–397.
- Finch CE, Stanford CB. Meat-adaptive genes and the evolution of slower aging in humans. Quart Rev Biol. 2004;79:3–50. [PubMed]
- Foster Z, Byron E, Reyes-García V, Huanca T, Vadez V, Apaza L, Pérez E, Tanner S, et al. Physical growth and nutritional status of Tsimane’ Amerindian children of lowland Bolivia. Am J Phys Anthropol. 2005;126:343–351. [PubMed]
- Frisancho AR. Reduced rate of fat oxidation: A metabolic pathway to obesity in the developing nations. Am J Hum Biol. 2003;15:35–52. [PubMed]
- Gabunia L, Vekua A, Lordkipanidze D, Swisher CC, Ferring R, Justus A, Nioradze M, et al. Earliest Pleistocene cranial remains from Dmanisi, Republic of Georgia: Taxonomy, geological setting, and age. Science. 2000;288:1019–1025. [PubMed]
- Gabunia L, Antón SC, Lordkipanidze D, Vekua A, Justus A, Swisher CC III. Dmanisi and dispersal. Evol Anthropol. 2001;10:158–170.
- Gaillard D, Passilly-Degrace P, Besnard P. Molecular mechanisms of fat preference and overeating. Ann N Y Acad Sci. 2008;1141:163–175. [PubMed]
- Grillo LP, Siqueira AFA, Silva AC, Martins PA, Verreschi ITN, Sawaya AL. Lower resting metabolic rate and higher velocity of weight gain in a prospective study of stunted vs. nonstunted girls living in the shantytowns of São Paulo, Brazil. Eur J Clin Nutr. 2005;59:835–842. [PubMed]
- Harris JWK, Capaldo S. The earliest stone tools: Their implications for an understanding of the activities and behavior of late Pliocene hominids. In: Berthelet A, Chavaillon J, editors. The Use of Tools by Human and Nonhuman Primates. Oxford: Oxford Science Publications; 1993. pp. 196–220.
- Hoffman DJ, Sawaya AL, Verreschi I, Tucker KL, Roberts SB. Why are nutritionally stunted children at increased risk of obesity? Studies of metabolic rate and fat oxidation in shantytown children from São Paulo, Brazil. Am J Clin Nutr. 2000;72:702–707. [PubMed]
- Hoffman DJ, Martins PA, Roberts SB, Sawaya AL. Body fat distribution in stunted compared to normal-height children from the shantytowns of São Paulo, Brazil. Nutrition. 2007;23:640–646. [PubMed]
- Holliday MA. Body composition and energy needs during growth. In: Falkner F, Tanner JM, editors. Human Growth: A Comprehensive Treatise. 2nd edn. Vol. 2. New York: Plenum Press; 1986. pp. 101–117.
- Hussain MA, Schmintz O, Mengel, Glatz Y, Christiansen JS, Zapf J, Froesch ER. Comparison of the effects of growth hormone and insulin-like growth factor I on substrate oxidation and on insulin sensitivity in growth hormone-defficient humans. J Clin Invest. 1994;94:1126–1133. [PMC free article] [PubMed]
- Johns T. The Origins of Human Diet and Medicine. Tucson, AZ: University of Arizona Press; 1996.
- Kety SS. The general metabolism of the brain in vivo. In: Richter D, editor. Metabolism of the Central Nervous System. New York: Pergamon; 1957. pp. 221–237.
- Klein RG. The Human Career: Human Biological and Cultural Origins. 2nd edn. Chicago, IL: University of Chicago Press; 1999.
- Kuzawa CW. Adipose tissue in human infancy and childhood: An evolutionary perspective. Yrbk Phys Anthropol. 1998;41:177–209. [PubMed]
- Le Coutre J, Schmitt JAJ. Food ingredients and cognitive performance. Curr. Opin. Clin. Nutr. Metab. Care. 2008;11:706–710. [PubMed]
- Leonard WR. Food for thought: Dietary change was a driving force in human evolution. Sci. Am. 2002;287(6):106–115. [PubMed]
- Leonard WR, Robertson ML. Nutritional requirements and human evolution: A bio-energetics model. Am J Hum Biol. 1992;4:179–195.
- Leonard WR, Robertson ML. Evolutionary perspectives on human nutrition: The influence of brain and body size on diet and metabolism. Am J Hum Biol. 1994;6:77–88.
- Leonard WR, Robertson ML. Comparative primate energetics and hominid evolution. Am J Phys Anthropol. 1997;102:265–281. [PubMed]
- Leonard WR, Robertson ML, Snodgrass JJ, Kuzawa CW. Metabolic correlates of hominid brain evolution. Comp. Biochem. Physiol., Part A. 2003;136:5–15. [PubMed]
- Lussana F, Painter RC, Ocke MC, Buller HR, Bossuyt PM, Roseboom TJ. Prenatal exposure to the Dutch famine is associated with a preference for fatty foods and a more atherogenic lipid profile. Am J Clin Nutr. 2008;88:1648–1652. [PubMed]
- Martin RD. Primate Origins and Evolution: A Phylogenetic Reconstruction. Princeton, NJ: Princeton University Press; 1989.
- Martorell R, Habicht JP. Growth in early childhood in developing countries. In: Falkner F, Tanner JM, editors. Human Growth: A Comprehensive Treatise. 2nd edn. Vol. 3. New York: Plenum Press; 1986. pp. 241–262.
- McHenry HM. Body size and proportions in early hominids. Am J Phys Anthropol. 1992;87:407–431. [PubMed]
- McHenry HM. Tempo and mode in human evolution. Proc Natl Acad Sci U S A. 1994a;91:6780–6786. [PMC free article] [PubMed]
- McHenry HM. Behavioral ecological implications of early hominid body size. J Hum Evol. 1994b;27:77–87.
- McHenry HM, Coffing K. Australopithecus to Homo: Transformations in body and mind. Ann Rev Anthropol. 2000;29:125–146.
- Messer E. Some like it sweet: Estimating sweetness preferences and sucrose intakes from ethnographic and experimental data. Am Anthropol. 1986;88:637–647.
- Millstone E, Lang T. The Penguin Atlas of Food. New York: Penguin Books; 2003.
- Milton K. Primate diets and gut morphology: Implications for human evolution. In: Harris M, Ross EB, editors. Food and Evolution: Toward a Theory of Human Food Habits. Philadelphia, PA: Temple University Press; 1987. pp. 93–116.
- Milton K. The critical role played by animal source foods in human (Homo) evolution. J Nutr. 2003;133:3886S–3892S. [PubMed]
- Plummer T. Flaked stones and old bones: Biological and cultural evolution at the dawn of technology. Yrbk Phys Anthrpol. 2004;47:118–164. [PubMed]
- Popovich DG, Jenkins DJA, Kendall CWC, Dierenfeld ES, Carroll RW, Tariq N, Vidgen E. The western lowland gorilla diet has implications for the health of humans and other hominoids. J Nutr. 1997;127:2000–2005. [PubMed]
- Potts R. Early Hominid Activities at Olduvai. New York: Aldine; 1988a.
- Potts R. Environmental hypotheses of hominin evolution. Yrbk Phys Anthropol. 1998b;41:93–136. [PubMed]
- Reed K. Early hominid evolution and ecological change through the African Plio-Pleistocene. J Hum Evol. 1997;32:289–322. [PubMed]
- Richard AF. Primates in Nature. New York: WH Freeman; 1985.
- Rosenberg KR. The evolution of modern human childbirth. Yrbk Phys Anthropol. 1992;35:89–124.
- Ruff CB, Trinkaus E, Holliday TW. Body mass and encephalization in Pleistocene. Homo. Nature. 1997;387:173–176. [PubMed]
- Sailer LD, Gaulin SJC, Boster JS, Kurland JA. Measuring the relationship between dietary quality and body size in primates. Primates. 1985;26:14–27.
- Salbe AD, DelParigi A, Pratley RE, Drewnowski A, Tataranni PA. Taste preferences and body weight changes in an obesity-prone population. Am J Clin Nutr. 2004;79:372–478. [PubMed]
- Sawaya AL, Grillo LP, Verreschi I, da Silva AC, Roberts SB. Mild stunting is associated with higher susceptibility to the effects high fat diets: Studies in a shantytown population in São Paulo, Brazil. J Nutr. 1998;128:415S–420S. [PubMed]
- Sawaya AL, Martins PA, Grillo LP, Florêncio TT. Long-term effects of early malnutrition on body weight regulation. Nutr Rev. 2004;62:S127–133. [PubMed]
- Sclafani A. Psychobiology of food preferences. Int J Obes. 2001;25:S13–16. [PubMed]
- Stanford CB. The hunting ecology of wild chimpanzees: Implications for the evolutionary ecology of Pliocene hominids. Am Anthropol. 1996;98:96–113.
- Teleki G. The omnivorous diet and eclectic feeding habits of the chimpanzees of Gombe National Park. In: Harding RSO, Teleki G, editors. Omnivorous Primates. New York: Columbia University Press; 1981. pp. 303–343.
- Toepel U, Knebel J-F, Hudry J, le Coutre J, Murray MM. The brain tracks the energetic value in food images. NeuroImage. 2009;44:967–974. [PubMed]
- Tutin CEG, Fernandez M. Insect-eating by sympatric lowland gorillas (Gorilla g. gorilla) and chimpanzees (Pan t. troglodytes) in the Lopé Reserve, Gabon. Am J Primatol. 1992;28:29–40.
- Tutin CEG, Fernandez M. Composition of the diet of chimpanzees and comparisons with that of sympatric lowland gorillas in the Lopé Reserve, Gabon. Am J Primatol. 1993;30:195–211.
- Vrba ES. The fossil record of African antelopes relative to human evolution. In: Vrba ES, Denton GH, Partridge TC, Burkle LH, editors. Paleoclimate and Evolution, with Emphasis on Human Origins. New Haven, CT: Yale University Press; 1995. pp. 385–424.
- Wolpoff MH. Paleoanthropology. 2nd edn. Boston, MA: McGraw-Hill; 1999.
- Wynn JG. Influence of Plio-Pleistocene aridification on human evolution: Evidence from paleosols from the Turkana Basin, Kenya. Am J Phys Anthropol. 2004;123:106–118. [PubMed]