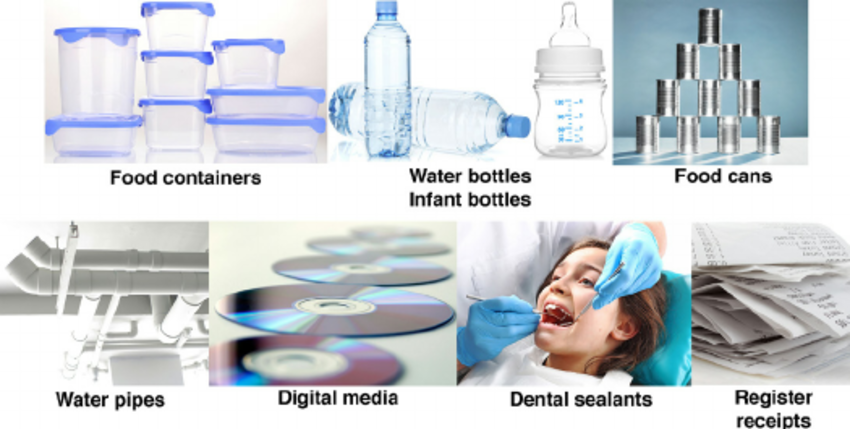
Fontes comuns de BPA: embalgens alimentares; garrafas d’água e mamadeiras; lâmina interna de enlatados; encanamentos; mídia digital como CD/DVD; selante odontológico; notas e recibos de máquinas de cartões.
https://www.mdpi.com/1422-0067/23/5/2894/htm
Chloe Welch1 e Kimberly Mulligan2
1Divisão de Ciências Biológicas, Universidade da Califórnia, San Diego, 9500 Gilman Drive, La Jolla, CA 92093, EUA
2Departamento de Ciências Biológicas, California State University, Sacramento, 6000 J Street, Sacramento, CA 95819, EUA
07 de março de 2022
[NOTA DO WEBSITE: Peço com toda minha afetividade que as pessoas leiam as partes que traduzi e transcrevi desta publicação abaixo. Principalmente pessoas que lidam com crianças em estabelecimentos de ensino. É triste como estamos deixando nossas crianças completamente lesadas por nossa negligência e displiscência de conhecermos o que as corporações e os administradores públicos estão fazendo e nos tornando, os consumidores, totalmente ignorantes e distraídos, nos grandes responsáveis pelo crime que nosso tempo está impetrando às futuras gerações].
Resumo
Evidências substanciais indicam que o bisfenol A (BPA), um químico ambiental onipresente usado na síntese de plásticos de policarbonato e resinas epóxi, pode prejudicar o desenvolvimento do cérebro. Estudos clínicos e epidemiológicos explorando possíveis conexões entre BPA e transtornos do neurodesenvolvimento em humanos, identificaram repetidamente correlações entre a exposição precoce ao BPA e transtornos do desenvolvimento, como transtorno de déficit de atenção/hiperatividade e transtorno do espectro autista (nt.: destaque dado pela tradução). Investigações usando modelos animais de invertebrados e vertebrados revelaram que a exposição ao BPA no desenvolvimento fetal, pode prejudicar vários aspectos do desenvolvimento neuronal, incluindo proliferação e diferenciação de células-tronco neurais, formação de sinapses, e plasticidade sináptica — fenótipos neuronais que se acredita sustentarem as mudanças fundamentais nos distúrbios do neurodesenvolvimento associados ao comportamento. Consistente com os fenótipos neuronais causados pelo BPA, as análises comportamentais de animais tratados com BPA mostraram impactos significativos nos endofenótipos comportamentais relacionados a distúrbios do neurodesenvolvimento, incluindo atividade locomotora alterada, déficits de aprendizado e memória além de comportamento semelhante à ansiedade. Para contextualizar as correlações entre BPA e distúrbios do neurodesenvolvimento em humanos, esta revisão resume a literatura atual sobre a neurotoxicidade do desenvolvimento do BPA em animais de laboratório com ênfase em fenótipos neuronais, mecanismos moleculares e resultados comportamentais.
[NOTA DO WEBSITE: colocamos essa imagem abaixo para que se veja quando o BPA afeta o neurodesenvolvimento dos embriões. Exatamente nos primeiros dias quando a tiroxina materna é imprescindpivel porque só após a formação do SNC e da tiroide é que o feto começa a ter habilidade de usar seus próprios hormônios para seu desenvolvimento saudável].
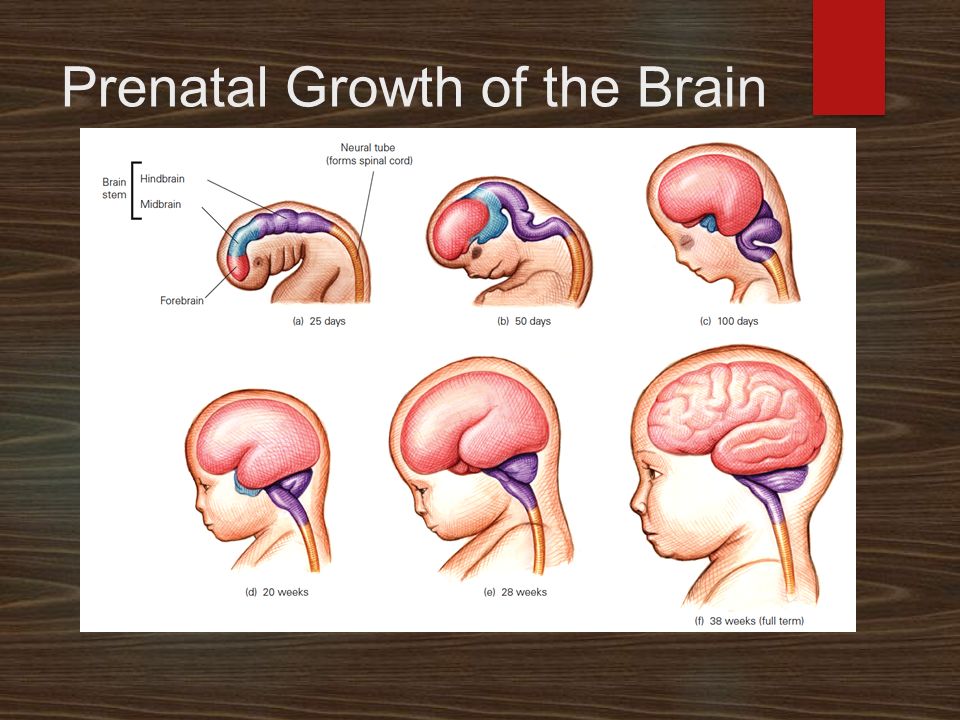
Apenas 25 dias após a concepção (a), o sistema nervoso central já está evidente. O cérebro parece distintamente humano no dia 100 (c). Na 28ª semana de gestação (e), as várias seções do cérebro são reconhecíveis. Quando o feto está a termo (f), todas as partes do cérebro, incluindo o córtex (as camadas externas), são formadas, dobrando-se umas sobre as outras e tornando-se mais enroladas, ou enrugadas, à medida que o número de células cerebrais aumenta.
1. Introdução
O bisfenol A (BPA, 2,2-bis (4′-hidroxifenil) propano), um produto químico onipresente usado na síntese de plástico policarbonato e resinas epóxi, está tomando forma como um fator de risco para distúrbios do neurodesenvolvimento (NDDs). NDDs referem-se a um grupo heterogêneo de distúrbios do sistema nervoso causados por alterações no desenvolvimento do cérebro, incluindo transtorno do espectro autista (TEA), transtorno de déficit de atenção/hiperatividade (TDAH), deficiência intelectual (DI), dificuldades de aprendizagem, paralisia cerebral, distúrbios convulsivos e deficiências na visão e na audição. A análise da prevalência de deficiências de desenvolvimento nos Estados Unidos (EUA) entre 2009 e 2017 indicou que 16,93% das crianças foram diagnosticadas com NDD [1]. Estudos também descobriram que a prevalência de NDDs aumentou significativamente nas últimas décadas – mais notavelmente, a incidência de TEA aumentou quase 300% nos últimos 20 anos [2, 3].
………………………………………………………………………………………………
O BPA é classificado como um produto químico que age como disruptor endócrino (EDC) devido à sua capacidade de se ligar a receptores hormonais endógenos e causar efeitos adversos. Estruturalmente semelhante ao estradiol, o BPA é mais conhecido por sua capacidade de agonizar e antagonizar os subtipos de receptores de estrogênio (ER) e antagonizar os receptores de andrógenos [10, 11]. O BPA também provoca impactos não estrogênicos/não androgênicos no desenvolvimento ao se ligar a outros receptores, incluindo o receptor do hormônio da tiroide -tiroxina- [12, 13], o receptor de glicocorticóides [14, 15, 16], o receptor acoplado à proteína G, GPR30 [17] e Receptor γ Ativado por Proliferador de Peroxissoma (PPARγ) [18, 19]. A capacidade do BPA de influenciar a sinalização hormonal foi documentada pela primeira vez na década de 1930 [20, 21].
[NOTA DO WEBSITE: interrupção da tradução para ressalvar essa citação acima destacada. Por quê? Aqui é dito que a molécula do BPA é ‘estruturalmente semelhante ao estradiol’. Ou seja, ao hormônio feminino! E que se sabe disso desde os anos 30. Mais um assombro. Será que sendo assim tão próximo, fisiologicamente, ao hormônio feminino e não ao masculino, não ocorreria a nível celular alguma interferência na substituição na conexão com os receptores que SOMENTE aceitariam hormônio feminino para atuar junto ao núcleo da célula, mesmo dos machos? E assim causar auterações fisiológicas, irreversíveis, nos organismos vivos, inclusive humanos? Será que não podemos agora entender porque esse -nem vamos mencionar os outros disruptores endócrinos- imitando o hormônio feminino está, inquestionavelmente, feminizando os embriões machos, inclusive os humanos? Isso se sabe desde 1989, e torna-se irrefutável desde o início dos anos 90, com o livro de Theo Colborn, ‘Our Stolen Future’ -no Brasil ‘O Futuro Roubado’-. E ainda tem-se que mencionar que ao se tentar usar o BPA como hormônio sintético feminino nos anos 30, o pesquisador da Universidade de Londres, Edward Charles Dodds considerou-o muito ‘fraco’. Com isso cria, em laboratório, a ‘molécula mãe’ de todos os estrogênios, conforme suas palavras, o malfadado Dietilestilbestrol/DES. Com sua dispersão por milhares de corpos de mães grávidas, causa a geração de milhares de crianças disfuncionais por mais 20 anos! Será que esse ‘cientista’ foi punido juntamente com as corporações que até hoje disseminam o BPA pelo mundo, disfuncionando milhares e milhares de nossos filhos? Parece que esses crimes, ‘científico’ e corporativo, não existem para a sociedade planetária de nossos tempos?]
Apesar da consciência de sua capacidade de ser um disruptor endócrino, o BPA foi adaptado para uso na síntese de plásticos da resina plástica Policarbonato na década de 1950 (nt.: destaque da tradução. Essa resina nasce da reação química do gás de guerra, mais utilizado na 1ª Guerra Mundial, Fosgênio e o BPA. E dessa união JÁ CONHECIDA de uma arma de guerra com um hormônio feminino se fez, durante décadas, mamadeiras e utensílios infantis. Crime corporativo?) e rapidamente se tornou um dos compostos sintéticos mais prevalentes no mundo [6, 22]. Estima-se que 7,7 milhões de toneladas métricas de BPA foram geradas em todo o mundo em 2015. A produção deverá aumentar para 10,6 milhões de toneladas métricas em 22 [6].
O BPA entra no corpo por ingestão, absorção dérmica e inalação, sendo a ingestão a via de exposição mais comum [23, 24, 25]. Uma grande variedade de produtos usados na vida cotidiana contém BPA, incluindo recipientes plásticos, papéis térmicos, latas de alimentos e latas de bebidas [26, 27, 28] (nt.: destaque dado pela tradução). O BPA residual pode lixiviar desses produtos devido à polimerização incompleta durante a produção ou despolimerização quando exposto a altas temperaturas ou condições extremas de pH, que aceleram a hidrólise das ligações éster que ligam os monômeros de BPA [6].
Devido a preocupações em torno das capacidades do BPA de desregular o sistema endócrino, a União Europeia proibiu seu uso em todos os produtos infantis a partir de 2011, e a Food and Drug Administration dos EUA seguiu o exemplo em 2012. No entanto, o BPA continua difundido em nossos ambientes; de maior preocupação, as mulheres grávidas ainda estão persistentemente expostas ao BPA de várias maneiras. A estrutura lipofílica do BPA permite que ele atravesse facilmente as membranas celulares, bem como as barreiras placentária e hematoencefálica [29, 30, 31], permitindo que sua capacidade de afetar potencialmente o programa de desenvolvimento neurológico de um embrião ou feto em crescimento (nt.: atualmente está inquestionável de que os disruptores endócrinos estão afetando o hormônio da tiroide, tiroxina, das mães, que é imprescindível para o desenvolvimento saudável do SNC/sistema nervoso central, ou seja, do cérebro, dos embriões nos primeiros dias, incluindo humanos).
Apesar da vasta evidência de que o BPA deve ser regulado com mais rigor, estabelecer níveis de exposição seguros é complicado, como evidenciado pelas variadas doses de referência em diferentes países. Por exemplo, a dose de referência atual definida pela EPA/Agência de Proteção Ambiental nos EUA é de 50 mg/kg/dia [32], a dose tolerável definida (TDI) no Canadá é de 25 mg/kg/dia [33], enquanto a A Autoridade Europeia de Segurança Alimentar (EFSA) estabeleceu seu TDI em 4 mg/kg/dia [34].
As doses de referência de BPA podem ser limites razoáveis para adultos, mas a pesquisa resumida nesta revisão e outras sugerem que doses na faixa de ng/kg/dia podem ter impactos deletérios no desenvolvimento do cérebro de animais de laboratório [ 35 ]. Em humanos adultos, o BPA não se bioacumula e é metabolizado e excretado em 48 h; no entanto, dada a sua prevalência ambiental, muitos indivíduos sofrem exposição crônica. Além disso, enquanto os níveis de exposição ao BPA são geralmente baixos em adultos, com média de 0,043 mg/kg/dia no Canadá e 0,073 mg/kg/dia nos EUA [ 32 ], os níveis de exposição fetal, infantil e infantil são muito maiores. ….
…………………………………………………………………………………………
Como muitos outros Disruptores Endócrinos, o BPA pode provocar respostas de dose não monotônicas [39, 40], que produzem curvas de resposta à dose em forma de U em vez de curvas lineares de resposta à dose. O BPA também pode causar respostas distintas dependendo do ponto de tempo de desenvolvimento da exposição. Assim, dependendo da dose administrada e da duração da exposição, uma dose mais alta de BPA pode provocar um fenótipo mais leve do que uma dose mais baixa [22, 40, 41], o que significa que, quando uma determinada dose de BPA não provoca um impacto negativo na saúde, não se pode presumir que todas as doses mais baixas sejam seguras.
Consistente com o cérebro sendo, por isso, um alvo comumente relatado dos Disruptores Endócrinos [42], a exposição precoce ao BPA está associada a comprometimento comportamental e NDDs em crianças [7, 8, 9]. Estudos longitudinais que mediram os níveis de exposição materna ao BPA durante a gravidez e, posteriormente, examinaram as crianças identificaram correlações positivas entre BPA e sintomas relacionados ao TDAH [43], déficits de aprendizagem [44, 45], comportamentos externalizantes [46] e ansiedade e depressão [47].
…………………………………………………………………………………..
6. conclusões
Esta revisão descreveu os impactos no desenvolvimento neurológico – molecular, celular e comportamental – resultantes da exposição precoce ao BPA em organismos que abrangem o reino animal, de invertebrados a mamíferos. Enquanto os animais de laboratório usados nesses estudos serviram em grande parte como modelos para entender os impactos humanos da exposição ao BPA, deve-se enfatizar que o BPA claramente prejudicou o neurodesenvolvimento de organismos em todo o nosso ambiente, sugerindo amplas implicações para o ecossistema.As mudanças comportamentais causadas pelo BPA em modelos animais são amplamente consistentes com os comportamentos humanos associados à exposição ao BPA, incluindo hiperatividade, déficits de aprendizado e comportamento semelhante à ansiedade. Em modelos animais, os impactos no desenvolvimento neurológico associados à exposição a baixas e altas doses de BPA durante o desenvolvimento são vastos, começando com interrupções no desenvolvimento do SNC/sistema nervoso central (nt.: desenvolvimento do cérebro dos embriões) e estendendo-se ao crescimento axônico e defeitos de orientação, dendritogênese prejudicada e plasticidade sináptica alterada. Os achados apresentados nesta revisão indicam coletivamente que a exposição ao BPA durante o desenvolvimento deve ser considerada um fator de risco para NDDs em humanos.
Contribuições do autor
CW e KM fizeram contribuições substanciais para a redação e edição desta revisão. Todos os autores leram e concordaram com a versão publicada do manuscrito.
Financiamento
Os encargos de publicação foram suportados pelo Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde sob o número de prêmio 5 SC2 GM132005.
Declaração do Conselho de Revisão Institucional
Não aplicável.
Declaração de Consentimento Informado
Não aplicável.
Declaração de disponibilidade de dados
Não aplicável.
Conflitos de interesse
Os autores declaram não haver conflito de interesses.
Referências
- Zablotsky, B.; Preto, LI; Maenner, MJ; Schieve, LA; Danielson, ML; Bitsko, RH; Blumberg, SJ; Kogan, MD; Boyle, CA Prevalência e tendências de deficiências de desenvolvimento entre crianças nos Estados Unidos: 2009–2017. Pediatria 2019 , 144 , e20190811. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Baio, J.; Wiggins, L.; Christensen, DL; Maenner, MJ; Daniels, J.; Warren, Z.; Kurzius-Spencer, M.; Zahorodny, W.; Robinson, CR; Rosenberg, CR; et ai. Prevalência do Transtorno do Espectro do Autismo entre Crianças de 8 Anos—Rede de Monitoramento de Deficiências de Autismo e Desenvolvimento, 11 Sites, Estados Unidos, 2014. MMWR. Vigilância. Sum. 2018 , 67 , 1-23. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Maenner, MJ; Shaw, KA; Baio, J.; Washington, A.; Patrick, M.; DiRienzo, M.; Christensen, DL; Wiggins, LD; Pettygrove, S.; Andrews, JG; et ai. Prevalência do Transtorno do Espectro Autista entre Crianças de 8 Anos—Rede de Monitoramento de Autismo e Deficiências de Desenvolvimento, 11 Sites, Estados Unidos, 2016. Morb. Mortal. Semanalmente. Rep. Vigilância. Sum. 2020 , 69 , 1-12. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Herbert, MR Contribuições do meio ambiente e fisiologia ambientalmente vulnerável para transtornos do espectro do autismo. atual Opinião. Neurol. 2010 , 23 , 103-110. [ Google Scholar ] [ CrossRef ]
- Matelski, L.; Van de Water, J. Fatores de risco no autismo: Pensando fora do cérebro. J. Autoimune. 2016 , 67 , 1–7. [ Google Scholar ] [ CrossRef ]
- Almeida, S.; Raposo, A.; Almeida-González, M.; Carrascosa, C. Bisfenol A: Exposição alimentar e impacto na saúde humana. Compr. Rev. Food Sci. Comida Saf. 2018 , 17 , 1503-1517. [ Google Scholar ] [ CrossRef ]
- De Cock, M.; Maas, YG; Van De Bor, M. A exposição perinatal a desreguladores endócrinos induz o espectro do autismo e transtornos de déficit de atenção e hiperatividade? Análise. Acta Pediatra. 2012 , 101 , 811-818. [ Google Scholar ] [ CrossRef ]
- Minatoya, M.; Kishi, R. Uma Revisão de Estudos Recentes sobre Exposições de Bisfenol A e Ftalatos e Neurodesenvolvimento Infantil. Int. J. Ambiente. Res. Saúde Pública 2021 , 18 , 3585. [ Google Scholar ] [ CrossRef ]
- Mustieles, V.; Fernández, MF O bisfenol A molda o cérebro e o comportamento das crianças: rumo a uma avaliação integrada de neurotoxicidade, incluindo dados humanos. Ambiente. Saúde 2020 , 19 , 66. [ Google Scholar ] [ CrossRef ]
- Wetherill, YB; Akingbemi, BT; Kanno, J.; McLachlan, JA; Nadal, A.; Sonnenschein, C.; Watson, CS; Zoeller, RT; Belcher, SM Mecanismos moleculares in vitro da ação do bisfenol A. Reproduzir. Toxicol. 2007 , 24 , 178-198. [ Google Scholar ] [ CrossRef ]
- Bonefeld-Jørgensen, EC; Longo, M.; Hofmeister, MV; Vinggaard, AM Potencial de Disrupção Endócrina do Bisfenol A, Dimetacrilato de Bisfenol A, 4- N -Nonilfenol e 4- N -Octilfenolina Vitro: Novos Dados e uma Breve Revisão. Ambiente. Perspectiva da Saúde. 2007 , 115 , 69-76. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Moriyama, K.; Tagami, T.; Akamizu, T.; Usui, T.; Saijó, M.; Kanamoto, N.; Hataya, Y.; Shimatsu, A.; Kuzuya, H.; Nakao, K. A ação do hormônio da tireóide é interrompida pelo bisfenol A como um antagonista. J. Clin. Endocrinol. Metab. 2002 , 87 , 5185-5190. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Sun, H.; Shen, O.-X.; Wang, X.-R.; Zhou, L.; Zhen, S.-Q.; Chen, X.-D. Atividade do hormônio antitireoidiano do bisfenol A, tetrabromobisfenol A e tetraclorobisfenol A em um ensaio aprimorado do gene repórter. Toxicol. Vitr. 2009 , 23 , 950-954. [ Google Scholar ] [ CrossRef ]
- Wang, J.; Sun, B.; Hou, M.; Pan, X.; Li, X. O obesogênio ambiental bisfenol A promove adipogênese aumentando a quantidade de 11β-hidroxiesteróide desidrogenase tipo 1 no tecido adiposo de crianças. Int. J. Obes. 2012 , 37 , 999-1005. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Prasanth, GK; Divya, LM; Sadasivan, C. Bisfenol-A pode se ligar ao receptor de glicocorticóide humano como um agonista: Um estudo in silico. J. Appl. Toxicol. 2010 , 30 , 769-774. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Atlas, E.; Papa, L.; Wade, MG; Kawata, A.; Boudreau, A.; Boucher, JG Bisfenol A aumenta a expressão de aP2 em 3T3L1, aumentando a atividade transcricional de receptores nucleares no promotor. Adipócito 2014 , 3 , 170-179. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Thomas, P.; Dong, J. Ligação e ativação do receptor de estrogênio de sete transmembrana GPR30 por estrogênios ambientais: Um novo mecanismo potencial de desregulação endócrina. J. Steroid Biochem. Mol. Biol. 2006 , 102 , 175-179. [ Google Scholar ] [ CrossRef ]
- Pereira-Fernandes, A.; Demaegdt, H.; Vandermeiren, K.; Hectors, TLM; Jorens, PG; Blust, R.; Vanparys, C. Avaliação de um Sistema de Triagem para Compostos Obesogênicos: Triagem de Compostos de Disrupção Endócrina e Avaliação da Dependência de PPAR do Efeito. PLoS ONE 2013 , 8 , e77481. [ Google Scholar ] [ CrossRef ]
- Somm, E.; Schwitzgebel, VM; Toulotte, A.; Cederroth, CR; Combescure, C.; Nef, S.; Aubert, ML; Hüppi, PS A exposição perinatal ao bisfenol A altera a adipogênese precoce no rato. Ambiente. Perspectiva da Saúde. 2009 , 117 , 1549-1555. [ Google Scholar ] [ CrossRef ]
- Vogel, SA A Política dos Plásticos: O Fazer e Desfazer do Bisfenol A “Segurança”. Sou. J. Saúde Pública 2009 , 99 , S559–S566. [ Google Scholar ] [ CrossRef ]
- Dodds, EC; Lawson, W. Agentes estrogênicos sintéticos sem o Núcleo Phenanthrene. Nature 1936 , 137 , 996. [ Google Scholar ] [ CrossRef ]
- Vandenberg, LN; Maffini, MV; Sonnenschein, C.; Rubin, BS; Soto, AM Bisfenol-A e a Grande Divisão: Uma Revisão de Controvérsias no Campo de Disrupção Endócrina. Endoc. Rev. 2009 , 30 , 75-95. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Nerín, C.; Fernández, C.; Domeño, C.; Salafranca, J. Determinação de Migrantes Potenciais em Recipientes de Policarbonato Utilizados para Fornos de Microondas por Cromatografia Líquida de Alto Desempenho com Detecção de Ultravioleta e Fluorescência. J. Agric. Química Alimentar. 2003 , 51 , 5647-5653. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Brede, C.; Fjeldal, P.; Skjevrak, I.; Herikstad, H. Aumento dos níveis de migração de bisfenol A de mamadeiras de policarbonato após a lavagem da louça, fervura e escovação. Aditivo Alimentar. Contam. 2003 , 20 , 684-689. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Konieczna, A.; Rutkowska, A.; Rachoń, D. Risco para a saúde da exposição ao Bisfenol A (BPA). Rocz. Panstw. Zakl. Alto. 2015 , 66 , 5-11. [ Google Acadêmico ]
- Lião, C.; Kannan, K. Concentrações e perfis de bisfenol A e outros análogos de bisfenol em alimentos dos Estados Unidos e suas implicações para a exposição humana. J. Agric. Química Alimentar. 2013 , 61 , 4655-4662. [ Google Scholar ] [ CrossRef ]
- Lião, C.; Kannan, K. Uma Pesquisa de Alquilfenóis, Bisfenóis e Triclosan em Produtos de Cuidados Pessoais da China e dos Estados Unidos. Arco. Ambiente. Contam. Toxicol. 2014 , 67 , 50-59. [ Google Scholar ] [ CrossRef ]
- Pivnenko, K.; Pedersen, GA; Eriksson, E.; Astrup, T. Bisfenol A e seus análogos estruturais em papel de lixo doméstico. Gestão de Resíduos. 2015 , 44 , 39-47. [ Google Scholar ] [ CrossRef ]
- Balakrishnan, B.; Henare, K.; Thorstensen, EB; Ponnampalam, AP; Mitchell, MD Transferência de bisfenol A através da placenta humana. Sou. J. Obstet. Gynecol. 2010 , 202 , 393.e1–393.e7. [ Google Scholar ] [ CrossRef ]
- Sun, Y.; Nakashima, MN; Takahashi, M.; Kuroda, N.; Nakashima, K. Determinação de bisfenol A em cérebro de rato por microdiálise e coluna de comutação de cromatografia líquida de alta eficiência com detecção de fluorescência. Biomédico. Cromatogr. 2002 , 16 , 319-326. [ Google Scholar ] [ CrossRef ]
- Nishikawa, M.; Iwano, H.; Yanagisawa, R.; Koike, N.; Inoue, H.; Yokota, H. Transferência Placentária de Bisfenol A Conjugado e Reativação Subsequente no Feto de Rato. Ambiente. Perspectiva da Saúde. 2010 , 118 , 1196-1203. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- LaKind, JS; Levesque, J.; Dumas, P.; Bryan, SN; Clarke, J.; Naiman, DQ Comparando as exposições da população dos Estados Unidos e do Canadá de Pesquisas Nacionais de Biomonitoramento: Ingestão de Bisfenol A como um estudo de caso. J. Expo. Sci. Ambiente. Epidemiol. 2012 , 22 , 219-226. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Eladak, S.; Grisin, T.; Moison, D.; Guerquin, M.-J.; N’Tumba-Byn, T.; Pozzi-Gaudin, S.; Benachi, A.; Livera, G.; Rouiller-Fabre, V.; Habert, R. Um novo capítulo na história do bisfenol A: Bisfenol S e bisfenol F não são alternativas seguras para este composto. Fértil. Esteril. 2015 , 103 , 11-21. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Hessel, EV; Ezendam, J.; van Broekhuizen, FA; Hakkert, B.; DeWitt, J.; Granum, B.; Guzylac, L.; Lawrence, BP; Penninks, A.; Rooney, AA; et ai. Avaliação de estudos recentes de imunotoxicidade do desenvolvimento com bisfenol A no contexto do t-TDI 2015 da EFSA. Reproduzir. Toxicol. 2016 , 65 , 448-456. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Negri-Cesi, P. Interação do Bisfenol A com o Desenvolvimento e Funções do Cérebro. Dose-Response 2015 , 13 , 1559325815590394. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Geens, T.; Roosens, L.; Neels, H.; Covaci, A. Avaliação da exposição humana ao Bisfenol-A, Triclosan e Tetrabromobisfenol-A através da ingestão de poeira interna na Bélgica. Quimiosfera 2009 , 76 , 755-760. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Corrales, J.; Kristofco, LA; Steele, WB; Yates, BS; Raça, CS; Williams, ES; Brooks, BW Avaliação Global do Bisfenol A no Meio Ambiente: Revisão e Análise de Sua Ocorrência e Bioacumulação. Dose-Response 2015 , 13 , 1559325815598308. [ Google Scholar ] [ CrossRef ]
- Nahar, MS; Lião, C.; Kannan, K.; Dolinoy, DC Concentrações de Bisfenol A no Fígado Fetal e Expressão Gênica de Biotransformação Revelam Exposição Variável e Capacidade Alterada de Metabolismo em Humanos. J. Biochem. Mol. Toxicol. 2012 , 27 , 116-123. [ Google Scholar ] [ CrossRef ]
- Vandenberg, LN Respostas de dose não monotônicas em estudos de produtos químicos desreguladores endócrinos: bisfenol a como estudo de caso. Dose-Resposta 2013 , 12 , 259-276. [ Google Scholar ] [ CrossRef ]
- Villar-Pazos, S.; Martinez-Pinna, J.; Castellano-Muñoz, M.; Madalena, PA; Marroqui, L.; Quesada, I.; Gustafsson, J.-A.; Nadal, A. Mecanismos moleculares envolvidos no efeito não monotônico do bisfenol-a na entrada de Ca 2+ em células β pancreáticas de camundongos. Sci. Rep. 2017 , 7 , 11700. [ Google Scholar ] [ CrossRef ]
- Nguyen, U.; Tinsley, B.; Sen, Y.; Stein, J.; Palácios, Y.; Ceballos, A.; Welch, C.; Nzenkue, K.; Penn, A.; Murphy, L.; et ai. A exposição ao bisfenol A afeta diferencialmente o neurodesenvolvimento e o comportamento em Drosophila melanogaster de origens genéticas distintas. Neuro Toxicol. 2020 , 82 , 146-157. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gore, AC Alvos neuroendócrinos de disruptores endócrinos. Hormônios 2010 , 9 , 16-27. [ Google Scholar ] [ CrossRef ]
- Casas, M.; Forns, J.; Martínez, D.; Avella-García, C.; Valvi, D.; Ballesteros-Gómez, A.; Luque, N.; Rubio, S.; Julvez, J.; Sunyer, J.; et ai. Exposição ao bisfenol A durante a gravidez e desenvolvimento neuropsicológico infantil na coorte INMA-Sabadell. Ambiente. Res. 2015 , 142 , 671-679. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lin, C.-C.; Chien, C.-J.; Tsai, M.-S.; Hsieh, C.-J.; Hsieh, W.-S.; Chen, P.‑C. Exposição pré-natal a compostos fenólicos e desenvolvimento neurocomportamental aos 2 e 7 anos de idade. Sci. Ambiente Total. 2017 , 605-606 , 801-810. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Jensen, TK; Mustieles, V.; Bless, D.; Frederiksen, H.; Trecca, F.; Schoeters, G.; Andersen, RH; Grandjean, P.; Kyhl, HB; Juul, A.; et ai. A exposição pré-natal ao bisfenol A está associada ao desenvolvimento da linguagem, mas não ao comportamento relacionado ao TDAH em crianças da Odense Child Cohort. Ambiente. Res. 2019 , 170 , 398-405. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Stacy, S.; Papandonatos, G.; Calafat, AM; Chen, A.; Yolton, K.; Lanphear, BP; Braun, JM Exposição ao bisfenol A no início da vida e neurocomportamento aos 8 anos de idade: Identificando janelas de vulnerabilidade aumentada. Ambiente. Int. 2017 , 107 , 258-265. [ Google Scholar ] [ CrossRef ]
- Pereira, F.; Nolte, ELR; Wang, Y.; Margolis, AE; Calafat, AM; Wang, S.; Garcia, W.; Hoepner, LA; Peterson, BS; Rauh, V.; et ai. Exposição ao bisfenol A e sintomas de ansiedade e depressão em crianças de 10 a 12 anos de idade. Ambiente. Res. 2016 , 151 , 195-202. [ Google Scholar ] [ CrossRef ]
- Stein, TP; Schluter, MD; Boi, RA; Guo, L.; Ming, X. Bisfenol A Exposição em Crianças com Transtornos do Espectro do Autismo. Autismo Res. 2015 , 8 , 272-283. [ Google Scholar ] [ CrossRef ]
- Rahbar, MH; Swingle, HM; Cristão, MA; Hessabi, M.; Lee, M.; Jarro, MR; Campbell, S.; Mitchell, A.; Krone, R.; Loveland, KA; et ai. Exposição Ambiental a Dioxinas, Dibenzofuranos, Bisfenol A e Ftalatos em Crianças com e sem Transtorno do Espectro Autista que vivem perto do Golfo do México. Int. J. Ambiente. Res. Saúde Pública 2017 , 14 , 1425. [ Google Scholar ] [ CrossRef ]
- Li, Y.; Zhang, H.; Kuang, H.; Fã, R.; Cha, C.; Li, G.; Luo, Z.; Pang, Q. Relação entre exposição ao bisfenol A e transtorno de déficit de atenção/hiperatividade: Um estudo de caso-controle para crianças do ensino fundamental em Guangzhou, China. Ambiente. Poluir. 2018 , 235 , 141-149. [ Google Scholar ] [ CrossRef ]
- Tewar, S.; Auinger, P.; Braun, JM; Lanphear, B.; Yolton, K.; Epstein, JN; Ehrlich, S.; Froehlich, TE Associação de Exposição ao Bisfenol A e Transtorno de Déficit de Atenção/Hiperatividade em uma amostra nacional de crianças dos EUA. Ambiente. Res. 2016 , 150 , 112-118. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Grohs, MN; a Equipe de Estudo AProN; Reynolds, JE; Liu, J.; Martin, J.; Pollock, T.; Lebel, C.; Dewey, D. Pré-natal materno e infantil bisfenol uma exposição e estrutura cerebral e comportamento de crianças pequenas. Ambiente. Saúde 2019 , 18 , 85. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Sol, D.; Zhou, X.; Yu, H.-L.; He, X.-X.; Guo, W.-X.; Xiong, W.-C.; Zhu, X.-J. Regulação da proliferação e diferenciação de células-tronco neurais pelo membro da família Kinesin 2a. PLoS ONE 2017 , 12 , e0179047. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Tiwari, SK; Agarwal, S.; Seth, B.; Yadav, A.; Ray, RS; Mishra, VN; Chaturvedi, RK Efeitos Inibitórios do Bisfenol-A na Proliferação e Diferenciação de Células-Tronco Neurais no Cérebro de Ratos São Dependentes da Via Wnt/β-Catenina. Mol. Neurobiol. 2015 , 52 , 1735-1757. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Urban, N.; Guillemot, F. Neurogênese no cérebro embrionário e adulto: mesmos reguladores, papéis diferentes. Frente. Célula. Neurociência. 2014 , 8 , 396. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Shohayeb, B.; Diab, M.; Ahmed, M.; Ng, DCH Fatores que influenciam a neurogênese adulta como terapia potencial. Trad. Neurodegeneração. 2018 , 7 , 4. [ Google Scholar ] [ CrossRef ]
- Ernst, C. Déficits de proliferação e diferenciação são um importante ponto de convergência para transtornos do neurodesenvolvimento. Tendências Neurociências. 2016 , 39 , 290-299. [ Google Scholar ] [ CrossRef ]
- Stevens, HE; Smith, KM; Rash, B.; Vaccarino, FM Regulação de células-tronco neurais, fatores de crescimento de fibroblastos e as origens do desenvolvimento de distúrbios neuropsiquiátricos. Frente. Neurociência. 2010 , 4 , 59. [ Google Scholar ] [ CrossRef ]
- Smith, I.; Nakashima, K. Mecanismos de Determinação do Destino de Células-Tronco Neurais: Sugestões Extracelulares e Programas Intracelulares. atual Res. Células-Tronco. Ter. 2006 , 1 , 267-277. [ Google Scholar ] [ CrossRef ]
- Kong, S.-Y.; Park, M.-H.; Lee, M.; Kim, J.-O.; Lee, H.-R.; Han, BW; Svendsen, CN; Sung, SH; Kim, H.-J. Kuwanon V inibe a proliferação, promove a sobrevivência celular e aumenta a neurogênese de células-tronco neurais. PLoS ONE 2015 , 10 , e0118188. [ Google Scholar ] [ CrossRef ]
- Longo, FM; Yang, T.; Xie, Y.; Massa, SM Abordagens de pequenas moléculas para a promoção da neurogênese. atual Alzheimer Res. 2006 , 3 , 5-10. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kim, H.-J.; Rosenfeld, MG Controle epigenético do destino de células-tronco para neurônios e glia. Arco. Res. Farmacêutica. 2010 , 33 , 1467-1473. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kim, H.-J.; Jin, células-tronco CY na triagem de drogas para doenças neurodegenerativas. Coreano J. Physiol. Pharmacol. 2012 , 16 , 1–9. [ Google Scholar ] [ CrossRef ]
- Yoon, HJ; Kong, S.-Y.; Park, M.-H.; Cho, Y.; Kim, S.-E.; Shin, J.-Y.; Jung, S.; Lee, J.; Farhanullah; Kim, H.-J.; et ai. Análogos de aminopropil carbazol como potenciadores potentes da neurogênese. Bioorganic Med. Química 2013 , 21 , 7165-7174. [ Google Scholar ] [ CrossRef ]
- Kim, HJ; Leeds, P.; Chuang, D.-M. O inibidor de HDAC, butirato de sódio, estimula a neurogênese no cérebro isquêmico. J. Neurochem. 2009 , 110 , 1226-1240. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Saxe, JP; Wu, H.; Kelly, TK; Phelps, ME; Sol, YE; Kornblum, HI; Huang, J. Uma tela fenotípica de pequenas moléculas identifica um par ligante-receptor órfão que regula a diferenciação de células-tronco neurais. Química Biol. 2007 , 14 , 1019-1030. [ Google Scholar ] [ CrossRef ]
- Kinch, CD; Ibhazehiebo, K.; Jeong, J.-H.; Habibi, RH; Kurrasch, DM A exposição a baixas doses de bisfenol A e reposição de bisfenol S induz neurogênese hipotalâmica precoce em zebrafish embrionário. Proc. Nacional Acad. Sci. EUA 2015 , 112 , 1475-1480. [ Google Scholar ] [ CrossRef ]
- Brânquias.; Kumara, V. Efeitos comparativos do neurodesenvolvimento do bisfenol A e do bisfenol F em modelos de células-tronco neurais fetais de ratos. Células 2021 , 10 , 793. [ Google Scholar ] [ CrossRef ]
- Cho, J.-H.; Kim, AH; Lee, S.; Lee, Y.; Lee, WJ; Chang, S.-C.; Lee, J. Avaliação de neurotoxicidade sensível de bisfenol A usando imunocitoquímica dupla de DCX e MAP2. Arco. Res. Farmacêutica. 2018 , 41 , 1098-1107. [ Google Scholar ] [ CrossRef ]
- Huang, M.; Li, Y.; Wu, K.; Hao, S.; Cai, Q.; Zhou, Z.; Yang, H. Efeitos de produtos químicos ambientais na proliferação e diferenciação de células-tronco neurais. Ambiente. Toxicol. 2019 , 34 , 1285-1291. [ Google Scholar ] [ CrossRef ]
- Agarwal, S.; Yadav, A.; Tiwari, SK; Seth, B.; Chauhan, LKS; Khare, P.; Ray, RS; Chaturvedi, RK A inibição da proteína 1 relacionada à dinamina atenua as alterações mediadas pelo bisfenol A na dinâmica mitocondrial e na proliferação e diferenciação de células-tronco neurais. J. Biol. Química 2016 , 291 , 15923-15939. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kim, K.; Filho, TG; Kim, SJ; Kim, HS; Kim, TS; Han, SY; Lee, J. Efeitos supressivos do bisfenol A na proliferação de células progenitoras neurais. J. Toxicol. Ambiente. Saúde Parte A 2007 , 70 , 1288–1295. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dong, P.; Sim, G.; Tu, X.; Luo, Y.; Cui, W.; Posso.; Wei, L.; Tian, X.; Wang, Q. Papéis da sinalização de ERRα e TGF-β no aprimoramento de stemness induzido por exposição a 1 µM de bisfenol A via células-tronco neurais humanas. Exp. Ter. Med. 2021 , 23 , 164. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Fujiwara, Y.; Miyazaki, W.; Koibuchi, N.; Katoh, T. Os Efeitos de Baixa Dose de Bisfenol A e Bisfenol F na Diferenciação Neural de uma Linha Celular Progenitora Neural Derivada do Cérebro Fetal. Frente. Endocrinol. 2018 , 9 , 24. [ Google Scholar ] [ CrossRef ]
- Azari, H.; Reynolds, BA Modelos In Vitro para Neurogênese. Porto da Primavera Fria. Perspectiva. Biol. 2015 , 8 , a021279. [ Google Scholar ] [ CrossRef ]
- Santoro, A.; Escafuro, M.; Troisi, J.; Piegari, G.; Di Pietro, P.; Mele, E.; Cappetta, D.; Marinho, M.; De Angelis, A.; Vecchione, C.; et ai. Alterações multissistêmicas por exposição crônica a uma dose baixa de bisfenol A na água potável: efeitos na inflamação e na desacetilase dependente de NAD + Sirtuína1 em ratas lactantes e desmamadas. Int. J. Mol. Sci. 2021 , 22 , 9666. [ Google Scholar ] [ CrossRef ]
- Mulligan, KA; Cheyette, BN Neurodevelopmental Perspectives on Wnt Signaling in Psychiatry. Mol. Neuropsiquiatria 2016 , 2 , 219-246. [ Google Scholar ] [ CrossRef ]
- Mulligan, KA; Cheyette, BNR Wnt Sinalização no Desenvolvimento e Função Neural de Vertebrados. J. Neuroimmune Pharmacol. 2012 , 7 , 774-787. [ Google Scholar ] [ CrossRef ]
- Hirabayashi, Y.; Gotoh, Y. Controle epigenético do destino da célula precursora neural durante o desenvolvimento. Nat. Rev. Neurosci. 2010 , 11 , 377-388. [ Google Scholar ] [ CrossRef ]
- Batool, S.; Raza, H.; Zaidi, J.; Riaz, S.; Hasan, S.; Syed, NI Formação de sinapses: de mecanismos celulares e moleculares a distúrbios neurodesenvolvimentais e neurodegenerativos. J. Neurofisiol. 2019 , 121 , 1381-1397. [ Google Scholar ] [ CrossRef ]
- Poggio, T. Uma teoria de como o cérebro pode funcionar. Porto da Primavera Fria. Sintoma Quant. Biol. 1990 , 55 , 899-910. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Taverna, E.; Götz, M.; Huttner, WB A Biologia Celular da Neurogênese: Rumo a uma Compreensão do Desenvolvimento e Evolução do Neocórtex. Anu. Rev. Cell Dev. Biol. 2014 , 30 , 465-502. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Morrice, JR; Gregory-Evans, CY; Shaw, CA Modelando a degeneração do neurônio motor induzida pelo meio ambiente em peixe-zebra. Sci. Rep. 2018 , 8 , 4890. [ Google Scholar ] [ CrossRef ]
- Wang, X.; Dong, Q.; Chen, Y.; Jiang, H.; Xiao, Q.; Wang, Y.; Li, W.; Bai, C.; Huang, C.; Yang, D. Bisfenol A afeta o crescimento axonal, musculatura e comportamento motor no desenvolvimento do peixe-zebra. Água. Toxicol. 2013 , 142-143 , 104-113. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Welch, C.; Johnson, E.; Tupikova, A.; Anderson, J.; Tinsley, B.; Newman, J.; Widman, E.; Alfareh, A.; Davis, A.; Rodrigues, L.; et ai. O bisfenol A afeta a expressão gênica do neurodesenvolvimento, a função cognitiva e a morfologia sináptica neuromuscular em Drosophila melanogaster . Neurotoxicologia 2022 , 89 , 67-78. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Liang, X.; Yin, N.; Liang, S.; Yang, R.; Liu, S.; Lu, Y.; Jiang, L.; Zhou, Q.; Jiang, G.; Faiola, F. Bisfenol A e vários derivados exercem toxicidade neural em células semelhantes a neurônios humanos, diminuindo o comprimento de neuritos. Química Alimentar. Toxicol. 2020 , 135 , 111015. [ Google Scholar ] [ CrossRef ]
- Xu, X.; Lu, Y.; Zhang, G.; Chen, L.; Tian, D.; Shen, X.; Yang, Y.; Dong, F. Bisfenol A promove a morfogênese dendrítica de neurônios do hipocampo através da via de sinal ERK1/2 mediada por receptor de estrogênio. Quimiosfera 2014 , 96 , 129-137. [ Google Scholar ] [ CrossRef ]
- Xu, X.; Xie, L.; Hong, X.; Ruan, Q.; Lu, H.; Zhang, Q.; Zhang, G.; Liu, X. A exposição perinatal ao bisfenol-A inibe a sinaptogênese e afeta o desenvolvimento morfológico sináptico em camundongos machos descendentes. Quimiosfera 2013 , 91 , 1073-1081. [ Google Scholar ] [ CrossRef ]
- Yin, Z.; Hua, L.; Chen, L.; Hu, D.; Li, J.; An, Z.; Tian, T.; Ning, H.; Ge, Y. Neurotoxicidade induzida pela exposição ao bisfenol-A e associada à sinapse e citoesqueleto em células Neuro-2a. Toxicol. Vitr. 2020 , 67 , 104911. [ Google Scholar ] [ CrossRef ]
- Van Battum, EY; Brignani, S.; Pasterkamp, RJ Proteínas de orientação axônica em distúrbios neurológicos. Lancet Neurol. 2015 , 14 , 532-546. [ Google Scholar ] [ CrossRef ]
- McFadden, K.; Minshew, NJ Evidência para desregulação do crescimento axonal e orientação na etiologia do TEA. Frente. Zumbir. Neurociência. 2013 , 7 , 671. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Cruz, PMR; Cossins, J.; Beeson, D.; Vincent, A. A junção neuromuscular na saúde e na doença: Mecanismos moleculares que governam a formação sináptica e a homeostase. Frente. Mol. Neurociência. 2020 , 13 , 610964. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zoghbi, HY; Bear, MF Disfunção Sináptica em Transtornos do Neurodesenvolvimento Associados ao Autismo e Deficiência Intelectual. Porto da Primavera Fria. Perspectiva. Biol. 2012 , 4 , a009886. [ Google Scholar ] [ CrossRef ]
- Washbourne, P. Synapse Assembly e Neurodevelopmental Disorders. Neuropsicofarmacologia 2014 , 40 , 4–15. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bourgeron, T. Da arquitetura genética à plasticidade sináptica no transtorno do espectro do autismo. Nat. Rev. Neurosci. 2015 , 16 , 551-563. [ Google Scholar ] [ CrossRef ]
- Stuchlik, A. Aprendizagem dinâmica e memória, plasticidade sináptica e neurogênese: Uma atualização. Frente. Comportamento Neurociência. 2014 , 8 , 106. [ Google Scholar ] [ CrossRef ]
- Davidson, RJ; McEwen, BS Influências sociais na neuroplasticidade: Estresse e intervenções para promover o bem-estar. Nat. Neurociência. 2012 , 15 , 689-695. [ Google Scholar ] [ CrossRef ]
- Segal, M. Espinhas dendríticas: Blocos de construção morfológicos da memória. Neurobiol. Aprender. Memória 2017 , 138 , 3-9. [ Google Scholar ] [ CrossRef ]
- Hasegawa, S.; Sakuragi, S.; Tominaga-Yoshino, K.; Ogura, A. Dinâmica da coluna dendrítica levando à eliminação da coluna após repetidas induções de LTD. Sci. Rep. 2015 , 5 , 7707. [ Google Scholar ] [ CrossRef ]
- Kawato, S.; Ogiue-Ikeda, M.; Soma, M.; Yoshino, H.; Kominami, T.; Saito, M.; Ao, S.; Hojo, Y. A exposição perinatal de bisfenol A afeta diferentemente as espinhas dendríticas de neurônios do hipocampo adulto masculino e feminino. Frente. Neurociência. 2021 , 15 , 712261. [ Google Scholar ] [ CrossRef ]
- Liu, Z.-H.; Ding, J.-J.; Yang, Q.-Q.; Song, H.-Z.; Chen, X.-T.; Xu, Y.; Xiao, G.; Wang, H.‑L. A exposição precoce ao bisfenol-A no desenvolvimento independentemente do sexo prejudica a memória espacial ao remodelar a arquitetura dendrítica do hipocampo e a transmissão sináptica em ratos. Sci. Rep. 2016 , 6 , 32492. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Hu, F.; Zhang, L.; Aceso.; Wang, H.; Liang, W.; Zhou, Y. A exposição ao bisfenol-A durante a gestação e lactação causa déficits de percepção visual em filhotes de ratos após uma diminuição na expressão de interleucina 1β no córtex visual primário. Neurociência 2020 , 434 , 148-160. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhou, R.; Bai, Y.; Yang, R.; Zhu, Y.; Chi, X.; Li, L.; Chen, L.; Sokabe, M.; Chen, L. A plasticidade sináptica anormal na amígdala basolateral pode ser responsável por hiperatividade e déficit de atenção em ratos machos expostos perinatalmente a baixas doses de bisfenol-A. Neurofarmacologia 2011 , 60 , 789-798. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhou, R.; Zhang, Z.; Zhu, Y.; Chen, L.; Sokabe, M. Déficits no desenvolvimento da plasticidade sináptica no estriado dorsal do rato após exposição pré-natal e neonatal a baixas doses de bisfenol A. Neuroscience 2009 , 159 , 161–171. [ Google Scholar ] [ CrossRef ]
- Wu, D.; Wu, F.; Lin, R.; Meng, Y.; Wei, W.; Sol, Q.; Jia, L. O comprometimento da aprendizagem e da memória induzida pela exposição perinatal ao BPA está associado a alterações mediadas por ERα de plasticidade sináptica e via de sinalização PKC/ERK/CREB em ratos descendentes. Res. Cérebro. Touro. 2020 , 161 , 43-54. [ Google Scholar ] [ CrossRef ]
- Wang, C.; Niu, R.; Zhu, Y.; Han, H.; Luo, G.; Zhou, B.; Wang, J. Alterações na memória e plasticidade sináptica induzidas em ratos machos após exposição materna ao bisfenol A. Toxicology 2014 , 322 , 51-60. [ Google Scholar ] [ CrossRef ]
- Elsworth, JD; Jentsch, JD; Vande Voort, CA; Roth, RH, Jr. A exposição pré-natal ao bisfenol A afeta os neurônios dopaminérgicos do mesencéfalo e as sinapses da coluna do hipocampo em primatas não humanos. Neuro Toxicol. 2013 , 35 , 113-120. [ Google Scholar ] [ CrossRef ]
- Kimura, E.; Matsuyoshi, C.; Miyazaki, W.; Benner, S.; Hosokawa, M.; Yokoyama, K.; Kakeyama, M.; Tohyama, C. A exposição pré-natal ao bisfenol A afeta a morfologia neuronal na região CA1 do hipocampo em camundongos em desenvolvimento e idosos. Arco. Toxicologia 2016 , 90 , 691-700. [ Google Scholar ] [ CrossRef ]
- Kumar, D.; Thakur, M. Ansiedade como comportamento devido à exposição perinatal ao Bisfenol-A está associado com diminuição na densidade sináptica excitatória para inibitória do cérebro de camundongo macho. Toxicologia 2017 , 378 , 107-113. [ Google Scholar ] [ CrossRef ]
- Xu, X.-H.; Zhang, J.; Wang, Y.-M.; Ye, Y.-P.; Luo, Q.-Q. A exposição perinatal ao bisfenol-A prejudica a memória de aprendizagem pela regulação negativa concomitante dos receptores N-metil-d-aspartato do hipocampo em camundongos descendentes do sexo masculino. Horm. Comportamento 2010 , 58 , 326-333. [ Google Scholar ] [ CrossRef ]
- Schneider, H.; Pitossi, F.; Balschun, D.; Wagner, A.; del Rey, A.; Besedovsky, HO Um papel neuromodulador da interleucina-1 no hipocampo. Proc. Nacional Acad. Sci. EUA 1998 , 95 , 7778-7783. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Eisinger, R.; Urdaneta, M.; Foote, K.; Okun, MS; Gunduz, A. Caracterização não motora dos gânglios basais: evidências da eletrofisiologia de primatas humanos e não humanos. Frente. Neurociência. 2018 , 12 , 385. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Leranth, C.; Hajszan, T.; Szigeti-Buck, K.; Bober, J.; MacLusky, N. Bisfenol A previne a resposta sinaptogênica ao estradiol no hipocampo e córtex pré-frontal de primatas não humanos ovariectomizados. Proc. Nacional Acad. Sci. EUA 2008 , 105 , 14187-14191. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Elsworth, JD; Jentsch, JD; Groman, SM; Roth, RH, Jr.; Leranth, C. Baixos níveis circulantes de bisfenol-A induzem déficits cognitivos e perda de sinapses espinhais assimétricas no córtex pré-frontal dorsolateral e hipocampo de macacos machos adultos. J. Comp. Neurol. 2015 , 523 , 1248-1257. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Leranth, C.; Szigeti-Buck, K.; MacLusky, N.; Hajszan, T. Bisfenol A previne a resposta sinaptogênica à testosterona no cérebro de ratos machos adultos. Endocrinologia 2007 , 149 , 988-994. [ Google Scholar ] [ CrossRef ]
- Eilam-Stock, T.; Serrano, P.; Frankfurt, M.; Luine, V. Bisfenol-A prejudica a memória e reduz a densidade da coluna dendrítica em ratos machos adultos. Comportamento Neurociência. 2012 , 126 , 175-185. [ Google Scholar ] [ CrossRef ]
- Inagaki, T.; Frankfurt, M.; Luine, V. Aprimoramentos de memória induzidos por estrogênio são bloqueados pelo bisfenol A agudo em ratos fêmeas adultas: papel das espinhas dendríticas. Endocrinologia 2012 , 153 , 3357-3367. [ Google Scholar ] [ CrossRef ]
- Bowman, RE; Hagedorn, J.; Madden, E.; Frankfurt, M. Efeitos da exposição adolescente ao Bisfenol-A na memória e densidade da coluna vertebral em ratas ovariectomizadas: Adolescência vs. idade adulta. Horm. Comportamento 2019 , 107 , 26-34. [ Google Scholar ] [ CrossRef ]
- Huarui, G.; Aceso.; Gong, H.; Chen, Z.; Jin, Y.; Xu, G.; Wang, M. O bisfenol A prejudica a plasticidade sináptica por mecanismos pré e pós-sinápticos. Av. Sci. 2017 , 4 , 1600493. [ Google Scholar ] [ CrossRef ]
- Lee, CY; Hyun, S.-A.; Ko, MEU; Kim, RH; Rho, J.; Kim, KK; Kim, W.-Y.; Ka, M. Maternal Bisfenol A (BPA) A exposição altera a morfogênese cortical cerebral e função sináptica em camundongos. Cérebro Cortex 2021 , 31 , 5598-5612. [ Google Scholar ] [ CrossRef ]
- Aldridge, JE; Gibbons, JA; Flaherty, MM; Kreider, ML; Romano, JA; Levin, ED Heterogeneidade da resposta tóxica: fontes de variabilidade humana. Toxicol. Sci. 2003 , 76 , 3-20. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Musachio, EAS; Couto, SDF; Poetini, MR; Bortolotto, VC; Dahleh, MMM; Janner, DE; Araújo, SM; Ramborger, BP; Rohers, R.; Guerra, GP; et ai. Exposição ao bisfenol A durante o período embrionário: insights sobre a relação da dopamina e distúrbios comportamentais em Drosophila melanogaster . Química Alimentar. Toxicol. 2021 , 157 , 112526. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kaur, K.; Simon, A.; Chauhan, V.; Chauhan, A. Efeito do bisfenol A no comportamento de Drosophila melanogaster —Um novo modelo para os estudos sobre distúrbios do neurodesenvolvimento. Comportamento Res. Cérebro. 2015 , 284 , 77-84. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Olsvik, PA; O que mais, P.; Penglase, SJ; Skjærven, KH; D’Auriac, MA; Ellingsen, S. Associações entre os efeitos comportamentais do bisfenol A e metilação do DNA em embriões de peixe-zebra. Frente. Genet. 2019 , 10 , 184. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Saili, KS; Corvi, MM; Weber, DN; Patel, UA; Das, SR; Przybyla, J.; Anderson, KA; Tanguay, RL A exposição ao bisfenol A de baixa dose de neurodesenvolvimento leva a hiperatividade no estágio inicial da vida e déficits de aprendizado em peixes-zebra adultos. Toxicologia 2012 , 291 , 83-92. [ Google Scholar ] [ CrossRef ]
- Anderson, OS; Peterson, KE; Sanchez, BN; Zhang, Z.; Mancuso, P.; Dolinoy, DC A exposição perinatal ao bisfenol A promove hiperatividade, composição corporal magra e respostas hormonais ao longo da vida murina. FASEB J. 2013 , 27 , 1784-1792. [ Google Scholar ] [ CrossRef ]
- Plessen, KJ; Bansal, R.; Zhu, H.; Whiteman, R.; Amat, J.; Quackenbush, GA; Martin, L.; Durkin, K.; Blair, C.; Real, J.; et ai. Morfologia do hipocampo e da amígdala no transtorno de déficit de atenção/hiperatividade. Arco. Gen. Psiquiatria 2006 , 63 , 795-807. [ Google Scholar ] [ CrossRef ]
- Zhou, N.; Yang, J.; Li, H.; Lu, Q.; Liu, Y.-D.; Lin, K.-F. Avaliação ecotoxicológica da exposição ao bisfenol A de baixa concentração no nematoide do solo Caenorhabditis elegans e mecanismos intrínsecos de resposta ao estresse in vivo. Ambiente. Toxicol. Química 2016 , 35 , 2041-2047. [ Google Scholar ] [ CrossRef ]
- Jang, YJ; Parque, RH; Kim, TH; Yang, W.-J.; Lee, J.-J.; Choi, SY; Ah, SB; Lee, E.; Park, J.-H.; Kim, H.-P.; et ai. Altas doses de bisfenol A prejudicam a neurogênese hipocampal em camundongos fêmeas ao longo das gerações. Toxicologia 2012 , 296 , 73-82. [ Google Scholar ] [ CrossRef ]
- Jašarević, E.; Williams, SA; Vandas, GM; Ellersieck, MR; Lião, C.; Kannan, K.; Roberts, RM; Geary, DC; Rosenfeld, CS Sexo e efeitos dependentes da dose da exposição ao bisfenol A no desenvolvimento da ansiedade e aprendizagem espacial em filhotes de camundongos cervos ( Peromyscus maniculatus bairdii ). Horm. Comportamento 2012 , 63 , 180-189. [ Google Scholar ] [ CrossRef ]
- Johnson, SA; Javurek, AB; Pintor, MS; Ellersieck, MR; Galês, TH; Camacho, L.; Lewis, SM; Vanlandingham, MM; Ferguson, S.; Rosenfeld, CS Efeitos da exposição de desenvolvimento ao bisfenol A na aprendizagem de navegação espacial e memória em ratos: Um estudo CLARITY-BPA. Horm. Comportamento 2016 , 80 , 139-148. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Xu, X.-B.; Ei.; Canção, C.; Ke, X.; Fan, S.-J.; Peng, W.-J.; Tan, R.; Kawata, M.; Matsuda, K.-I.; Pan, B.-X.; et ai. O bisfenol a regula a sinalização alfa do receptor de estrogênio no desenvolvimento do hipocampo de ratos machos através do receptor de estrogênio. Hipocampo 2014 , 24 , 1570-1580. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Poimenova, A.; Markaki, E.; Rahiotis, C.; Kitraki, E. Ações reguladas por corticosterona no cérebro de ratos são afetadas pela exposição perinatal a baixa dose de bisfenol A. Neuroscience 2010 , 167 , 741-749. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Tian, Y.-H.; Baek, J.-H.; Lee, S.-Y.; Jang, C.-G. A exposição pré-natal e pós-natal ao bisfenol a induz comportamentos ansiolíticos e déficits cognitivos em camundongos. Synapse 2010 , 64 , 432-439. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Wang, C.; Li, Z.; Han, H.; Luo, G.; Zhou, B.; Wang, S.; Wang, J. O comprometimento da memória de reconhecimento de objetos pela exposição materna ao bisfenol A está associado à inibição da via Akt e ERK/CREB/BDNF no hipocampo da prole masculina. Toxicologia 2016 , 341-343 , 56-64. [ Google Scholar ] [ CrossRef ]
- Hass, U.; Christiansen, S.; Boberg, J.; Rasmussen, MG; Mandrup, K.; Axelstad, M. Efeito de baixa dose da exposição ao bisfenol A no desenvolvimento da contagem de espermatozóides e comportamento em ratos. Andrologia 2016 , 4 , 594-607. [ Google Scholar ] [ CrossRef ]
- Matsuda, S.; Matsuzawa, D.; Ishii, D.; Tomizawa, H.; Sajiki, J.; Shimizu, E. A exposição perinatal ao bisfenol A aumenta a memória contextual do medo e afeta o sistema serotoninérgico em camundongos fêmeas juvenis. Horm. Comportamento 2013 , 63 , 709-716. [ Google Scholar ] [ CrossRef ]
- Nakamura, K.; Itoh, K.; Dai, H.; Han, L.; Wang, X.; Kato, S.; Sugimoto, T.; Fushiki, S. A exposição pré-natal e lactacional a baixas doses de bisfenol A altera o comportamento de camundongos adultos. Cérebro Dev. 2012 , 34 , 57-63. [ Google Scholar ] [ CrossRef ]
- Toco, DG; Beck, MJ; Radovsky, A.; Garman, RH; Água doce, LL; Folhas, LP; Marty, MS; Waechter, JM; Dimond, SS; Van Miller, JP; et ai. Estudo de neurotoxicidade do desenvolvimento do bisfenol A dietético em ratos Sprague-Dawley. Toxicol. Sci. 2010 , 115 , 167-182. [ Google Scholar ] [ CrossRef ]
- Fujimoto, T.; Kubo, K.; Aou, S. A exposição pré-natal ao bisfenol A prejudica a diferenciação sexual do comportamento exploratório e aumenta o comportamento semelhante à depressão em ratos. Res. Cérebro. 2006 , 1068 , 49-55. [ Google Scholar ] [ CrossRef ]
- Cox, KH; Gatewood, JD; Howeth, C.; Rissman, EF A exposição gestacional ao bisfenol A e a adoção cruzada afetam os comportamentos em camundongos juvenis. Horm. Comportamento 2010 , 58 , 754-761. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gao, R. Mecanismos Comuns de Desequilíbrio Excitatório e Inibitório na Esquizofrenia e Transtornos do Espectro do Autismo. atual Mol. Med. 2015 , 15 , 146-167. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Selten, M.; Van Bokhoven, H.; Kasri, NN Controle inibitório do equilíbrio excitatório/inibitório em transtornos psiquiátricos. F1000Research 2018 , 7 , 23. [ Google Scholar ] [ CrossRef ]
- Mamiya, P.; Arnett, A.; Stein, M. Cuidados de Medicina de Precisão em TDAH: O Caso de Excitação e Inibição Neural. Ciência do Cérebro. 2021 , 11 , 91. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mhaouty-Kodja, S.; Belzunces, LP; Canivenc, M.-C.; Schroeder, H.; Chevrier, C.; Pasquier, E. Prejuízo do desempenho de aprendizagem e memória induzido por BPA: Evidências da literatura de um MoA mediado por um ED. Mol. Célula. Endocrinol. 2018 , 475 , 54-73. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Programa de Pesquisa CLARITY-BPA. NTP Research Report on the Consortium Linking Academic and Regulatory Insights on Bisphenol A Toxicity (CLARITY-BPA): A Compendium of Published Findings: Research Report 18. 2021. Disponível online: https://pubmed.ncbi.nlm.nih.gov/ 34910417/ (acessado em 4 de março de 2022).
- Rebolledo-Solleiro, D.; Flores, LYC; Solleiro-Villavicencio, H. Impacto do BPA no comportamento, neurodesenvolvimento e neurodegeneração Daniela. Frente. Biosci. 2021 , 26 , 363-400. [ Google Scholar ] [ CrossRef ]
- Bakoyiannis, I.; Kitraki, E.; Stamatakis, A. Substâncias químicas e comportamento desreguladores endócrinos: Um alto risco a se assumir? Melhor Pr. Res. Clin. Endocrinol. Metab. 2021 , 35 , 101517. [ Google Scholar ] [ CrossRef ]
- Nesan, D.; Kurrasch, DM Exposição gestacional a substâncias químicas endócrinas comuns e seu impacto no neurodesenvolvimento e no comportamento. Anu. Rev. Fisiol. 2020 , 82 , 177-202. [ Google Scholar ] [ CrossRef ]
- Xin, F.; Fischer, E.; Krapp, C.; Krizman, EN; Lan, Y.; Mesaros, C.; Snyder, NW; Bansal, A.; Robinson, MB; Simmons, RA; et ai. Camundongos expostos ao bisfenol A exibem comportamento do tipo depressivo com neurotransmissor e disfunção esteróide neuroativa. Horm. Comportamento 2018 , 102 , 93-104. [ Google Scholar ] [ CrossRef ]
- Santoro, A.; Chianese, R.; Troisi, J.; Richards, S.; Nori, SL; Fasano, S.; Guida, M.; Plunk, E.; Viggiano, A.; Pierantoni, R.; et ai. Efeitos neurotóxicos e reprodutivos do BPA. atual Neurofarmacol. 2019 , 17 , 1109-1132. [ Google Scholar ] [ CrossRef ]
Tradução livre, parcial, de Luiz Jacques Saldanha, abril de 2022.


