
Ana Soto
https://pmc.ncbi.nlm.nih.gov/articles/PMC9662687/
Ana M Soto 1, Cheryl M Schaeberle 1, Carlos Sonnenschein 1
29 jan 2021
1 Departamento de Imunologia, Universidade Tufts, Faculdade de Medicina, Boston, MA, EUA.
E-mail: [email protected]
De Wingspread aos dias de hoje: uma trajetória pessoa
(Publicação da Nat Rev Endocrinol. 2021 Jan 29;17(4):247–256. doi: 10.1038/s41574-020-00460-3)
[NOTA DO WEBSITE: Pesquisadora pioneira, juntamente com a Dra. Theo Colborn, na descoberta e no desvelar dos disruptores endócrinos. Esse material nos traz uma visão histórica, mostrando como há quantos anos, toda essa ciência está aí, à disposição de toda a sociedade planetária. Infelizmente, a maioria dos cientistas de todo o planeta, até hoje, ainda não absorveram toda essa bagagem que está completa e totalmente aberta para todos. Até quando viveremos sofrendo toda essa agressão que vai muito além de nós, os nascidos, e que vem inviabilizando uma vida saudável para todos nascidos nestes mais de 30 anos e destacamos, os que ainda nem nasceram?].
Resumo
Nas três décadas desde que a disrupção endócrina foi conceituada na Wingspread Conference, testemunhamos o crescimento desse campo multidisciplinar e o acúmulo de evidências mostrando os efeitos deletérios à saúde de produtos químicos disruptores endócrinos. Foi somente na última década que, embora lentamente, algumas mudanças em relação às medidas regulatórias ocorreram. Nesta Perspectiva, abordamos alguns pontos históricos sobre o advento do campo da disrupção endócrina e as mudanças conceituais que a disrupção endócrina trouxe. Também fornecemos nossa lembrança pessoal dos eventos desencadeados por nossa descoberta fortuita da atividade estrogênica no plástico, um evento fundador no campo da disrupção endócrina. Essa lembrança termina com o estudo CLARITY/Consortium Linking Academic and Regulatory Insights on Bisphenol A Toxicity como um exemplo de discordância entre ‘ciência por si só’ e ‘ciência regulatória’ e nos leva a oferecer uma perspectiva que poderia ser resumida pelo lema atribuído a Ludwig Boltzmann: “Nada é mais prático do que uma boa teoria”.
O conceito dos disruptores endócrinos foi introduzido em 1991 na Conferência Wingspread intitulada “Alterações induzidas quimicamente no desenvolvimento sexual: a conexão vida selvagem/humana”. Uma quantidade esmagadora de evidências mostrando os efeitos deletérios à saúde de produtos químicos disruptores endócrinos foi reunida. Cada vez mais, artigos de opinião estão sendo publicados conectando o conhecimento científico sobre produtos químicos desreguladores endócrinos e sua aplicação à política de saúde pública, e em alguns países algumas ações regulatórias foram implementadas. Nesta Perspectiva, abordamos a lacuna entre o conhecimento científico e sua aplicação à política de saúde pública e ambiental a partir de uma perspectiva histórica pessoal derivada de nossa descoberta fortuita da atividade estrogênica no plástico que levou à nossa participação no evento fundamental do campo da desregulação endócrina, a Conferência Wingspread. O estudo CLARITY também é discutido.
De Rachel Carson a Theo Colborn
A publicação do livro de Rachel Carson, Silent Spring , em 1962, é considerada um momento decisivo em relação à conscientização das consequências deletérias das ações humanas no ecossistema. Seu livro examinou as consequências do uso generalizado de agrotóxicos e desencadeou o desenvolvimento do ativismo ambiental e a criação da Agência de Proteção Ambiental (EPA) nos EUA. Carson assumiu que o câncer é um resultado direto da exposição a agrotóxicos, mas considerou que também pode surgir indiretamente por meio de alterações hepáticas que resultam em níveis aumentados de estrogênio. Em 1979, quase duas décadas após o trabalho pioneiro de Carson, John McLachlan, então no Instituto Nacional de Ciências da Saúde Ambiental dos EUA (NIEHS), organizou a primeira de uma série de conferências intitulada “Estrogênios no Meio Ambiente” no Research Triangle Park, NC, EUA. Nesta conferência, problemas emergentes causados por vários poluentes ambientais (como agrotóxicos com atividade estrogênica), o uso generalizado de anticoncepcionais orais e a descoberta da síndrome do dietilestilbestrol/DES foram amplamente discutidos 1 .
Na década que se seguiu a esta conferência, Theo Colborn e seus colaboradores conduziram uma pesquisa sobre o estado do meio ambiente na área dos Grandes Lagos. Eles observaram que animais jovens exibiam alterações que eventualmente causavam morte prematura ou desenvolvimento anormal. Essas alterações incluíam mudanças metabólicas que se manifestavam como “emagrecimento”. Animais afetados pelo emagrecimento ficavam letárgicos, perdiam o apetite, experimentavam perda de peso e morriam prematuramente. Danos a órgãos, que são mais sutis do que o emagrecimento, também ocorriam. Por exemplo, Colborn e seus colegas observaram problemas de tireoide e coração, porfiria, metabolismo anormal de ferro, níveis reduzidos de vitamina A em tecidos críticos, pássaros machos desenvolvendo tecido ovariano, pássaros fêmeas desenvolvendo tecido oviductal excessivo, peixes machos não atingindo a maturidade sexual completa e peixes exibindo hermafroditismo. Defeitos congênitos e mudanças comportamentais também foram observados pela equipe 2 . Colborn se perguntou se esses efeitos devastadores à saúde eram consequência da redução dos níveis de produtos químicos estrogênicos, como DDT (diclorodifeniltricloroetano) e PCBs (bifenilos policlorados), após a introdução de regulamentações pela EPA na década de 1970. Essa observação sugeriu que a ação residual dos produtos químicos proibidos só se tornou aparente quando os efeitos iniciais de seu uso generalizado na mortalidade se dissiparam após vários anos de seu uso sendo regulamentado. Se de fato esse fosse o caso, não havia mais nada a fazer a não ser esperar por uma redução ainda maior desses níveis. Em vez disso, um acidente em nosso laboratório naquela época revelou que havia xenoestrogênios no ambiente que ainda não eram regulamentados 3 .
Estrogênios ‘não regulamentados’
Para fornecer contexto, um breve relato histórico será útil. Enquanto trabalhávamos na regulação do estrogênio da proliferação celular em células epiteliais mamárias MCF7, concluímos que o estrogênio não estava estimulando a proliferação celular nessas células. Em vez disso, o protagonista desse fenômeno era um inibidor presente no soro humano que afetava essas células-alvo de estrogênio 4; os estrogênios afetavam a proliferação celular neutralizando esse inibidor em vez de afetar diretamente a proliferação celular. Esses resultados nos inspiraram a postular que todas as células, tanto em organismos unicelulares quanto multicelulares, proliferam e se movem constitutivamente quando na presença de quantidades adequadas de nutrientes 5 – 7. Com base nesse princípio, a partir de 1986, procedemos à purificação do inibidor transmitido pelo sangue 4.
Durante esse processo de purificação, as frações estavam sendo testadas tanto na presença quanto na ausência de estrogênio; as frações contendo atividade inibitória resultaram em uma diminuição estatisticamente significativa no número de células, enquanto a suplementação de estrogênio anulou a inibição. Inesperadamente, em 1987, todas as culturas de células-alvo de estrogênio epitelial mamário (linhagens celulares MCF7 e T47D) proliferaram ao máximo. Levamos 4 meses de substituições sistemáticas para rastrear a contaminação dos tubos de plástico onde o soro humano que não continha estrogênio estava sendo armazenado. Após 1 ano de trabalho adicional, identificamos o nonilfenol como o contaminante que causou a proliferação celular 3. O nonilfenol, assim como outros alquilfenóis estrogênicos, é usado como antioxidante e na síntese de detergentes não iônicos 8. Os humanos são diretamente expostos porque alguns desses detergentes são usados como espermicidas e em produtos para cuidados com o cabelo e a pele. Além disso, os produtos de degradação desses detergentes foram encontrados na água do rio 8. Com base nessa descoberta, fomos convidados a participar da primeira Conferência Wingspread, onde o termo “disruptor endócrino” foi cunhado 9 , 10.
O conceito de disrupção endócrina
Colborn, então membro da Fundação W. Alton Jones, reuniu um grupo de 21 cientistas para discutir as observações que ela e seus colegas fizeram sobre o estado do meio ambiente na área dos Grandes Lagos; a conferência ocorreu no Wingspread Conference Center, Racine, WI, EUA, em julho de 1991. A declaração de abertura da Declaração Wingspread afirmou que “Muitos compostos introduzidos no meio ambiente pela atividade humana são capazes de perturbar o sistema endócrino de animais, incluindo peixes, vida selvagem e humanos. A perturbação endócrina pode ser profunda devido ao papel crucial que os hormônios desempenham no controle do desenvolvimento” 11. Para abordar essa preocupação global, várias questões foram discutidas. A primeira questão abordada pelos participantes da reunião Wingspread foi a ligação entre as alterações descritas na vida selvagem e a síndrome iatrogênica causada pelo estrogênio sintético dietilestilbestrol 12. Filhas nascidas de mães que receberam dietilestilbestrol durante a gravidez para prevenir aborto espontâneo apresentaram taxas aumentadas de adenocarcinoma vaginal de células claras, várias anormalidades do trato genital, gestações anormais e respostas imunológicas alteradas 12 , 13. Tanto filhos quanto filhas expostos no útero ao dietilestilbestrol desenvolveram anomalias congênitas em seu sistema reprodutivo e tiveram fertilidade reduzida mais tarde na vida 14. Os efeitos observados em humanos expostos ao dietilestilbestrol no útero foram semelhantes aos encontrados em animais selvagens e de laboratório expostos a xenoestrogênios, o que sugere que os humanos também correm risco quando expostos aos mesmos perigos ambientais que os animais selvagens 15 (FIG. 1).
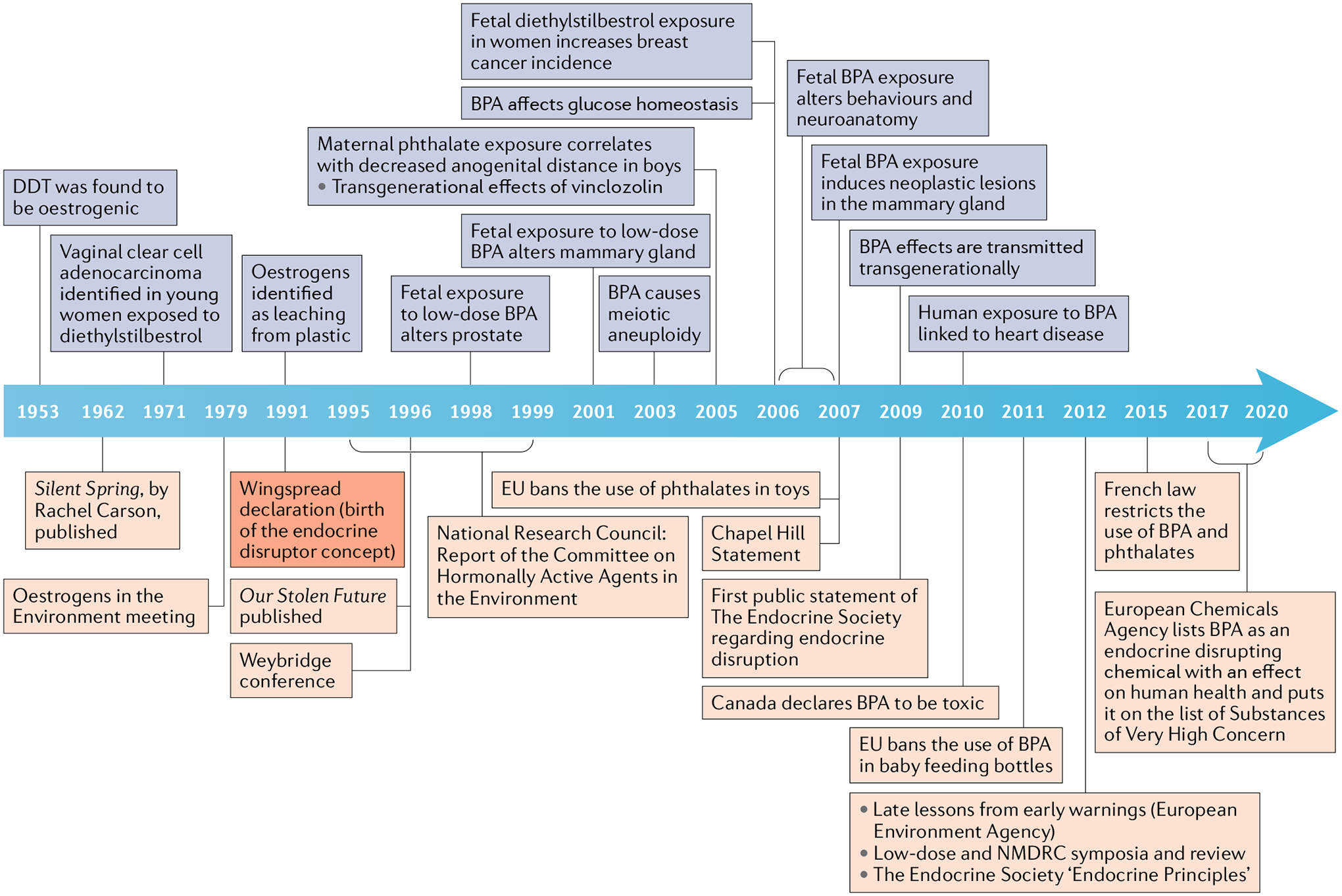
Igualmente importante foi a questão dos níveis de exposição humana, que eram então desconhecidos. Para abordar essa questão, os participantes se concentraram nos efeitos fisiológicos dos hormônios durante o desenvolvimento normal. Em animais politócicos (que produzem ninhadas), como roedores, o posicionamento intrauterino dos fetos tem efeitos marcantes nos resultados anatômicos, funcionais e comportamentais mais tarde na vida. O sexo dos fetos vizinhos resulta em pequenas diferenças locais nos níveis de esteroides sexuais durante a vida fetal, revelando assim que pequenas variações fisiológicas dos níveis hormonais durante a morfogênese têm consequências mensuráveis no fenótipo adulto. Por exemplo, em várias espécies de roedores, um feto fêmea posicionado entre dois outros fetos fêmeas tem abertura vaginal mais precoce, idade mais precoce no primeiro estro e é mais provável que seja escolhido por um macho do que outros roedores 16, enquanto um feto fêmea entre dois fetos machos tende a mostrar traços anatômicos, fisiológicos e comportamentais masculinizados na idade adulta 17 , 18. Consideramos crucial conhecer os níveis de exposição a produtos químicos hormonalmente ativos na população em geral, pois esperávamos que fossem mais baixos do que aqueles que afetam a vida selvagem exposta ao DDT ou os humanos expostos ocupacionalmente a agrotóxicos 19.
A declaração da Wingspread também fez recomendações sobre o tipo de pesquisa necessária para entender o problema e avaliar o efeito em populações humanas. Muitos dos participantes estavam preocupados que os testes toxicológicos então atuais usados por agências reguladoras avaliassem toxicidade aguda, mutagenicidade e carcinogenicidade; ou seja, pontos finais que provavelmente não detectariam a maioria dos disruptores endócrinos (DEs), dado que raramente são mutagênicos 10. A declaração também deixou claro que novos métodos para detectar e medir esses tipos de tóxicos precisavam ser desenvolvidos 11 (CAIXA 1). Assim, adaptamos o ensaio para o inibidor no soro (descrito em uma seção anterior) para rastrear substâncias estrogênicas suspeitas e descobrimos atividade estrogênica em vários contaminantes ambientais que são produzidos em grandes volumes 20. Este ensaio é agora conhecido como ensaio E-SCREEN 21.
Caixa 1 |. Conceitos fundamentais de Wingspread.
- Os disruptores endócrinos são substâncias químicas presentes no ambiente que têm atividade hormonal e, diferentemente do DDT e dos PCBs, seu uso não é regulamentado.
- Baixas doses são importantes: uma pequena diferença dentro da faixa fisiológica tem consequências fenotípicas.
- O feto frágil: o organismo é mais vulnerável à medida que se desenvolve.
- O que é ruim para a vida selvagem, é ruim para os humanos. Teoricamente apoiado pela ancestralidade evolutiva comum, esse conceito é claramente ilustrado pela similaridade da síndrome do dietilestilbestrol em humanos e roedores. O “experimento” do dietilestilbestrol em humanos mostra que hormônios no lugar errado na hora errada produzem efeitos adversos irreversíveis — alguns dos quais são semelhantes aos observados na vida selvagem. Essa observação ilustra a conexão vida selvagem-humano evocada no título da conferência.
- O foco regulatório na mutagenicidade e carcinogenicidade de produtos químicos fará com que malformações e déficits funcionais causados por disruptores endócrinos sejam ignorados.
- Portanto, novas ferramentas precisam ser desenvolvidas para identificar esses produtos químicos e para biomonitorar populações.
DDT, diclorodifeniltricloroetano; PCBs, bifenilos policlorados.
Os principais temas conceituais
Os principais conceitos invocados na declaração Wingspread foram explicados mais detalhadamente por Colborn e colegas 10. A maioria dos conceitos fundamentais da disrupção endócrina já eram incontroversos na endocrinologia. Além disso, a confiabilidade desses conceitos é demonstrada por quase três décadas de pesquisa revisada por pares após a Conferência Wingspread (FIG. 1). A esse respeito, a Endocrine Society publicou sua primeira declaração científica em 2009 abordando a ameaça representada pelos DEs e “defendendo o envolvimento de partes interessadas individuais e da sociedade científica na comunicação e implementação de mudanças na política pública e conscientização” 22 . Uma declaração atualizada foi publicada em 2015 (REF. 23).
Definindo a desregulação endócrina
A Endocrine Society adotou uma definição sucinta de DE como “um produto químico exógeno, ou mistura de produtos químicos, que interfere em qualquer aspecto da ação hormonal” 24. Esta definição tem a virtude da brevidade e tem a vantagem de não confundir o conceito de interferir na ação hormonal com o de produzir efeitos adversos.
Um disruptor endócrino, muitos alvos
A especificidade dos hormônios naturais não é absoluta. Por exemplo, altas doses de andrógenos produzem um efeito positivo no ensaio uterotrópico, que era tradicionalmente usado para determinar se um composto tem propriedades estrogênicas 25. Portanto, não é surpreendente que os DEs possam afetar vários alvos. Por exemplo, os xenoestrogênios imitam os efeitos dos estrogênios ovarianos, mas também produzem efeitos endócrinos adicionais. Entre os xenoestrogênios, o bisfenol A (BPA) não é apenas um agonista do estrogênio, mas em altas doses interfere na ação do hormônio tireoidiano 26 , 27. Além disso, para alguns pontos finais mediados por receptores de estrogênio, os efeitos do estradiol e do BPA são diferentes, se não opostos 28 , 29. Essas diferenças nos efeitos de vários estrogênios não devem ser usadas pelos reguladores para descartar os efeitos dos xenoestrogênios que diferem daqueles do controle positivo (geralmente um estrogênio esteroidal como o etinilestradiol) como sendo devidos ao acaso 30. Em vez disso, esses diferentes efeitos devem ser levados a sério, pois fornecem uma oportunidade para descobrir processos regulatórios fisiológicos 31.
Janelas de suscetibilidade
Os DEs podem afetar a saúde em todas e quaisquer fases da vida. No entanto, os efeitos da exposição durante o desenvolvimento embrionário e fetal são geralmente mais deletérios do que os efeitos da exposição em fases posteriores da vida porque o organismo é mais vulnerável durante a organogênese; esses chamados efeitos organizacionais são, em sua maioria, irreversíveis 32. Em contraste, os efeitos ativadores parecem ser, em sua maioria, reversíveis. Por exemplo, exposições ocupacionais a produtos químicos estrogênicos podem resultar em azoospermia e redução da libido, efeitos que diminuem após a cessação da exposição 19. No entanto, uma distinção clara entre efeitos ativadores e organizacionais é confusa em alguns casos. Por exemplo, as mães expostas a baixas doses de BPA durante a gravidez desenvolvem intolerância à glicose e sensibilidade alterada à insulina vários meses após o parto. Nesse caso, os efeitos deletérios, ao contrário dos efeitos ativadores, manifestam-se vários meses após a cessação da exposição 33.
Estudos epidemiológicos encontraram correlações positivas entre a exposição a DEs como BPA e obesidade e doenças cardíacas 34. Em relação ao câncer, a exposição ao dietilestilbestrol durante a gravidez aumenta a incidência de câncer de mama na mesma faixa etária em que esses cânceres se manifestam na população em geral 35, e as filhas dessas mulheres têm um risco aumentado de câncer de mama aos 40 anos de idade e além 36. A exposição ao DDT também resulta em um aumento na incidência de câncer de mama que se manifesta 40 anos após a exposição; digno de nota, a incidência é maior naquelas expostas perinatalmente do que naquelas expostas mais tarde na vida 37.
Como o sistema endócrino regula múltiplas funções, incluindo crescimento, desenvolvimento e metabolismo, espera-se que as síndromes produzidas pela exposição a DEs sejam complexas e incluam efeitos diretos e indiretos. Por exemplo, alguns DEs aumentam o risco de obesidade; o momento da puberdade é afetado pela obesidade e, consequentemente, a exposição a DEs pode aumentar indiretamente o risco de câncer de mama (o início precoce da puberdade está associado a um risco aumentado de câncer de mama) 23. Além disso, os DEs também podem alterar todo o ambiente hormonal, afetando muitos tecidos reprodutivos simultaneamente 38.
A dose importa
Os DEs, assim como os hormônios endógenos, são ativos em baixas concentrações e doses, exibem curvas dose-resposta não monotônicas (NMDRCs) e podem agir de forma aditiva com hormônios endógenos e outros DEs. Apesar dessas muitas semelhanças, alguns resultados inesperados foram obtidos ao avaliar o efeito dos DEs usando testes toxicológicos padrão. Por exemplo, a exposição a xenoestrogênios durante o desenvolvimento fetal em camundongos produz efeitos em doses muito mais baixas do que as necessárias in vitro ou no teste toxicológico padrão, o ensaio uterotrópico 39. Vários efeitos de baixa dose foram agora claramente mapeados para receptores extranucleares, como ERα, ERβ e GPR30 (REF. 31).
Não monotonicidade.
Antes da Conferência Wingspread, já se sabia que os hormônios frequentemente exibem NMDRCs. Ou seja, existe uma relação não linear entre dose e efeito que é caracterizada por uma mudança de sinal da inclinação da curva dentro do intervalo de doses examinadas. Essa característica é ilustrada pelo efeito proliferativo dos estrogênios 40 e androgênios, que é bifásico; ou seja, em doses mais baixas o efeito líquido é mais células, enquanto em doses mais altas, o efeito é um número menor de células 41 , 42. Esses dois efeitos são mediados por processos distintos que podem ser separados um do outro em um ambiente experimental 41 – 43; ou seja, o NMDRC é um composto de duas ou mais curvas monotônicas. Não surpreendentemente, os DEs também exibem NMDRCs 44 – 46 . Por exemplo, BPA e bisfenol S (BPS) são estrogênios potentes quando agem via ERα, ERβ e GPR30 extranucleares. O NMDRC que BPA e BPS provocam nas células β pancreáticas pode ser atribuído ao fato de que os diferentes componentes da curva são mediados por vias distintas envolvendo diferentes receptores 31 , 46.
Efeitos aditivos.
Estudos experimentais tradicionalmente investigam produtos químicos isoladamente porque esta é a maneira mais direta de aprender sobre eles sem se preocupar em como lidar com interações complexas. No entanto, determinar os efeitos da exposição simultânea a combinações de produtos químicos é de extrema relevância porque os humanos, assim como a vida selvagem, são geralmente expostos simultaneamente a uma infinidade de DEs 47. De fato, devido ao conhecimento substancial obtido usando estudos tradicionais, os efeitos das misturas estão agora sendo avaliados em modelos experimentais 48 e em estudos epidemiológicos 49.
O mesmo hormônio, mas efeitos diferentes.
Além da não monotonicidade, que se refere aos efeitos de diferentes doses administradas durante um período similar, os hormônios naturais produzem efeitos diferentes dependendo se são administrados em uma única dose (efeito agudo) ou continuamente (efeito crônico). Por exemplo, uma única dose de estrogênio induz uma onda de proliferação celular no epitélio luminal do útero de ratos ovariectomizados, enquanto a administração contínua primeiro induz a proliferação celular e depois inibe a proliferação posterior 50. Da mesma forma, andrógenos administrados a um rato macho castrado resultaram em um efeito proliferativo e, mais tarde, promoveram a quiescência 51 , 52.
Além disso, o mesmo hormônio pode produzir efeitos diferentes e até contrários em alvos diferentes ou no mesmo alvo em momentos diferentes 53 . Além disso, um hormônio pode afetar tecidos diferentes quando administrado a animais durante diferentes estágios de desenvolvimento. Por exemplo, uma única dose de estradiol resulta em aumento da atividade mitótica tanto na lâmina própria quanto no epitélio do endométrio de ratos imaturos, enquanto em ratos maduros ovariectomizados o aumento da atividade mitótica ocorre exclusivamente no compartimento epitelial 54 , 55.
Outro fator importante é a velocidade de mudança do nível hormonal. Um aumento rápido nos níveis de estradiol durante o período pré-ovulatório desencadeia uma resposta de feedback positivo e liberação do hormônio luteinizante, o que leva à ovulação 56. Por outro lado, níveis baixos e constantes de estrogênio geram um feedback negativo 57 , 58 . Além disso, em tecidos neoplásicos sensíveis a hormônios, o mesmo hormônio pode ter efeitos proliferativos ou inibitórios, dependendo do modo de entrega. Por exemplo, a atividade cíclica do ovário é necessária para o desenvolvimento de tumores mamários induzidos por 7,12-dimetilbenz[a] antraceno (DMBA), mas altos níveis constantes de estrogênios inibem a formação de tumores 59 . Vale ressaltar que estrogênios sintéticos como o dietilestilbestrol podem aumentar a propensão ao desenvolvimento de câncer de mama 35 , 60 , inibir o desenvolvimento do câncer de mama 59 e induzir a regressão do câncer de mama dependendo de quando o estrogênio sintético é administrado 61 , 62 . A mesma exposição ao dietilestilbestrol pode desencadear efeitos diferentes em diferentes órgãos dentro do mesmo indivíduo. Algumas mulheres tratadas com dietilestilbestrol para induzir a regressão do câncer de mama desenvolvem carcinomas endometriais 63 , e homens tratados com dietilestilbestrol para induzir a regressão do câncer de próstata podem desenvolver ginecomastia e, menos frequentemente, câncer de mama 64 .
Em suma, a não monotonicidade e a contextualidade da resposta aos hormônios devem ser levadas em consideração ao avaliar o efeito dos DEs. Não se deve esperar que as respostas aos agonistas hormonais sejam monotônicas ou semelhantes às respostas aos hormônios naturais que eles imitam, independentemente da idade da exposição, ou da duração e do tipo de exposição.
Novos desenvolvimentos desde Wingspread
Um documentário, “Assault on the Male” (produtora Deborah Cadbury, série Horizon da BBC) que foi lançado em 1993 foi um dos primeiros filmes dedicados ao tópico de DEs. Ele transmitiu realisticamente o estado do campo 2 anos após Wingspread. O tema central eram as alterações na reprodução masculina sendo observadas em humanos e na vida selvagem e ele postulou a hipótese de que esse resultado era devido aos efeitos deletérios dos DEs. Três anos depois, Our Stolen Future , um livro de T. Colborn, D. Dumanoski e JP Myers, que é frequentemente comparado a Silent Spring, fez um caso persuasivo sobre o problema dos DEs e suas prováveis consequências 65 (FIG. 1). Desde então, a literatura científica sobre o assunto cresceu exponencialmente, revelando DEs adicionais e os efeitos relacionados à saúde previstos pelos participantes do Wingspread. Por exemplo, a exposição perinatal de roedores fêmeas ao BPA resulta em efeitos semelhantes aos resultantes da exposição pré-natal ao dietilestilbestrol em mulheres e roedores fêmeas (TABELA 1). Efeitos semelhantes foram obtidos em camundongos machos em relação aos pontos finais comportamentais 66 , reprodutivos, neoplásicos e metabólicos (alterações dos órgãos genitais masculinos, diminuição da produção diária de espermatozoides e aumento da propensão ao câncer de próstata, obesidade e diabetes mellitus tipo 2) 67 – 69 .
Tabela 1 |.
Exemplos representativos de alvos afetados resultantes da exposição ao xenoestrogênio
| Alvo afetado | BPA | Dietilestilbestrol |
|---|---|---|
| Início da puberdade | Início mais precoce em camundongos 103 , 104 | Abertura vaginal acelerada em camundongos 105 |
| Ciclos estrais | Ciclagem alterada, cessação precoce em ratos 106 | Alterações do estro ou ciclos menstruais a , 105 em ratos, camundongos e humanos, menopausa precoce a , 107 |
| Perfis hormonais | Ação adversa do hormônio tireoidiano em ratos 26 , expressão alterada do receptor hormonal no útero em camundongos 108 , níveis alterados de LH em camundongos 39 | Níveis plasmáticos alterados de tiroxina, TSH e LH, funções da tireoide alteradas em ratos 109 , resposta da hipófise alterada ao GnRH em ratos b , 110 |
| Resposta aos estrogênios | Sensibilidade alterada em ratos 111 , 112 | Resposta alterada em ratos 113 |
| Obesidade, diabetes mellitus tipo 2 e metabolismo | Ação obesogênica em camundongos b , 114 , metabólitos alterados em camundongos 115 , metaboloma alterado em camundongos e ratos 90 , 116 , ação diabetogênica em camundongos b , 91 , 117 | Ação obesogênica em camundongos 23 |
| Comportamento | Atividade neurológica prejudicada em camundongos 118 , hiperatividade, aumento de comportamentos repetitivos em roedores 91 | Aumento do comportamento agressivo em ratos 119 |
| Morfogênese do trato reprodutivo | Oogênese alterada 120 , aumento de anormalidades ovarianas, vaginais e uterinas em camundongos 108 | Aumento de ovários policísticos, cornificação vaginal independente de ovário, adenose vaginal c , malformações do oviduto, útero e colo do útero c , 105 |
| Morfogênese da glândula mamária | Desenvolvimento alterado da glândula mamária 121 , 122 , resposta alterada ao estradiol 112 , resposta alterada à progesterona em camundongos 112 | Resposta hormonal alterada 123 , desenvolvimento alterado em ratos 124 |
| Fertilidade ou fecundidade | Diminuição da fertilidade e fecundidade (diminuição do número de ninhadas e de filhotes) 45 , ovulação prejudicada 125 | Diminuição da fertilidade 105 , diminuição do número de filhotes, aumento do tempo até a primeira ninhada em camundongos 126 |
| Neoplasias mamárias | Carcinoma in situ 127 , adenocarcinoma em ratos 128 | Adenocarcinomas c , 129 |
| Neoplasias do trato reprodutivo | Lesões pré-neoplásicas e/ou neoplásicas em ovário e trato reprodutivo em camundongos 130 | Carcinomas em camundongos 126 , carcinoma de células claras da vagina a |
| Transmissão transgeracional | Reconhecimento social prejudicado 131 , capacidade reprodutiva reduzida em ratos 132 | Aumento de anormalidades do trato reprodutivo, neoplasias em camundongos 126 |
Os efeitos listados foram observados após exposição fetal ou perinatal ao BPA ou dietilestilbestrol. Todos os efeitos listados são encontrados em estudos com roedores, exceto quando indicado. BPA, bisfenol A; GnRH, hormônio liberador de gonadotropina; LH, hormônio luteinizante.
a) Efeitos em mulheres expostas fetalmente.
b) Efeitos em ratos machos.
c) Efeitos em mulheres e roedores.
Apesar dos muitos efeitos deletérios bem documentados do BPA (TABELA 1), houve pouca tradução em ação regulatória. Nas próximas seções, discutimos por que isso pode ser, e identificamos dois tipos de explicação, uma teórica e a outra, por falta de uma palavra melhor, institucional.
Inconsistências teóricas
O conceito de DE surgiu simultaneamente com importantes desenvolvimentos teóricos nas ciências biológicas. Desde a década de 1950, a revolução da biologia molecular atualizou o status metafórico do organismo de uma máquina para o de um computador 70 ; esses desenvolvimentos foram devidos à introdução de metáforas vagamente baseadas nas teorias matemáticas da informação. Filósofos e teóricos alertaram repetidamente sobre a inadequação dessas metáforas 71 . A ascensão das disciplinas conhecidas como biologia ecológica do desenvolvimento (eco-devo) e biologia evolucionária do desenvolvimento também trouxe uma crítica às visões genocêntricas na biologia 72 . A eco-devo não apenas trouxe à tona o papel do ambiente como um co-criador de fenótipos, mas ao fazê-lo rejeitou explicitamente a ideia de um programa genético de desenvolvimento, ou a supremacia das explicações genéticas sobre as funcionais. Em outras palavras, não há “controle central”, os genes não têm um papel causal privilegiado; em vez disso, há redundância e plasticidade. Desenvolvimentos teóricos adicionais incluem fortes argumentos para abandonar metáforas que equiparam organismos e células a máquinas, e a validade de mecanismos (particularmente os moleculares) como o único tipo de explicação em biologia 73 , 74 .
Devido à forte estrutura teórica da biologia evolutiva, a introdução de novos conceitos, como o papel da herança epigenética, gerou discussões abrangentes (e desacordos) sobre quais conceitos devem ser mantidos, quais precisam de modificação e quais devem ser rejeitados 75 . Em contraste, na biologia organismal, a falta de engajamento teórico pela comunidade de pesquisa convencional levou à coexistência de postulados conflitantes, pelos quais a falta de ajuste entre dados e pressupostos poderia ser facilmente corrigida por adições ad hoc. Por exemplo, o papel do ambiente como determinante do fenótipo é metaforicamente chamado de “reprogramação” mesmo por aqueles que estão cientes de que o desenvolvimento não é um programa; um termo muito mais neutro para a indução da plasticidade do desenvolvimento é “elicitado ambientalmente” 76 .
Embora frequentemente ignoradas pelos biólogos, as posturas filosóficas importam. Assim, tem sido para o deleite daqueles que gostariam de atrasar a ação regulatória em relação aos DEs que alguns biólogos propuseram o desenvolvimento de vias de resultados adversos 77 , 78 que conectarão moléculas em um caminho linear por meio de mecanismos para efeitos adversos. No entanto, a linearidade é incomum em sistemas biológicos; seus fenômenos são multicausais e circulares devido a feedbacks e história, ou seja, ontogenia e evolução 79 . Felizmente, existe uma alternativa plausível a essa postura teoricamente falha que tem uma consequência prática imediata. Consiste em deixar o mecanismo de lado e, em vez disso, usar características-chave (KCs) como base para a identificação de riscos. Em outras palavras, KCs seriam as “características comuns da regulação e ação hormonal que são independentes da diversidade dos efeitos dos hormônios durante o ciclo de vida”. Além disso, “KCs de DEs são as propriedades funcionais de agentes que alteram a ação hormonal”, e “… KCs são agnósticos com relação ao conhecimento atual ou futuro de riscos à saúde a jusante e vias mecanicistas” 80 . Embora os proponentes dessa alternativa não tenham oferecido argumentos teóricos sobre a validade de vias mecanicistas, sua abordagem tinha a virtude de não depender de posições de legitimidade científica duvidosa e, mais importante, poderia ser aplicada imediatamente para fins regulatórios rigorosos. Essa solução pragmática não torna a resolução de questões teóricas supérflua ou menos oportuna.
Os desenvolvimentos conceituais trazidos pela biologia eco-devo e pela biologia evolutiva do desenvolvimento foram úteis para fornecer uma estrutura teórica frouxa que permitiu aos cientistas contornar os obstáculos causados pelo uso indevido das noções de programa, informação e mecanismo. No entanto, a elaboração de princípios sólidos para uma teoria de organismos 81 , 82 que abrange o ciclo de vida completo certamente forneceria uma estrutura adequada para experimentação e também ajudaria a excluir argumentos irracionais que impedem a regulamentação desenvolvidos pelos praticantes da chamada ciência regulatória.
Regulamentação e a questão do BPA
As agências reguladoras governamentais nos EUA e na Europa, como a FDA e a Autoridade Europeia para a Segurança Alimentar (EFSA), alegaram sistematicamente que não havia evidências suficientes para uma ação regulatória ou que as evidências indicavam que o BPA era seguro nos níveis usuais de exposição. Essas conclusões foram alcançadas principalmente devido a uma escolha tendenciosa de conjuntos de dados que favoreceram os pesquisadores que usavam protocolos de boas práticas de laboratório (BPL) 83 . As BPL foram criadas para dificultar a ocultação de dados inconvenientes por aqueles interessados em promover o uso do produto químico que está sendo testado. Esses estudos de BPL usam pontos finais toxicológicos clássicos que são inapropriados para detectar os efeitos relatados por laboratórios acadêmicos 84 . Devido à contradição entre a opinião dessas duas agências (FDA e EFSA) e as evidências de estudos com animais conduzidos por cientistas em instituições acadêmicas revelando que a exposição a níveis ambientalmente relevantes de BPA resulta em uma constelação de efeitos deletérios, a França promulgou legislação proibindo o uso de BPA em materiais de contato com alimentos (Lei n.º 2010-729 de 30 de junho de 2010 modificada pela Lei n.º 2012-1442 de 24 de dezembro de 2012 (INERIS 2015)). Simultaneamente, estudos patrocinados pela ANSES, o equivalente francês da EFSA e da FDA, identificaram o BPA como um DE usando estudos acadêmicos e de BPL 85 (FIG. 1).
Como resultado dessa situação conflitante, em 2013, o FDA decidiu conduzir uma avaliação toxicológica do BPA. O NIEHS propôs que pesquisadores acadêmicos pudessem participar do estudo obtendo os órgãos de interesse do estudo GLP e usando-os para testar os pontos finais que levaram os pesquisadores acadêmicos a alegar que o BPA induz efeitos sérios à saúde. Esse conceito se materializou como o Consortium Linking Academic and Regulatory Insights on Bisphenol A Toxicity (CLARITY-BPA), uma colaboração entre cientistas acadêmicos e do governo federal, organizada pelo National Toxicology Program, NIEHS e o FDA National Center for Toxicological Research (NCTR) 86 . Esperava-se que esse consórcio de pesquisa “melhorasse significativamente a interpretação da riqueza de dados que está sendo gerada por todos os parceiros do consórcio, incluindo a caracterização da resposta à dose dos efeitos observados e sua interpretação em um contexto biológico integrado” 87 .
O estudo CLARITY
O estudo principal CLARITY foi conduzido em ratos e teve dois ramos experimentais, com exposições iniciadas no dia gestacional 6 em ambos os estudos. No chamado ramo de dose de parada, que visava detectar efeitos devidos somente à exposição do desenvolvimento, a exposição terminou no dia pós-natal 21. O outro ramo foi chamado de “contínuo”, e a exposição terminou quando os animais foram sacrificados (intermediário 1 ano, final 2 anos). O ramo contínuo representa um design típico para estudos regulatórios que visam detectar tóxicos clássicos, não DEs. De uma perspectiva endocrinológica, esses dois regimes não são comparáveis. Como já foi aludido, de acordo com se a exposição é aguda ou crônica, e dependendo do momento da exposição, o mesmo hormônio pode produzir efeitos diferentes no mesmo órgão ou tecido.
O objetivo dos estudos acadêmicos no consórcio CLARITY era principalmente determinar se, nessa configuração GLP, os resultados obtidos anteriormente poderiam ser reproduzidos e, portanto, verificados. Eles avaliaram a próstata, o trato urinário, o ovário, a glândula mamária, o cérebro e o coração. Os estudos acadêmicos dentro do CLARITY confirmaram estudos acadêmicos anteriores; eles encontraram respostas de dose não lineares, e algumas eram claramente não monotônicas (às vezes em forma de U (próstata) 88 ou em forma de W (ovário) 89 ). O maior e, às vezes, único efeito nesses estudos foi observado na dose mais baixa, o que sugeriu que o BPA poderia ter efeitos em doses mais baixas do que as testadas no estudo CLARITY (a menor dose usada no estudo CLARITY foi de 2,5 μg/kg de peso corporal por dia). De fato, alguns estudos acadêmicos anteriores encontraram efeitos em 25 ng/kg por dia e 250 ng/kg por dia 18 , 39 , 90 , 91 . Além disso, correlações estatísticas entre os diferentes estudos acadêmicos do CLARITY revelaram padrões de efeitos nos órgãos dos mesmos conjuntos de animais, mostrando assim que, ao contrário das conclusões do NCTR, os efeitos de baixas doses não foram aleatórios e, novamente, os maiores efeitos ocorreram consistentemente nas doses mais baixas 89 .
Uma excelente discussão do estudo CLARITY já foi publicada neste periódico 92 . Nós focamos apenas em um estudo acadêmico sobre o NMDRC do BPA obtido em espécimes do estudo CLARITY; ele não estava disponível no momento da discussão anterior do estudo CLARITY. Esta nova evidência refuta a interpretação do estudo principal fornecido pelo FDA. Ele foca nos efeitos do BPA na estrutura e no crescimento da árvore ductal da glândula mamária do rato e, mais importante, se esses efeitos revelam um NMDRC (uma questão controversa entre toxicologistas em agências reguladoras). Para este propósito, uma nova ferramenta de software foi desenvolvida para avaliação automática não supervisionada de aspectos quantificáveis da árvore ductal mamária. Esta análise de espécimes do dia 21 pós-natal revelou um NMDRC de efeitos do BPA com um ponto de ruptura (uma mudança abrupta na direção da curva dose-resposta) entre as doses de 25 μg/kg por dia e 250 μg/kg por dia para a maioria das 91 medições 93 ( FIG. 2 ).
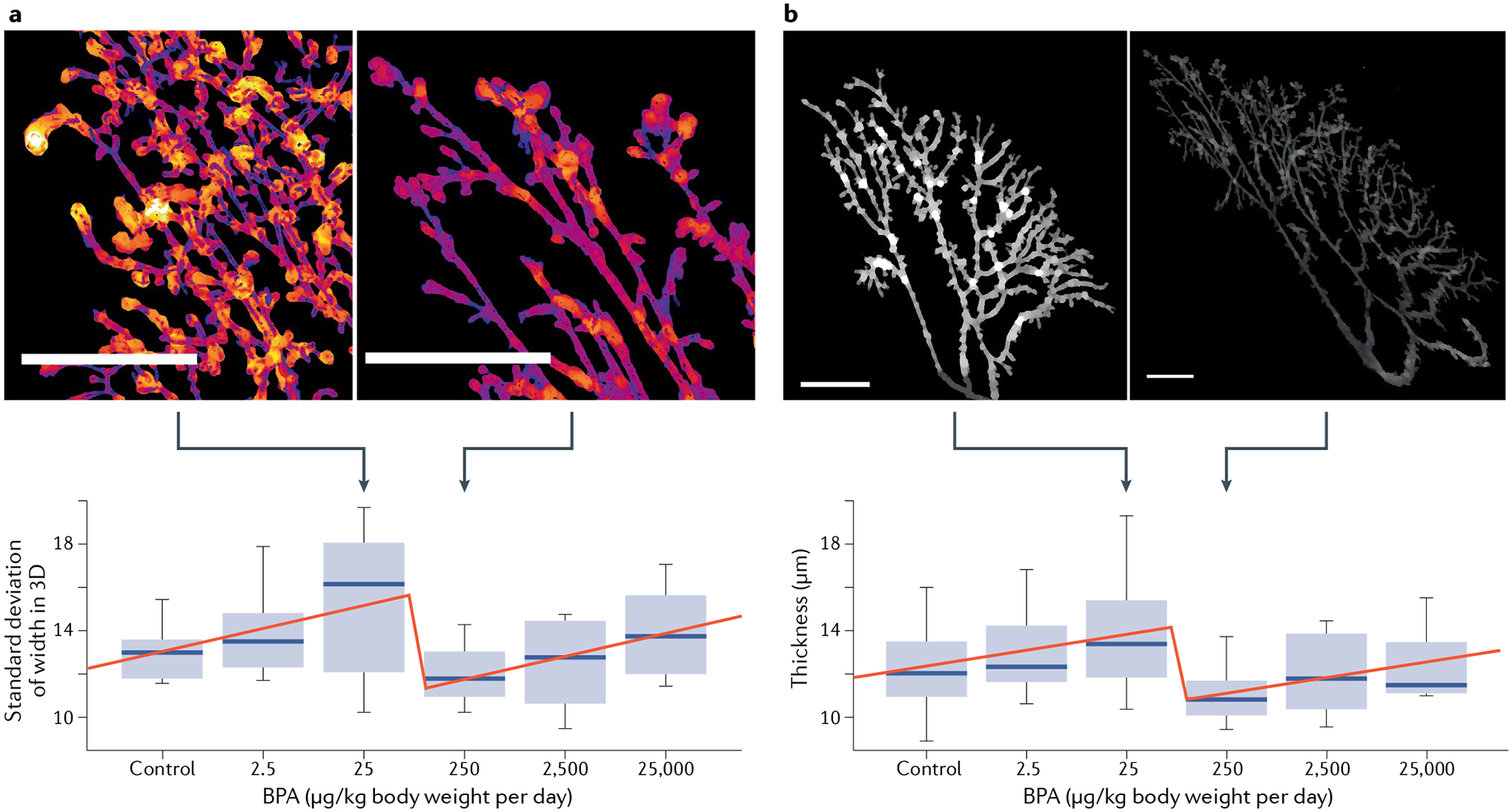
Este resultado foi confirmado por uma análise estatística global dos animais de dose contínua e parada no dia 90 pós-natal e aos 6 meses de idade. Além disso, os efeitos do BPA e do etinilestradiol, o controle positivo, foram diferentes para várias características. Este estudo forneceu a evidência mais forte de não monotonicidade dentro do estudo CLARITY, validando assim a postura teórica em endocrinologia em relação à prevalência de NMDRCs. Além disso, este estudo demonstrou que a matemática padrão para mostrar a causalidade não deve ser sempre encontrar uma resposta linear, como esperado pelos toxicologistas da FDA, mas quando a resposta não é linear, mostrar a prevalência de um padrão não monotônico específico, aqui um ponto de ruptura entre doses de 25 μg/kg por dia e 250 μg/kg por dia. Além disso, quanto às respostas lineares (monotônicas), o conhecimento dos mecanismos moleculares subjacentes a cada um desses NMDRCs não é necessário para reconhecer a existência deste fenômeno estatisticamente significativo bem descrito 93 – 95 . Portanto, a ausência de uma explicação mecanicista não deve ser usada para descartar NMDRCs obtidos com métodos estatisticamente apropriados na ciência regulatória, como foi feito anteriormente 30 .
Retornando ao estudo principal 30 , ele mostrou vários efeitos estatisticamente significativos relacionados à doença; o mais crítico deles foi que o BPA induziu cânceres mamários na dose mais baixa, confirmando assim experimentos conduzidos na academia. Infelizmente, a interpretação do estudo principal pelo NCTR não levou em conta os princípios da endocrinologia. Ao descartar esses conceitos empiricamente apoiados de não monotonicidade, os autores do estudo concluíram que, como as respostas dentro dos braços de dose contínua e de dose interrompida e as respostas dentro e entre os tecidos eram todas inconsistentes, a plausibilidade da relação entre a maioria das lesões e o tratamento com BPA poderia ser questionada 30 . Objetivamente, essa conclusão não parece ser baseada em razões científicas. Ou seja, a descoberta de respostas inconsistentes significa que as descobertas não concordavam com o conceito de que a linearidade é a única matemática correta da causalidade, que todos os estrogênios fazem exatamente a mesma coisa e que uma exposição mais longa deve produzir pelo menos o mesmo resultado que uma exposição mais curta, não um resultado menos grave. Todos esses conceitos são inválidos em endocrinologia. Para superar essa resistência do NCTR, devemos explicitar os princípios e as estruturas teóricas que orientam a pesquisa em endocrinologia e origens desenvolvimentais de doenças adultas. Caso contrário, ao colocar a carroça mecanicista na frente dos bois fenomenológicos, instituições criadas para proteger o público podem adotar medidas para adiar a regulamentação muito necessária 94 .
Experiência pessoal
Retornando à nossa experiência pessoal, nossa descoberta fortuita de estrogênios no plástico nos motivou a estudar a disrupção endócrina do feto em desenvolvimento. Este projeto de pesquisa produziu resultados que nos levaram, novamente, a questionar as suposições que originalmente guiaram nossa pesquisa; ou seja, aquelas que dominaram a pesquisa sobre desenvolvimento e câncer durante a segunda metade do século passado, um período durante o qual o reducionismo se tornou hegemônico e a prática da biologia molecular prosperou.
Durante esse período, o desenvolvimento fetal foi interpretado como um programa que é principalmente impermeável à modulação ambiental. Paralelamente, o câncer foi considerado um problema baseado em células causado por mutações em genes que supostamente controlavam a proliferação celular. A carcinogenicidade do dietilestilbestrol e outros DEs motivou nossa reavaliação desses dois dogmas, a saber, o programa de desenvolvimento e a teoria da mutação somática 96 . Em termos práticos, percebemos que, para o bem de nossa atividade contínua como biólogos experimentais, precisávamos examinar as inconsistências da estrutura teórica sob a qual a pesquisa era conduzida na intersecção das origens do desenvolvimento da doença adulta, DEs, reprodução e câncer.
Começamos estudando a disrupção endócrina usando os princípios da biologia eco-devo, em que o embrião é considerado um sistema aberto e o ambiente um co-determinante de fenótipos. Como o desenvolvimento é sobre “tornar-se”, ele é melhor atendido por uma perspectiva explicativa organicista do que por uma perspectiva reducionista e/ou mecanicista fixada em “ser” 70 . Sob a estrutura eco-devo, os hormônios agem como morfógenos 97 , 98 .
Usando a estrutura fornecida para esses princípios, desenvolvemos a teoria do campo de organização tecidual da carcinogênese, que postula que o câncer é uma doença baseada em tecido causada por várias exposições deletérias que interferem na comunicação recíproca entre células no campo morfogenético e entre células e sua matriz extracelular circundante. Dessa perspectiva, o câncer é visto como um desenvolvimento que deu errado 99 . Nesse contexto, as exposições a DEs causarão mais danos quando ocorrerem durante a organogênese. Por sua vez, esse entendimento nos levou a reexaminar o amplo quadro da biologia do desenvolvimento e propor princípios para uma Teoria dos Organismos que aborda todo o ciclo de vida 81 , 82 . Essa teoria é compatível e complementa a teoria evolucionária.
As teorias têm um propósito prático: construir objetividade e determinar o que pode ser observado; no nosso caso, nosso trabalho teórico levou a uma modelagem matemática bem-sucedida e explicações robustas de processos de desenvolvimento e endocrinológicos 100 , 101 . Quando uma teoria não é vaga, ela também nos permite decidir quando rejeitar uma interpretação ou abandonar uma hipótese. Nosso trabalho teórico nos permitiu lidar com esse tipo de problema e nos impediu de procurar explicações ad hoc ou de usar termos carregados de bagagem teórica que, quando explicitados, são incompatíveis com a estrutura teórica aceita. Essa experiência positiva nos encoraja a propor uma direção futura para o campo da disrupção endócrina: construir uma estrutura teórica rigorosa e explícita. Essa abordagem não apenas facilitará a pesquisa ao determinar quais são os postulados e observáveis adequados, mas também serviria para desmascarar e superar argumentos espúrios destinados a atrasar a regulamentação.
Conclusões
Dados suficientes foram coletados sobre os efeitos deletérios dos DEs para garantir uma ação imediata para diminuir a exposição humana a esses agentes por meio de uma política de saúde pública bem pensada e executável. Felizmente, no caso específico do BPA, o enorme conjunto de evidências coletadas, principalmente por meio de estudos acadêmicos, resultou na listagem do BPA como um DE pela Agência Europeia de Produtos Químicos e na inclusão do BPA na Lista de Candidatos de substâncias de alta preocupação devido às suas propriedades de toxicidade reprodutiva. Sem dúvida, este é um movimento na direção certa e deve ser estendido por regulamentação adicional. Para acelerar esse processo, propomos nos concentrar em princípios e teorias. O princípio da precaução já está sendo invocado em países da União Europeia; sua aplicação mundial como um guia para uma política de proteção à saúde pública e ambiental poderia ajudar imediatamente a reduzir o risco, restringindo a exposição aos DEs. Novamente, em 14 de outubro de 2020, a Comissão Europeia publicou uma estratégia abrangente de produtos químicos para a sustentabilidade. Ela propõe, entre outras coisas, “estabelecer uma identificação de risco juridicamente vinculativa de disruptores endócrinos, com base na definição da OMS, com base em critérios já desenvolvidos para agrotóxicos e biocidas, e aplicá-la em toda a legislação”, e “garantir que os disruptores endócrinos sejam proibidos em produtos de consumo assim que forem identificados” 102 . Em relação às teorias, o campo da endocrinologia em geral, e dos DEs em particular, se beneficiaria de um trabalho teórico que levasse à identificação de princípios fundamentais, uma noção que começou a ser discutida e que merece maior desenvolvimento 24 , 84 . Este trabalho teórico é muito necessário, por um lado, para orientar o trabalho experimental com o objetivo de encontrar explicações precisas dos fenômenos e, por outro, para realizar ciência regulatória, informada por uma estrutura teórica adequada. Esperamos que os endocrinologistas, agora armados com os princípios adequados e uma compreensão clara de quando “chega”, possam ajudar a superar as táticas de atraso que, mais cedo ou mais tarde, tentarão descarrilar a estratégia da Comissão Europeia.
Agradecimentos
Agradecemos a V. Bouffard por sua leitura perspicaz deste manuscrito. Reconhecemos com gratidão o apoio do National Institute of Environmental Health Sciences (bolsas ES030045 e ES026283). Os financiadores não tiveram nenhum papel no conteúdo deste artigo, e ele não representa necessariamente as visões oficiais das agências de financiamento.
Notas de rodapé
Interesses concorrentes
A AMS e a CS receberam reembolsos de viagens de universidades, governos, agências não governamentais e indústrias para falar sobre produtos químicos disruptores endócrinos.
A AMS serve ad honorem/pro bono em dois conselhos consultivos científicos. A CMS declara não haver conflitos de interesses.
Referências
- 1.McLachlan JA Estrogens in the Environment (Elsevier, 1980). [Google Scholar]
- 2.Colborn T & Liroff RA Toxics in the Great Lakes. EPA J 16, 5–8 (1990). [Google Scholar]
- 3.Soto AM, Justicia H, Wray JW & Sonnenschein C p-Nonyl-phenol: an estrogenic xenobiotic released from “modified” polystyrene. Environ. Health Perspect 92, 167–173 (1991). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sonnenschein C, Soto AM & Michaelson CL Human serum albumin shares the properties of estrocolyone-I, the inhibitor of the proliferation of estrogen-target cells. J. Steroid Biochem. Mol. Biol 59, 147–154 (1996). [DOI] [PubMed] [Google Scholar]
- 5.Soto AM & Sonnenschein C Regulation of cell proliferation: the negative control perspective. Ann. NY Acad. Sci 628, 412–418 (1991). [DOI] [PubMed] [Google Scholar]
- 6.Sonnenschein C & Soto AM The Society of Cells: Cancer and Control of Cell Proliferation (Springer, 1999). [Google Scholar]
- 7.Soto AM, Longo G, Montévil M & Sonnenschein C The biological default state of cell proliferation with variation and motility, a fundamental principle for a theory of organisms. Prog. Biophys. Mol. Biol 122, 16–23 (2016). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Markey CM, Michaelson CL, Sonnenschein C & Soto AM in Endocrine Disruptors – Part I (ed Metzler M) 129–153 (Springer, 2001). [Google Scholar]
- 9.Colborn T & Clement C Chemically Induced Alterations in Sexual and Functional Development: the Wildlife/Human Connection (Princeton Scientific, 1992). [Google Scholar]
- 10.Colborn T, vom Saal FS & Soto AM Developmental effects of endocrine-disrupting chemicals in wildlife and humans. Environ. Health Perspect 101, 378–384 (1993). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Bern HA et al. in Chemically Induced Alterations in Sexual and Functional Development: The Wildlife/Human Connection (eds Colborn T & Clement C) 1–8 (Princeton Scientific, 1992). [Google Scholar]
- 12.Herbst AL, Ulfelder H & Poskanzer DC Adenocarcinoma of the vagina: association of maternal stilbestrol therapy with tumor appearance in young women. N. Engl. J. Med 284, 878–881 (1971). [DOI] [PubMed] [Google Scholar]
- 13.Noller KL et al. Increased occurrence of autoimmune disease among women exposed in utero to diethylstilbestrol. Fertil. Steril 49, 1080–1082 (1988). [DOI] [PubMed] [Google Scholar]
- 14.Bern HA in Chemically-Induced Alterations in Sexual and Functional Development: The Wildlife/Human Connection (eds Colborn T & Clement C) 9–15 (Princeton Scientific, 1992). [Google Scholar]
- 15.Fox GA in Chemically Induced Alterations in Sexual and Functional Development: the Wildlife/Human Connection (eds Colborn T & Clement C) 147–158 (Princeton Scientific, 1992). [Google Scholar]
- 16.Ryan BC & Vandenbergh JG Intrauterine position effects. Neurosci. Biobehav. Rev 26, 665–678 (2002). [DOI] [PubMed] [Google Scholar]
- 17.vom Saal FS TRIENNIAL REPRODUCTION SYMPOSIUM: Environmental programming of reproduction during fetal life: effects of intrauterine position and the endocrine disrupting chemical bisphenol A. J. Anim. Sci 94, 2722–2736 (2016). [DOI] [PubMed] [Google Scholar]
- 18.Vandenberg LN et al. Exposure to environmentally relevant doses of the xenoestrogen bisphenol-A alters development of the fetal mouse mammary gland. Endocrinology 148, 116–127 (2007). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Guzelian PS Comparative toxicology of chlorodecone (kepone) in humans and experimental animals. Annu. Rev. Pharmacol. Toxicol 22, 89–113 (1982). [DOI] [PubMed] [Google Scholar]
- 20.Soto AM, Chung KL & Sonnenschein C The pesticides endosulfan, toxaphene, and dieldrin have estrogenic effects on human estrogen sensitive cells. Environ. Health Perspect 102, 380–383 (1994). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Soto AM et al. The E-SCREEN assay as a tool to identify estrogens: an update on estrogenic environmental pollutants. Environ. Health Perspect 103, 113–122 (1995). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Diamanti-Kandarakis E et al. Endocrine-disrupting chemicals: an Endocrine Society scientific statement. Endocr. Rev 30, 293–342 (2009). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Gore AC et al. EDC-2: the Endocrine Society’s second scientific statement on endocrine-disrupting chemicals. Endocr. Rev 36, E1–E150 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Zoeller RT et al. Endocrine-dsrupting chemicals and public health protection: a statement of principles from the Endocrine Society. Endocrinology 153, 4097–4110 (2012). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Armstrong DT, Moon YS & Leung PCK Uterotrophic effects of testosterone and 5à-dihydrotestosterone in intact and ovariectomized immature female rats. Biol. Reprod 15, 107–114 (1976). [DOI] [PubMed] [Google Scholar]
- 26.Zoeller RT, Bansal R & Parris C Bisphenol-A, an environmental contaminant that acts as a thyroid hormone receptor antagonist in vitro, increases serum thyroxine, and alters RC3/neurogranin expression in the developing rat brain. Endocrinology 146, 607–612 (2005). [DOI] [PubMed] [Google Scholar]
- 27.Fini JB et al. An in vivo multiwell-based fluorescent screen for monitoring vertebrate thyroid hormone disruption. Env. Sci. Technol 41, 5908–5914 (2007). [DOI] [PubMed] [Google Scholar]
- 28.Kurian JR et al. Acute influences of bisphenol A exposure on hypothalamic release of gonadotropin- releasing hormone and kisspeptin in female rhesus monkeys. Endocrinology 156, 2563–2570 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Speroni L et al. New insights into fetal mammary gland morphogenesis: differential effects of natural and environmental estrogens. Sci. Rep 7, 40806 (2017). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Camacho L et al. A two-year toxicology study of bisphenol A (BPA) in Sprague-Dawley rats: CLARITY-BPA core study results. Food Chem. Toxicol 132, 110728 (2019). [DOI] [PubMed] [Google Scholar]
- 31.Nadal A et al. Extranuclear-initiated estrogenic actions of endocrine disrupting chemicals: is there toxicology beyond paracelsus? J. Steroid Biochem. Mol. Biol 176, 16–22 (2018). [DOI] [PubMed] [Google Scholar]
- 32.Phoenix CH, Goy RW, Gerall AA & Young WC Organizing action of prenatally administered testosterone propionate on the tissues mediating mating behavior in the female guinea pig. Endocrinology 65, 369–382 (1959). [DOI] [PubMed] [Google Scholar]
- 33.Alonso-Magdalena P, Garcia-Arevalo M, Quesada I & Nadal A Bisphenol-A treatment during pregnancy in mice: a new window of susceptibility for the development of diabetes in mothers later in life. Endocrinology 156, 1659–1670 (2015). [DOI] [PubMed] [Google Scholar]
- 34.Ranciere F et al. Bisphenol A and the risk of cardiometabolic disorders: a systematic review with meta-analysis of the epidemiological evidence. Env. Health 14, 46 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Titus-Ernstoff L et al. Long-term cancer risk in women given diethylstilbestrol (DES) during pregnancy. Br. J. Cancer 84, 126–133 (2001). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Hoover RN et al. Adverse health outcomes in women exposed in utero to diethylstilbestrol. N. Engl. J. Med 365, 1304–1314 (2011). [DOI] [PubMed] [Google Scholar]
- 37.Cohn BA, Cirillo PM & Terry MB DDT and breast cancer: prospective study of induction time and susceptibility windows. J. Natl Cancer Inst 111, 803–810 (2019). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Sonnenschein C, Wadia PR, Rubin BS & Soto AM Cancer as development gone awry: the case for bisphenol-A as a carcinogen. J. Dev. Orig. Health Dis 2, 9–16 (2011). [Google Scholar]
- 39.Rubin BS et al. Evidence of altered brain sexual differentiation in mice exposed perinatally to low environmentally relevant levels of bisphenol A. Endocrinology 147, 3681–3691 (2006). [DOI] [PubMed] [Google Scholar]
- 40.Amara JF & Dannies PS 17β-Estradiol has a biphasic effect on GH cell growth. Endocrinology 112, 1141–1143 (1983). [DOI] [PubMed] [Google Scholar]
- 41.Sonnenschein C, Olea N, Pasanen ME & Soto AM Negative controls of cell proliferation: human prostate cancer cells and androgens. Cancer Res 49, 3474–3481 (1989). [PubMed] [Google Scholar]
- 42.Geck P, Maffini MV, Szelei J, Sonnenschein C & Soto AM Androgen-induced proliferative quiescence in prostate cancer: the role of AS3 as its mediator. Proc. Natl Acad. Sci. USA 97, 10185–10190 (2000). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Soto AM et al. Variants of the human prostate LNCaP cell line as a tool to study discrete components of the androgen-mediated proliferative response. Oncol. Res 7, 545–558 (1995). [PubMed] [Google Scholar]
- 44.Vandenberg LN et al. Hormones and endocrine disrupting chemicals: low dose effects and non-monotonic dose responses. Endocr. Rev 33, 378–455 (2012). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Cabaton NJ et al. Perinatal exposure to environmentally relevant levels of bisphenol-A decreases fertility and fecundity in CD-1 mice. Environ. Health Perspect 119, 547–552 (2011). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Villar-Pazos S et al. Molecular mechanisms involved in the non-monotonic effect of bisphenol-a on Ca2+ entry in mouse pancreatic β-cells. Sci. Rep 7, 11770 (2017). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Kortenkamp A, Faust M, Scholze M & Backhaus T Low-level exposure to multiple chemicals: reason for human health concerns? Environ. Health Perspect 115, 106–114 (2007). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Isling LK et al. Late-life effects on rat reproductive system after developmental exposure to mixtures of endocrine disrupters. Reproduction 147, 465–476 (2014). [DOI] [PubMed] [Google Scholar]
- 49.Pastor-Barriuso R et al. Total effective xenoestrogen burden in serum samples and risk for breast cancer in a population-based multicase-control study in Spain. Env. Health Perspect 124, 1575–1582 (2016). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Stormshak F, Leake R, Wertz N & Gorski J Stimulatory and inhibitory effects of estrogen on uterine DNA synthesis. Endocrinology 99, 1501–1511 (1976). [DOI] [PubMed] [Google Scholar]
- 51.Bruchovsky N, Lesser B, Van Doorn E & Craven S Hormonal effects on cell proliferation in rat prostate. Vitam. Hormones 33, 61–102 (1975). [DOI] [PubMed] [Google Scholar]
- 52.Maffini MV, Geck P, Powell CE, Sonnenschein C & Soto AM Mechanism of androgen action on cell proliferation AS3 protein as a mediator of proliferative arrest in the rat prostate. Endocrinology 143, 2708–2714 (2002). [DOI] [PubMed] [Google Scholar]
- 53.Soto AM & Sonnenschein C The two faces of Janus: sex steroids as mediators of both cell proliferation and cell death. J. Natl Cancer Inst 93, 1673–1675 (2001). [DOI] [PubMed] [Google Scholar]
- 54.Kang YH, Anderson WA & DeSombre ER Modulation of uterine morphology and growth by estradiol-17beta and an estrogen antagonist. J. Cell Biol 64, 682–691 (1975). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Martin L, Finn CA & Trinder G Hypertrophy and hyperplasia in the mouse uterus after oestrogen treatment: an autoradiographic study. J. Endocrinol 56, 133–144 (1973). [DOI] [PubMed] [Google Scholar]
- 56.Schaison G & Couzinet B Steroid control of gonadtropin secretion. J. Steroid Biochem. Mol. Biol 40, 417–420 (1991). [DOI] [PubMed] [Google Scholar]
- 57.Bronson FH The regulation of luteinizing hormone secretion by estrogen: relationships among negative feedback, surge potential, and male stimulation in juvenile, peripubertal, and adult female mice. Endocrinology 108, 506–516 (1981). [DOI] [PubMed] [Google Scholar]
- 58.Liu X, Porteous R & Herbison AE Dynamics of GnRH neuron ionotropic GABA and glutamate synaptic receptors are unchanged during estrogen positive and negative feedback in female mice. eNeuro 4, 1–14 (2017). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Huggins C, Moon RC & Morii S Extinction of experimental mammary cancer. I. Estradiol-17β and progesterone. Proc. Natl Acad. Sci. USA 48, 379–386 (1962). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Palmer JR et al. Prenatal diethylstilbestrol exposure and risk of breast cancer. Cancer Epidemiol. Biomarkers Prev 15, 1509–1514 (2006). [DOI] [PubMed] [Google Scholar]
- 61.Ingle JN, Ahman DL & Green SJ Randomized clinical trial of DES versus tamoxifen in post-menopausal women with advanced breast cancer. N. Engl. J. Med 304, 16–21 (1981). [DOI] [PubMed] [Google Scholar]
- 62.Goldenberg IS Results of studies of the Cooperative Breast Cancer Group 1961–1963. Cancer Chemotherapy Rep 41, 1–24 (1964). [PubMed] [Google Scholar]
- 63.Khandekar JD, Victor TA & Mukhopadhyaya P Endometrial carcinoma following estrogen therapy for breast cancer. Report of three cases. Arch. Intern. Med 138, 539–541 (1978). [PubMed] [Google Scholar]
- 64.O’Grady WP & McDivitt RW Breast cancer in a man treated with diethylstilbestrol. Arch. Pathol 88, 162–165 (1969). [PubMed] [Google Scholar]
- 65.Colborn T, Dumanoski D & Myers JP Our Stolen Future (Penguin, 1995). [Google Scholar]
- 66.Gioiosa L, Palanza P, Parmigiani S & vom Saal FS Risk evaluation of endocrine-disrupting chemicals: effects of developmental exposure to low doses of bisphenol A on behavior and physiology in mice (Mus musculus). Dose Response 13, 1559325815610760 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Timms BG et al. Estrogenic chemicals in plastic and oral contraceptives disrupt development of the fetal mouse prostate and urethra. Proc. Natl Acad. Sci. USA 102, 7014–7019 (2005). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.vom Saal FS et al. A physiologically based approach to the study of bisphenol A and other estrogenic chemicals on the size of reproductive organs, daily sperm production, and behavior. Toxicol. Ind. Health 14, 239–260 (1998). [DOI] [PubMed] [Google Scholar]
- 69.Ho SM, Tang WY, Belmonte de Frausto J & Prins GS Developmental exposure to estradiol and bisphenol A increases susceptibility to prostate carcinogenesis and epigenetically regulates phosphodiesterase type 4 variant 4. Cancer Res 66, 5624–5632 (2006). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Soto AM & Sonnenschein C Reductionism, organicism, and causality in the biomedical sciences: a critique. Perspect. Biol. Med 61, 489–502 (2018). [DOI] [PubMed] [Google Scholar]
- 71.Longo G, Miquel PA, Sonnenschein C & Soto AM Is information a proper observable for biological organization? Prog. Biophys. Mol. Biol 109, 108–114 (2012). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Gilbert SF Developmental plasticity and developmental symbiosis: the return of eco-devo. Curr. Top. Dev. Biol 116, 415–433 (2016). [DOI] [PubMed] [Google Scholar]
- 73.Nicholson DJ Is the cell really a machine? J. Theor. Biol 477, 108–126 (2019). [DOI] [PubMed] [Google Scholar]
- 74.Nicholson DJ The concept of mechanism in biology. Stud. Hist. Philos. Biol. Biomed. Sci 43, 152–163 (2012). [DOI] [PubMed] [Google Scholar]
- 75.Laland K et al. Does evolutionary theory need a rethink? Nature 514, 161–164 (2014). [DOI] [PubMed] [Google Scholar]
- 76.Bateson P Developmental plasticity and evolutionary biology. J. Nutr 137, 1060–1062 (2007). [DOI] [PubMed] [Google Scholar]
- 77.Ankley GT et al. Adverse outcome pathways: a conceptual framework to support ecotoxicology research and risk assessment. Env. Toxicol. Chem 29, 730–741 (2010). [DOI] [PubMed] [Google Scholar]
- 78.Leist M et al. Adverse outcome pathways: opportunities, limitations and open questions. Arch. Toxicol 91, 3477–3505 (2017). [DOI] [PubMed] [Google Scholar]
- 79.Lesne A Multiscale analysis of biological systems. Acta Biotheoretica 61, 3–19 (2013). [DOI] [PubMed] [Google Scholar]
- 80.La Merrill MA et al. Consensus on the key characteristics of endocrine-disruption chemicals as a basis for hazard indentification. Nat. Rev. Endocrinol 16, 45–57 (2020). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Soto AM, Longo G & Noble D From the century of the genome to the century of the organism: new theoretical approaches. Prog. Biophys. Mol. Biol 122, 1–82 (2016). [DOI] [PubMed] [Google Scholar]
- 82.Soto AM et al. Toward a theory of organisms: three founding principles in search of a useful integration. Prog. Biophys. Mol. Biol 122, 77–82 (2016). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Myers JP et al. Why public health agencies cannot depend on good laboratory practices as a criterion for selecting data: the case of bisphenol A. Environ. Health Perspect 117, 309–315 (2009). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Vandenberg LN et al. Regulatory decisions on endocrine disrupting chemicals should be based on the principles of endocrinology. Reprod.Toxicol 38, 1–15 (2013). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Beausoleil C et al. Regulatory identification of BPA as an endocrine disruptor: context and methodology. Mol. Cell Endocrinol 475, 4–9 (2018). [DOI] [PubMed] [Google Scholar]
- 86.Schug TT et al. A new approach to synergize academic and guideline-compliant research: the CLARITY-BPA research program. Reprod. Toxicol 40, 35–40 (2013). [DOI] [PubMed] [Google Scholar]
- 87.Heindel JJ et al. NIEHS/FDA CLARITY-BPA research program update. Reprod. Toxicol 58, 33–44 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Prins GS et al. Prostate cancer risk and DNA methylation signatures in aging rats following developmental BPA exposure: a dose-response analysis. Env. Health Perspect 125, 077007 (2017). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Heindel JJ et al. Data integration, analysis, and interpretation of eight academic CLARITY-BPA studies. Reprod. Toxicol 98, 29–60 (2020). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Tremblay-Franco M et al. Dynamic metabolic disruption in rats perinatally exposed to low doses of bisphenol-A. PLoS ONE 10, e0141698 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Rubin BS et al. Perinatal BPA exposure alters body weight and composition in a dose specific and sex specific manner: the addition of peripubertal exposure exacerbates adverse effects in female mice. Reprod. Toxicol 68, 130–144 (2017). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Vandenberg LN, Hunt PA & Gore AC Endocrine disruptors and the future of toxicology testing – lessons from CLARITY-BPA. Nat. Rev. Endocrinol 15, 366–374 (2019). [DOI] [PubMed] [Google Scholar]
- 93.Montévil M et al. A combined morphometric and statistical approach to assess nonmonotonicity in the developing mammary gland of rats in the CLARITY-BPA study. Env. Health Perspect 128, 57001 (2020). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Soto AM & Sonnenschein C Endocrine disruptors – putting the mechanistic cart before the phenomenological horse. Nat. Rev. Endocrinol 14, 317–318 (2018). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 95.Zoeller RT & Vandenberg LN Assessing dose-response relationships for endocrine disrupting chemicals (EDCs): a focus on non-monotonicity. Env. Health 14, 42 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Sonnenschein C & Soto AM Over a century of cancer research: inconvenient truths and promising leads. PLoS Biol 18, e3000670 (2020). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Speroni L et al. Hormonal regulation of epithelial organization in a 3D breast tissue culture model. Tissue Eng. C Methods 20, 42–51 (2014). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.Paulose T, Speroni L, Sonnenschein C & Soto AM Estrogens in the wrong place at the wrong time: fetal BPA exposure and mammary cancer. Reprod. Toxicol 54, 58–65 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 99.Sonnenschein C & Soto AM Carcinogenesis explained within the context of a theory of organisms. Prog. Biophys. Mol. Biol 122, 70–76 (2016). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100.Montévil M, Speroni L, Sonnenschein C & Soto AM Modeling mammary organogenesis from biological first principles: cells and their physical constraints. Prog. Biophys. Mol. Biol 122, 58–69 (2016). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Bich L, Mossio M & Soto AM Glycemia regulation: from feedback loops to organizational closure. Front. Physiol 11, 69 (2020). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102.European Commission. Communication from the Commission to the European Parliament, the Council, the European Economic and Social Committee and the Committee of the Regions: Chemicals strategy for sustainability towards a toxic-free environment https://ec.europa.eu/environment/pdf/chemicals/2020/10/Strategy.pdf (2020).
- 103.Howdeshell KL, Hotchkiss AK, Thayer KA, Vandenbergh JG & vom Saal FS Exposure to bisphenol A advances puberty. Nature 401, 763–764 (1999). [DOI] [PubMed] [Google Scholar]
- 104.Honma S et al. Low dose effects of in utero exposure to bisphenol A and diethylstilbestrol on female mouse reproduction. Reprod. Toxicol 16, 117–122 (2002). [DOI] [PubMed] [Google Scholar]
- 105.Cunha GR et al. New approaches for estimating risk from exposure to diethylstilbestrol. Environ. Health Perspect 107, 625–630 (1999). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 106.Rubin BS, Murray MK, Damassa DA, King JC & Soto AM Perinatal exposure to low doses of bisphenol-A affects body weight, patterns of estrous cyclicity and plasma LH levels. Environ. Health Perspect 109, 675–680 (2001). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 107.Hatch EE et al. Age at natural menopause in women exposed to diethylstilbestrol in utero. Am. J. Epidemiol 164, 682–688 (2006). [DOI] [PubMed] [Google Scholar]
- 108.Markey CM, Wadia PR, Rubin BS, Sonnenschein C & Soto AM Long-term effects of fetal exposure to low doses of the xenoestrogen bisphenol-A in the female mouse genital tract. Biol. Reprod 72, 1344–1351 (2005). [DOI] [PubMed] [Google Scholar]
- 109.Yamamoto M et al. Effects of maternal exposure to diethylstilbestrol on the development of the reproductive system and thyroid function in male and female rat offspring. J. Toxicol. Sci 28, 385–394 (2003). [DOI] [PubMed] [Google Scholar]
- 110.Register B et al. The effect of neonatal exposure to diethylstilbestrol, coumestrol, and beta-sitosterol on pituitary responsiveness and sexually dimorphic nucleus volume in the castrated adult rat. Proc. Soc. Exp. Biol. Med 208, 72–77 (1995). [DOI] [PubMed] [Google Scholar]
- 111.Vandenberg LN et al. The mammary gland response to estradiol: monotonic at the cellular level, non-monotonic at the tissue-level of organization? J. Steroid Biochem. Mol. Biol 101, 263–274 (2006). [DOI] [PubMed] [Google Scholar]
- 112.Wadia PR et al. Perinatal bisphenol-A exposure increases estrogen sensitivity of the mammary gland in diverse mouse strains. Environ. Health Perspect 115, 592–598 (2007). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 113.Newbold RR, Jefferson WN, Padilla-Banks E & Haseman J Developmental exposure to diethylstilbestrol (DES) alters uterine response to estrogens in prepubescent mice: low versus high dose effects. Reprod. Toxicol 18, 399–406 (2004). [DOI] [PubMed] [Google Scholar]
- 114.Angle BM et al. Metabolic disruption in male mice due to fetal exposure to low but not high doses of bisphenol A (BPA): evidence for effects on body weight, food intake, adipocytes, leptin, adiponectin, insulin and glucose regulation. Reprod. Toxicol 42, 256–268 (2013). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 115.Shimpi PC et al. Hepatic lipid accumulation and Nrf2 expression following perinatal and peripubertal exposure to bisphenol A in a mouse model of nonalcoholic liver disease. Env. Health Perspect 125, 087005 (2017). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 116.Cabaton NJ et al. Effects of low doses of bisphenol A on the metabolome of perinatally exposed CD-1 mice. Environ. Health Perspect 121, 586–593 (2013). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 117.Alonso-Magdalena P, Quesada I & Nadal Á Prenatal exposure to BPA and offspring outcomes: the diabesogenic behavior of BPA. Dose Response 13, 1559325815590395 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 118.Palanza P, Nagel SC, Parmigiani S & vom Saal FS Perinatal exposure to endocrine disruptors: sex, timing and behavioral endpoints. Curr. Opin. Behav. Sci 7, 69–75 (2016). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 119.Palanza P, Parmigiani S, Liu H & vom Saal FS Prenatal exposure to low doses of the estrogenic chemicals diethylstilbestrol and o,p′-DDT alters aggressive behavior of male and female house mice. Pharmacol. Biochem. Behav 64, 665–672 (1999). [DOI] [PubMed] [Google Scholar]
- 120.Hunt PA et al. Bisphenol A exposure causes meiotic aneuploidy in the female mouse. Curr. Biol 13, 546–553 (2003). [DOI] [PubMed] [Google Scholar]
- 121.Munoz de Toro MM et al. Perinatal exposure to bisphenol A alters peripubertal mammary gland development in mice. Endocrinology 146, 4138–4147 (2005). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 122.Markey CM, Luque EH, Munoz de Toro MM, Sonnenschein C & Soto AM In utero exposure to bisphenol A alters the development and tissue organization of the mouse mammary gland. Biol. Reprod 65, 1215–1223 (2001). [DOI] [PubMed] [Google Scholar]
- 123.Bern HA, Mills KT, Hatch DL, Ostrander PL & Iguchi T Altered mammary responsiveness to estradiol and progesterone in mice exposed neonatally to diethylstilbestrol. Cancer Lett 63, 117–124 (1992). [DOI] [PubMed] [Google Scholar]
- 124.Hovey RC et al. Effects of neonatal exposure to diethylstilbestrol, tamoxifen, and toremifene on the BALB/c mouse mammary gland. Biol. Reprod 72, 423–435 (2005). [DOI] [PubMed] [Google Scholar]
- 125.Acevedo N, Rubin BS, Schaeberle CM & Soto AM Perinatal BPA exposure and reproductive axis function in CD-1 mice. Reprod. Toxicol 79, 39–46 (2018). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 126.Newbold RR et al. Increased tumors but uncompromised fertility in the female descendants of mice exposed developmentally to diethlystilbestrol. Carcinogenesis 19, 1655–1663 (1998). [DOI] [PubMed] [Google Scholar]
- 127.Murray TJ, Maffini MV, Ucci AA, Sonnenschein C & Soto AM Induction of mammary gland ductal hyperplasias and carcinoma in situ following fetal bisphenol A exposure. Reprod. Toxicol 23, 383–390 (2007). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 128.Acevedo N, Davis B, Schaeberle CM, Sonnenschein C & Soto AM Perinatally administered bisphenol A as a potential mammary gland carcinogen in rats. Env. Health Perspect 121, 1040–1046 (2013). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 129.Rothschild TC, Boylan ES, Calhoon RE & Vonderhaar BK Transplacental effects of diethylstilbestrol on mammary development and tumorigenesis in female ACI rats. Cancer Res 47, 4508–4516 (1987). [PubMed] [Google Scholar]
- 130.Newbold RR, Jefferson WN & Padilla-Banks E Long-term adverse effects of neonatal exposure to bisphenol A on the murine female reproductive tract. Reprod. Toxicol 24, 253–258 (2007). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 131.Wolstenholme JT, Goldsby JA & Rissman EF Transgenerational effects of prenatal bisphenol A on social recognition. Horm. Behav 64, 833–839 (2013). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 132.Ziv-Gal A, Wang W, Zhou C & Flaws JA The effects of in utero bisphenol A exposure on reproductive capacity in several generations of mice. Toxicol. Appl. Pharmacol 284, 354–362 (2015). [DOI] [PMC free article] [PubMed] [Google Scholar]
Tradução livre, parcial, de Luiz Jacques Saldanha, março de 2025


